蒿属植物提取物对畜禽抗氧化及抗炎功能的研究进展
2022-11-04李书仪史彬林赵艳丽闫素梅
李书仪 史彬林 赵艳丽 闫素梅
(内蒙古农业大学 动物科学学院/动物营养与饲料科学自治区高等学校重点实验室,呼和浩特 010018)
随着人们生活水平的不断提高,食品安全已经成为世界各国备受关注的焦点问题。研究发现,抗生素是抑制或杀灭细菌、真菌、螺旋体、支原体和衣原体等致病微生物繁殖的有效药物,然而抗生素在医学及农业生产中的大规模使用催生了细菌耐药性在环境中的快速扩散和传播,特别是多种抗生素的联合使用更是促进了多重耐药性的产生,严重威胁着人类和畜禽健康及食品与环境安全,而欧洲国家(瑞典)早在1986年就已实行禁抗措施[1]。我国农业农村部2020年7月份颁布全面禁抗指令,要竭力做到饲料端禁抗、养殖端限抗、食品端无抗,因此寻找天然安全的饲料添加剂以促进畜禽抗氧化和免疫功能、抑制肿瘤细胞增殖、改善畜禽生长、替代抗生素以及环境的保护已然成为动物营养领域的核心问题[2]。
我国蒿属植物资源丰富,因其具有清热解毒、抗菌消炎的功效,临床上主要用于治疗疟疾、痛经、闭经等病症,其次生代谢产物(多糖、黄酮和挥发油等成分)具有较高的研究价值[3]。大量研究表明,蒿属植物提取物在增强畜禽抗氧化[4]和抗炎[5]方面发挥重要作用,改善了畜禽的健康状况[6-9],是目前最具有潜力的抗生素替代品之一。然而,氧化应激、炎症反应和免疫失衡是一个联动反应,在这个反应中的每一个环节都不是孤立的,而是某一个环节的诱发会引起整个链条产生整体联动反应,甚至出现叠加效应[10],说明蒿属植物提取物对畜禽机体抗氧化及抗炎功能的作用机制是多条信号通路协同作用产生的,例如蒿属植物提取物通过激活核转录因子E2相关因子2(Nuclear factor erythroid 2-related factor 2,Nrf2)和核转录因子-κB(Nuclear transcription factor-κB,NF-κB)信号通路,促进抗氧化酶的表达和抑制炎症因子的生成,进而缓解机体的氧化应激和炎症反应。此外,蒿属植物提取物对肿瘤细胞的凋亡也具有促进作用,其可能机制是通过促进肿瘤细胞活性氧(Activated oxygen,ROS)的生成,或经线粒体途径活化半胱胺酸天冬氨酸特异性蛋白酶(Caspase)家族和紊乱细胞周期等方式抑制肿瘤细胞增殖[11]。
近年来,已有国内外学者总结了蒿属植物提取物活性成分的提取工艺及抑菌活性的研究进展[12-14],并阐述了其在畜禽健康中的应用[15],但对于其发挥的抗氧化和抗炎机制及其抗肿瘤活性进行综合论述的文献相对较少。因此,本综述基于Nrf2和NF-κB信号通路对蒿属植物提取物的抗氧化和抗炎机制进行了系统梳理,分析蒿属植物提取物发挥抗肿瘤活性的可能机制,展望蒿属植物提取物的未来研究方向,以期为今后蒿属植物提取物相关研究及应用提供参考。
1 蒿属植物提取物促进畜禽机体的抗氧化和抗炎功能
氧化应激是指机体遭受到体内外各种有害刺激时,氧化系统与抗氧化系统失衡的一种状态,体内过多的自由基蓄积是造成氧化应激的主要原因,如ROS和活性氮(Activated nitrogen,RNS),若自由基得不到及时清除,也可导致机体免疫失衡,而免疫失衡的形成会进一步加剧氧化应激,造成恶性循环,进而导致畜禽健康状况和经济效益下降。有研究表明,蒿属植物提取物可提高畜禽的抗氧化及抗炎功能,即减轻畜禽的氧化应激和炎症反应,从而使机体恢复免疫平衡稳态[16]。表1汇总了添加不同蒿属植物提取物对断奶仔猪、小白鼠、肉鸡和蛋鸡抗氧化、抗炎功能的促进效果。
大量国内外研究资料表明,在非应激状态下,蒿属植物提取物通过增加畜禽抗氧化酶、炎症因子的活性及含量对畜禽的生产性能起到积极作用;而在应激状态下,蒿属植物提取物通过提高抗氧化酶的活性和降低炎症因子的含量,使得机体恢复免疫平衡稳态,改善了畜禽的健康状况。由表1总结可知,蒿属植物提取物作为饲料添加剂可有效提高畜禽的抗氧化与抗炎功能。Xing等[6]研究发现,黑沙蒿水提物(750 mg/kg)的添加可显著增加血清总抗氧化能力(Total antioxidant capacity,T-AOC)和炎症因子白介素-1(Interleukin-1,IL-1)、白介素-2(Interleukin-2,IL-2)、白介素-4(Interleukin-4,IL-4)、白介素-6(Interleukin-6,IL-6)和肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)的浓度,显著降低血清丙二醛(Malondialdehyde,MDA)的含量,说明黑沙蒿水提物在非应激状态下,通过增加抗氧化酶和炎症因子的活性及含量,进而增强断奶仔猪的抗氧化与抗炎功能,这与郭世伟等[17]在小白鼠饲粮中添加黑沙蒿水提物的试验结果类似,黑沙蒿水提物的添加提高了小白鼠的抗氧化和免疫水平,且增加了其对Ca和P的表观消化率。Baghban-kanani等[18]在蛋鸡基础日粮添加7.5%的青蒿(Artemisiaannua)叶对其血浆抗氧化状态、蛋黄颜色指数和蛋壳厚度具有积极影响,且显著降低血浆胆固醇含量和动脉粥样硬化指数。Yang等[19]研究指出,艾蒿(Artemisiaargyi)黄酮显著提高了LPS刺激下21和35 d肉鸡的体重,缓解了LPS(500 μg/kg)刺激下肉鸡平均日增重(Average daily gain,ADG)的下降,显著降低LPS诱导肉鸡肝、脾组织中IL-1β和IL-6浓度,IL-1β和NF-κB的mRNA表达显著降低,提示艾蒿黄酮在应激状态通过降低炎症因子的生成,进而缓解LPS刺激下免疫机能的下降。Song等[20]也得出类似结果,其通过建立热应激((34±1) ℃,8 h)模型,引起肉鸡肠道形态损伤,而添加酶处理的青蒿(Enzymatically treatedArtemisiaannua,1 000 mg/kg)可逆转以上情况,减轻热应激引起的肠道脂肪酶、胰蛋白酶、超氧化物歧化酶(Superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)的活性降低,降低了肠道分泌性球蛋白A(Secretory immunoglobulin A,SIgA)、免疫球蛋白G(Immunoglobulin G,IgG)和MDA的浓度,增加了肠道Nrf2、血红素氧合酶-1(Heme oxygenase 1,HO-1)和GSH-Px的mRNA丰度,说明青蒿提取物在热应激状态下,通过增加抗氧化酶的活性和降低炎症因子的含量,进而缓解热应激引起的肉鸡肠道损伤。

表1 蒿属植物提取物对畜禽机体抗氧化和抗炎功能影响的相关研究Table 1 Correlative research on the effects of Artemisia plant extracts on antioxidant and anti-inflammatory functions of livestock and poultry
2 蒿属植物提取物促进畜禽机体抗氧化及抗炎功能的作用机制
氧化还原稳态失衡的原因可能是机体抗氧化防御体系的衰减、体内自由基的过量累积或两者的共同作用。研究表明,蒿属植物提取物可激活多条信号通路(Nrf2、NF-κB),在多条信号通路的协同作用下,上调了抗氧化酶的表达和抑制了NO的生成,进而减少机体氧化应激和炎症反应的发生。
2.1 蒿属植物提取物促进畜禽机体抗氧化功能的作用机制

2.1.1通过螯合金属离子或增加铁离子还原力减少自由基的生成
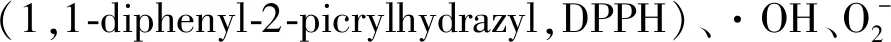
2.1.2通过Keap1-Nrf2/ARE上调抗氧化酶的表达
Nrf2是体内内源性诱导防御系统的关键调控因子,其通过启动机体抗氧化及抗炎等保护性基因转录,从而增强机体抵御氧化应激、发挥药物代谢和抗炎症反应等功能[26]。Keap1-Nrf2/ARE信号通路在机体抗氧化系统中发挥着重要作用。当机体处于氧化应激状态时,Nrf2与Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)解离从胞质入核,Nrf2与其下游抗氧化反应原件(Anti-oxidative response element,ARE)结合,增强序列启动细胞保护基因(HO-1等)的转录[27]。有研究发现,蒿属植物提取物被称为ARE激活剂,其通过激活Keap1-Nrf2系统防止氧化应激诱导的细胞损伤[28]。Lee等[29]从艾蒿提取物分离出的倍半萜3-epi-iso-seco-tanapartholide 通过促进了Nrf2核易位,上调HO-1基因及蛋白表达,进而有效预防碘克沙醇诱导的肾上皮细胞死亡。研究表明,在绒山羊基础饲粮中添加3%的黑沙蒿粉可增加GPX、CAT等抗氧化酶基因和Nrf2基因的表达,这表明Nrf2信号通路的激活可增强其下游抗氧化酶的基因表达,从而改善绒山羊的抗氧化功能[30]。这与Xing等[31]在肉鸡上的研究结果类似,其通过在肉鸡腹腔注射LPS(10 mg/kg)后,导致T-AOC、SOD、CAT和GPX等抗氧化酶活性及Nrf2的mRNA表达降低,Keap1基因及蛋白表达显著增加,而黑沙蒿水提物(750 mg/kg)的添加可逆转以上情况,提示黑沙蒿水提物通过抑制Keap1基因及蛋白的过表达,激活Nrf2-ARE信号通路,导致其下游抗氧化酶的活性增加,进而减轻LPS对肉鸡造成的氧化应激反应。此外,Sajjad等[32]利用杏仁蒿(Artemisiaamygdalina)提取物(100 μg/mL)对H2O2诱导的神经细胞(SH-SY5Y)进行预处理,其ROS显著降低,上调HO-1蛋白表达,细胞核的Nrf2数量显著高于胞质内,且呈剂量依赖性的上升,说明杏仁蒿提取物通过促进Nrf2与Keap1的解离,并转移入核与ARE结合,进而缓解H2O2刺激下抗氧化机能的下降。
2.1.3通过PI3K/Akt-Keap1-Nrf2/ARE上调抗氧化酶的表达
PI3K是一种胞内磷脂酰肌醇激酶,既具有磷脂酰肌醇酶活性,也具有丝/苏氨酸激酶活性。ROS通过激活受体酪氨酸激酶EGFR、anexelekto(Axl)等使磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K)活化,将磷脂酰肌醇-4,5-二磷酸(PIP2)转化成磷脂酰肌醇-1,4,5-三磷酸(PIP3),从而活化3-磷酸肌醇依赖性激酶1(PDK1),活化后的PDK1磷酸化Akt的Thr308和Ser473位点,而Akt的活化进一步激活下游因子Nrf2,促使Nrf2从Keap1解离,从而使Nrf2的核转位增多,与ARE的结合能力增强,即激活 Nrf2下游靶基因表达[33]。研究发现,在2型糖尿病小鼠饲粮中添加青蒿素(Artemisinin,40 mg/kg)后,可显著提高小鼠海马组织的PI3K、AKT磷酸化水平,增强Nrf2与ARE的结合能力、Akt水平和突触后膜致密物蛋白-95(PSD-95)的mRNA表达,从而改善机体的抗氧化功能和认知障碍[34]。这与Song等[35]的研究结果类似,其利用2 mmol/L吲哚美辛处理猫食管上皮细胞建立氧化应激模型,将青蒿中提取的一种黄酮类化合物异泽兰黄素(Eupatilin)添加到细胞后,Eupatilin通过诱导Akt 磷酸化,并增加Nrf2核易位,导致HO-1含量增加,而HO-1数量的增加代表着细胞抵御氧化应激的能力增强,提示Eupatilin通过激活PI3K/AKT信号途径可进一步活化Nrf2通路,进而减轻吲哚美辛诱导的细胞损伤。
2.2 蒿属植物提取物促进畜禽机体抗炎功能的作用机制
氧化应激的发生通常伴随着炎症反应,即Nrf2与NF-κB信号通路在维持机体氧化还原平衡中存在互作关系[36],当机体处于轻度氧化应激状态,通过激活Nrf2信号通路来提高机体的抗氧化防御系统,而Nrf2基因缺陷时更容易激活NF-κB通路,从而诱导炎症和氧化应激增加。研究发现,蒿属植物提取物激活Nrf2信号通路后,其代谢产物HO-1、GPX可抑制NF-κB磷酸化,进而减少炎症因子的生成,从而缓解氧化应激反应导致的生产性能降低[37]。NO是具有简单结构和小分子量的RNS自由基。Han等[38]研究发现,LPS显著诱导巨噬细胞(RAW264.7)NF-κB信号通路的激活,使得炎症介质IL-6、TNF-α的mRNA表达上调,炎性介质的表达可介导iNOS和NO的过量生成,而NO的过量生成可引发细胞自由基失衡,诱发氧化应激,加速炎症反应的发生,进而导致机体损伤,提示NF-κB信号通路是炎症反应的核心。因此,本文从以下信号通路综述了蒿属植物提取物通过抑制NF-κB信号通路,达到减少NO生成的效果。
2.2.1通过HO-1/GPX-NF-κB途径抑制过量NO的生成
氧化应激的发生通常伴随着炎症反应,即Nrf2与NF-κB信号通路之间可进行相互调节,其中Nrf2下游靶基因HO-1的表达是Nrf2介导NF-κB活性抑制的重要途径[39]。在氧化应激状态下,磷酸化的抑制蛋白κB(Inhibitory κB,IκB)与NF-κB解离,NF-κB从细胞质转移入核后与转录因子结合,进而启动炎症反应,促使炎症因子如1L-1β生成,而1L-1β可刺激iNOS持续表达并生成过量NO,从而加重机体的氧化应激[40]。研究表明,LPS(3%)显著诱导RAW264.7细胞中NO的过量生成,并激活了NF-κB信号通路,然而艾蒿乙醇提取物的添加通过激活Nrf2通路,显著增加其下游靶基因HO-1基因及蛋白表达,进而抑制LPS诱导NF-κB的核转录,降低了NO、iNOS、环氧合酶-2(Cyclooxygenase-2,COX2)和前列腺素E2(Prostaglandin E2,PGE2)等炎症因子的产生[41]。这与Liu等[42]的体内试验结果类似,青蒿琥酯通过激活HO-1途径减弱了肾缺血再灌注损伤诱导的肺部组织NF-κB磷酸化,结果显示,与对照组相比,青蒿琥酯(15 mg/kg)可显著降低大鼠血清和肺中MDA、IL-6 和NO含量,说明HO-1途径的激活可抑制NF-κB信号通路的活化。黑沙蒿水提物通过增强肝脏GPx的活性,缓解了断奶仔猪的炎症反应[6]。GPx属于抗氧化酶家族,是畜禽体内一类重要的含硒酶,其可通过调节NF-κB信号通路,进而抑制炎症诱发的免疫病理过程。Li等[43]研究指出,GPx的过表达可抑制NF-κB磷酸化,而利用Nrf2 siRNA和GPx抑制剂进行预处理,可激活NF-κB信号通路,增加其下游炎症因子的基因及蛋白表达,促使iNOS和NO的过量生成,提示NF-κB是GPx介导炎症反应减少的潜在靶点。以上研究表明,蒿属植物提取物通过HO-1/GPX途径抑制 NF-κB信号通路,进而减缓机体氧化应激和炎症反应的发生。
但是当机体处于较强烈或较长时间的应激时,氧化应激的因子(ROS和RNS)主要通过Toll样受体4(Toll-like receptors 4,TLR4)识别并启动炎症反应的可能性更大,而TLR4信号级联中主要包括NF-κB、丝裂原活化蛋白激酶(Mitogen-activated protein kinases,MAPKs)等信号通路[44-45]。因此,蒿属植物提取物通过抑制TLR4/ NF-κB及TLR4介导的MAPK/ NF-κB信号通路缓解炎症反应导致的畜禽生产性能下降。
2.2.2通过TLR4/ NF-κB途径抑制过量NO的生成
病原微生物或损伤相关分子的存在可激活Toll样受体(Toll-like receptors,TLR),进而启动对外界感染或组织损伤的先天免疫应答反应,其主要分布在固有免疫细胞表面。TLR4能够识别LPS的刺激,活化的TLR4招募胞内髓样分化初级应答基因88(Myeloid differentiation factor 88,MyD88),并将刺激信号向下转导给TNF受体相关因子(Tnf receptor associated factors,TRAFs),TRAF6进一步激活NF-κB信号通路,促进炎症反应的发生[46]。有研究指出,蒿属植物提取物能够有效抑制TLR4/NF-κB炎症信号通路的激活,进而抑制Th1型炎症介质的分泌。Lai等[47]研究发现,青蒿琥酯通过抑制TLR-4/NF-κB信号通路来缓解小鼠的肝纤维,青蒿琥酯(28.8 mg/kg)下调α-平滑肌肌动蛋白(Alpha-smooth muscle actin,α-SMA)、TLR4、MyD88和转化生长因子β1(Transforming growth factor beta1,TGF-β1)的mRNA和蛋白表达,通过降低小鼠血清LPS、TNF-α和IL-6浓度,上调免疫系统活性,进而改善多种因素和炎症反应引起的肝纤维化。这与杨硕[48]的研究结果类似,其利用LPS(10 μg/mL)诱导淋巴细胞建立免疫应激模型,并分别用NF-κB抑制剂PDTC(10 μmol/mL)和艾蒿黄酮(100 μg/mL)进行处理30.5 h后,与LPS模型组相比,LPS+PDTC组与LPS+艾蒿黄酮组的作用效果一致,说明艾蒿黄酮通过抑制NF-κB信号通路,减少上游相关基因(TLR4、MyD88、NF-κBp65和NF-κBp50)及下游炎症因子(IL-1β、IL-6)的mRNA表达,并显著降低了NF-κB p65的蛋白表达,进而发挥抗炎作用。此外,Xing等[31]研究结果表明,黑沙蒿水提物(750 mg/kg)通过抑制TLR4/NF-κB信号通路,导致其下游的炎症因子IL-1β和IL-6的mRNA表达降低,而IL-1β的释放介导iNOS的表达和NO的增加,说明黑沙蒿水提物通过TLR4/NF-κB信号通路降低炎症因子的分泌,进而缓解肉鸡经LPS(10 mg/kg)诱导的氧化应激反应。
2.2.3通过MAPK-NF-κB途径抑制过量NO的生成
丝裂原活化蛋白激酶(MAPKs)是细胞外信号从细胞表面传递到细胞核内部的重要传递者,主要由细胞外信号调节激酶(Extracellular signal regulated kinase,ERK)、c-jun氨基末端激酶(c-Jun n-terminal kinase,JNK)和p38组成[49]。MAPK蛋白(JNK、ERK和P38激酶)参与信号转导级联反应,而NF-κB信号通路的激活也受到MAPK蛋白磷酸化水平的调控,且MAPK-NF-κB信号通路是抑制Th1型细胞极化的关键转录因子。Kim等[50]利用LPS(30 ng/mL)诱导巨噬细胞(J774A.1)建立氧化应激模型,导致ERK1/2和p38的磷酸化,提示MAPK信号通路被激活,而MAPK信号通路的激活进一步诱导NF-κB通路的活化,促使炎症因子的生成,而亚洲蒿(Artemisiaasiaticanakai)提取物(50 μg/mL)的添加,呈剂量依赖性的降低J774A.1细胞中TNF-α、IL-6、IL-1和MCP-1的mRNA表达,而IL-1含量的降低,其介导的iNOS和NO含量也呈显著降低,说明亚洲蒿提取物通过抑制MAPK-NF-κB信号通路的活化,减少炎性因子和自由基的产生。任道远[51]利用浓度为20%的高果糖水持续喂养小鼠8周,诱发其肠道屏障功能发生障碍,而内毒素的不断累积进入血液后进一步诱导炎症反应的发生,导致其血清TNF-α、IL-1和尿素含量显著增加,而利用沙蒿多糖(Artemisia sphaerocephala krasch polysaccharide,ASKP)进行干预后可逆转以上情况的发生,改善高果糖引起小鼠的内毒素血症及炎症反应,并将沙蒿多糖进一步纯化得到的ASKP-1,以小鼠腹腔巨噬细胞RAW264.7为载体评价其免疫调节活性,结果发现其显著诱导巨噬细胞的细胞毒性分子NO、ROS释放和细胞因子干扰素-β(Interferon-β,IFN-β)和IL-6分泌,显著增强巨噬细胞(RAW264.7)的吞噬作用,其通过介导TLR4激活MAPK信号通路,其中ERK、JNK和P38均磷酸化,且增加核因子NF-κB亚基p65核易位和IκB-α降解,提示ASKP-1通过TLR4介导MAPK和NF-κB信号通路激活巨噬细胞进而发挥抗炎作用,使得机体恢复免疫平衡状态。温和的炎症反应对于免疫是必需的,但炎症细胞因子的过度表达会导致病理学炎症反应的发生[52]。芦蒿(ArtemisiarupestrisL.)水提物(400 μg/mL)通过Toll受体(TLR2/TLR4)介导MAPK通路,增加NF-κB核转运,进而促进DCs成熟并提高了IL-1β 和IL-6等细胞因子分泌,从而增强DCs适应性免疫力[53]。
综上所述,蒿属植物提取物通过螯合金属离子或增加铁离子还原力减少自由基的生成,并激活内源防御通路,如通过Keap1-Nrf2/ARE和PI3K/Akt-Keap1-Nrf2/ARE信号通路上调抗氧化酶的表达,进而增强自由基的清除,其也可通过HO-1/GPX-NF-κB、TLR4/ NF-κB和MAPK-NF-κB等途径抑制过量NO的生成,进而缓解机体的氧化应激和炎症反应(图1)。

┥:抑制 Inhibition;→:促进 Promotion;APE:蒿属植物提取物 Artemisia plant extracts图1 蒿属植物提取物发挥抗氧化和抗炎功能的机制模拟图Fig.1 Mechanism simulation diagram of antioxidation and anti-inflammatory function of Artemisia plant extracts
3 蒿属植物提取物的抗肿瘤活性
肿瘤是危害人类健康的重大疾病。据统计,中国每年因恶性肿瘤导致死亡的人数约为180万,每年发病的人数约为260万,且人数呈逐年递增态势发展[54]。因此,寻找既能降低化疗药物的副作用,又能增强疗效,并能克服耐药性的植物源性物质已然成为行业内的重要研究方向。研究发现,蒿属植物提取物在抗肿瘤方面发挥重要作用,其可能通过激发肿瘤细胞ROS产生进而促使其凋亡。肿瘤细胞内高浓度的ROS可造成其氧化应激,诱导细胞发生脂质氧化、损坏细胞膜的完整性,使蛋白质分子聚合、交联,导致其活性丧失,亦可攻击核酸的嘌呤与嘧啶使DNA链断裂,导致肿瘤细胞的结构与功能发生改变,致使肿瘤细胞的存活率降低[55]。异泽兰黄素(Eupatilin)是蒿属植物提取物的主要黄酮类化合物,将其添加到人的肾癌细胞株(786-O)后显著诱导细胞凋亡并伴随着ROS的大量产生,其中p38α的受体Thr180/Tyr182、ERK和 JNK的受体Thr183/Tyr185发生磷酸化,而MAPK信号通路的的激活可以进一步诱导NF-κB信号通路的活化,说明Eupatilin通过MAPK-NF-κB信号通路介导ROS的生成,进而促进786-O细胞凋亡,且具有剂量依赖性[56]。王汉楚等[57]建立裸鼠卵巢癌皮下移植肿瘤模型,双氢青蒿素(Dihydroartemisinin,DHA)的添加可显著抑制小鼠SOD、GPX和Nrf2的活性及其基因表达量,且利用卵巢癌细胞株(HO-8910PM)培养液添加DHA后的试验结果与体内试验结果一致,提示DHA通过抑制keap1-Nrf2信号通路,促进卵巢癌细胞内ROS的产生,从而诱导卵巢癌细胞凋亡。以上研究结果与Yan等[58]利用茵陈蒿(Artemisiacapillaris)提取物AC68(100 mg/kg)抑制肝癌细胞(Huh7)增殖的结果保持一致,其主要通过抑制PI3K/Akt- Nrf2信号通路,促进Huh7细胞ROS生成,进而抑制Huh7细胞的增殖。
细胞活力的维持与线粒体膜电位的完整性有着密不可分的关系,线粒体膜电位的下降也被称作细胞凋亡。线粒体在多种因素作用下通透性改变(遗传缺陷、ROS失衡、自噬受损和细胞失活),引起下游具有凋亡效应的Caspase蛋白家族活化,进而诱导细胞进入凋亡途径[59]。Wei等[60]研究指出,苦艾(ArtemisiaabsinthiumL.)乙醇提取物可诱导肝癌细胞凋亡,其通过降低线粒体膜电位,增加细胞色素C(Cytochrome-c,Cyt-C)的释放,并促进人肝癌细胞(BEL-7404)和小鼠肝癌细胞(H22)中Caspase-3、caspase-9的mRNA表达,此外,其通过建立H22肿瘤异种移植小鼠模型,苦艾乙醇提取物的作用效果与体外试验结果一致,可显著抑制肿瘤生长,提高肿瘤小鼠的存活率,且无毒副作用。这与Lv等[61]和Jung等[62]分别在人的卵巢癌细胞(CAOV-3、SKOV-3、PC3和HELA)和肝癌细胞(HCC)的研究青蒿和菌陈蒿结果相似。细胞的增殖和生长依赖于细胞有丝分裂的正常进行,蒿属植物提取物可诱导肿瘤细胞周期停滞,导致细胞周期紊乱,最终抑制肿瘤生长。Lang等[63]将三阴性人乳腺癌细胞(MDA-MB-231) 异种移植到小鼠体内,而青蒿提取物的添加可增加癌细胞S期和G2/M期的细胞数量,随后线粒体膜电位丧失,Caspase-3表达增加,提示青蒿提取物通过紊乱细胞周期,进而诱导细胞凋亡。Du等[64]也得出类似的结果,其利用DHA干预人的急性髓系白血病细胞后发生G0/G1细胞阻滞,进而促进肿瘤细胞凋亡。
以上研究结果表明,蒿属植物提取物对人的或经异种移植到小鼠体内的肿瘤细胞具有促凋亡作用,其可能通过促进肿瘤细胞ROS生成,经线粒体途径促进Caspase蛋白家族活化和紊乱细胞周期等方式抑制肿瘤细胞增殖。
4 小结与展望
蒿属植物提取物发挥的抗氧化与抗炎机制逐渐明确,其中抗氧化机制是通过螯合金属离子或增加铁离子还原力减少自由基的生成,并激活内源防御通路,如Keap1-Nrf2/ARE和PI3K/Akt-Keap1-Nrf2/ARE等途径上调抗氧化酶的表达;抗炎机制是通过HO-1/GPX-NF-κB、TLR4/NF-κB和MAPK-NF-κB等信号通路抑制过量NO的生成,进而缓解机体的氧化应激和炎症反应,从而改善畜禽的健康状况。此外,蒿属植物提取物对肿瘤细胞的凋亡也具有促进作用,其通过激发肿瘤细胞ROS的生成,或经线粒体途径促进Caspase蛋白家族活化和紊乱细胞周期等方式诱导肿瘤细胞凋亡。以上研究表明,蒿属植物提取物可有效提高畜禽机体的抗氧化和抗炎机能,且有着良好的抗肿瘤活性,进而有效改善畜禽的健康状况。
对于未来的研究方向,国内可进一步研究蒿属植物提取物的生产工艺及其标准的制定,集成开展蒿属植物提取物在不同畜禽中的耐受性研究、毒理学以及代谢和残留研究,为研发蒿属植物提取物替代抗生素促生长功能的饲料添加剂及其在畜禽生产中的应用提供系统的参考标准,且对于多种功能蛋白、中间代谢产物在氧化损伤和宿主免疫中的作用及信号通路间的相互作用知之甚少,仍需要进一步探究。
