弥漫大B细胞淋巴瘤中MYD88、CD79B基因特征与临床病理及预后的关系
2022-11-04张大川史勇强谢雯莹贾晨昊
吴 灿,张大川,王 辉,雷 婷,史勇强,谢雯莹,贾晨昊,李 青
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是最常见的成人淋巴瘤,占非霍奇金淋巴瘤的30%~40%[1],国际上标准的治疗方案为R-CHOP[2]。尽管R-CHOP方案能够显著提高DLBCL患者的总生存期(overall survival, OS)和无进展生存期(progress-free survival, PFS),但约40%患者表现为疗效差、易复发转移或疾病进展[3]。因此,深入探讨其发生机制、寻找新的分子靶点成为亟待解决的问题[4]。本文检测89例DLBCL中MYD88、CD79B基因突变,分析其临床病理特征及预后的关系,旨在更好地了解基因突变在DLBCL中的作用。
1 材料与方法
1.1 临床资料选取2016年10月~2020年7月苏州大学附属第三医院收治的89例DLBCL,其中男性30例,女性59例,年龄34~82岁,中位年龄65岁。纳入标准:(1)病理明确诊断为DLBCL, 非特指型;(2)术前未进行放疗或化疗;(3)有完整的临床信息及随访结果;(4)有足够的组织样本用于二代测序(next generation sequencing, NGS)检测。
1.2 方法
1.2.1观察指标 记录患者入院治疗时的年龄、性别、Ann Arbor临床分期、国际预后指数(international prognostic index, IPI)评分、原发部位、血清乳酸脱氢酶(lactate dehydrogenase, LDH)水平。
1.2.2免疫组化 所有标本经10%中性福尔马林固定,常规脱水,石蜡包埋,3~4 μm厚连续切片,行常规HE和免疫组化SP染色。一抗CD20(L26)、CD79a(MX076)、CD10(MX002)、BCL-6(MX042)、MUM1(MX093)、BCL-2(MX022)、c-MYC(EP121)、Ki-67(MXR002)、Cyclin D1(MX0078)、CD3(MX036)、CD5(MX052)、CD21(MX019),均购自福州迈新公司。Hans分类将DLBCL分为生发中心B细胞(germinal center B-cell-like, GCB)型和非生发中心B细胞(non-germinal center B-cell-like, non-GCB)型[5]。c-MYC蛋白≥40%肿瘤细胞阳性及BCL-2蛋白≥50%肿瘤细胞阳性者为双阳性[6]。Ki-67≥80%肿瘤细胞阳性为高增殖指数[7]。
1.2.3NGS法 用QIAGEN FFPE样品DNA分离试剂盒从DLBCL石蜡包埋组织提取基因组DNA,进行PCR扩增反应,然后使用SPB磁珠分离纯化PCR扩增产物。使用源奇生物公司淋巴瘤55基因试剂盒,于MiSeq测序仪测序(美国Illumina公司,型号Novaseq 6000),使用标准化自动样本管理与数据分析系统对原始数据进行过滤并进行生物信息学分析。
1.2.4疗效评价 患者采用PET-CT进行疗效评估,根据淋巴瘤国际协作组的评价标准,疗效评价包括完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)、复发或进展(stable disease, PD)[8]。OS是指从确诊为DLBCL到因肿瘤死亡或随访结束的时间;PFS是指从确诊为DLBCL到肿瘤复发、转移或病情恶化的时间。
1.3 统计学分析采用SPSS 26.0软件进行统计学处理。计数资料的比较采用χ2检验及Fisher精确检验,OS、PFS采用Log-rank进行生存分析。本组统计学比较均采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 免疫表型及基因突变89例DLBCL中(图1A、B),GCB型31例,non-GCB型58例;c-MYC/BCL-2双阳性24例(图1C、D)。89例DLBCL中,18例MYD88基因突变,突变率为20.2%(18/89)。最常见的突变位点为L265P,达56.5%(13/18),V147A位点突变率为11.1%(2/18),S243N、M182T及M33T位点突变率均为5.5%(1/18)。19例CD79B基因突变,突变率为21.3%(19/89)。CD79B Y196H、Y196S位点突变率为15.8%(3/19),CD79B Y196X、Y196C位点突变率为10.5%(2/19)。CD79B Y196C、Y196N、Y196D、A16V、T509G、G135D、C550-1G>A、Tyr196Cys、Ala205fs位点突变率均为5.3%(1/19)。6例MYD88、CD79B基因双突变,占6.7%(6/89)。

图1 A.HE染色显示:DLBCL肿瘤细胞体积较大,细胞核内可见2~3个小核仁,呈中心母细胞形态;B.肿瘤细胞CD20胞膜弥漫阳性,SP法;C.c-MYC阳性,SP法;D.BCL-2阳性,SP法
2.2 MYD88、CD79B基因突变及双突变与DLBCL临床病理特征的关系
2.2.1MYD88基因突变与DLBCL临床病理特征的关系 non-GCB型DLBCL中,MYD88突变率(16/58,27.5%)显著高于GCB型(2/31,6.5%,P=0.018)。不同淋巴结外部位中MYD88基因突变情况:原发睾丸100%(5/5),卵巢100%(2/2),大腿100%(1/1),原发乳腺66.7%(2/3),骨组织50%(1/2),鼻咽部33.3%(4/12),舌根25%(1/4);未发现MYD88基因突变部位:胃肠道(0/9),扁桃体(0/6),颌下腺(0/3),腮腺(0/2),会厌(0/2),腹腔(0/2),胸腔(0/1),甲状腺(0/1),脾脏(0/1),腭部(0/1),喉部(0/1),臀部(0/1)。DLBCL淋巴结外组(15/59,25.4%)MYD88基因突比率高于结内组(3/30,10%),两组间差异无统计学意义(P=0.087)。BCL-2阳性组MYD88突变率(16/55,29.1%)高于BCL-2阴性组(2/34,5.9%),两组差异有统计学意义(P=0.008)。c-MYC/BCL-2双阳性组中MYD88突变率(9/24,37.5%)显著高于非双阳性组(9/65,13.8%,P=0.030)。Ki-67增殖指数高与MYD88基因突变显著相关,Ki-67增殖指数≥80%组中MYD88基因突变率(14/47,29.8%)高于Ki-67增殖指数<80%组(4/42,9.5%,P=0.018,表1)。
2.2.2CD79B基因突变与DLBCL临床病理特征的关系 58例non-GCB型DLBCL中CD79B基因突变16例,占27.6%,31例GCB型DLBCL中CD79B基因突变3例,占9.7%,CD79B基因突变以non-GCB型为主,两组相比差异有统计学意义(P=0.049)。Ki-67增殖指数高与CD79B基因突变显著相关,Ki-67增殖指数≥80%组中CD79B基因突变率(15/47,40.5%)高于Ki-67增殖指数<80%组(4/42,9.5%,P=0.010,表1)。
2.2.3MYD88/CD79B基因双突变与DLBCL临床病理特征的关系 c-MYC/BCL-2双阳性组中MYD88/CD79B基因双突变率(5/24,20.8%)显著高于c-MYC/BCL-2非双阳性组(1/65,1.5%,P=0.006)。Ki-67增殖指数高与MYD88/CD79B基因双突变相关,Ki-67增殖指数≥80%组中MYD88/CD79B基因突变率(6/47,12.8%)高于Ki-67增殖指数<80%组(0/42,0,P=0.048,表1)。
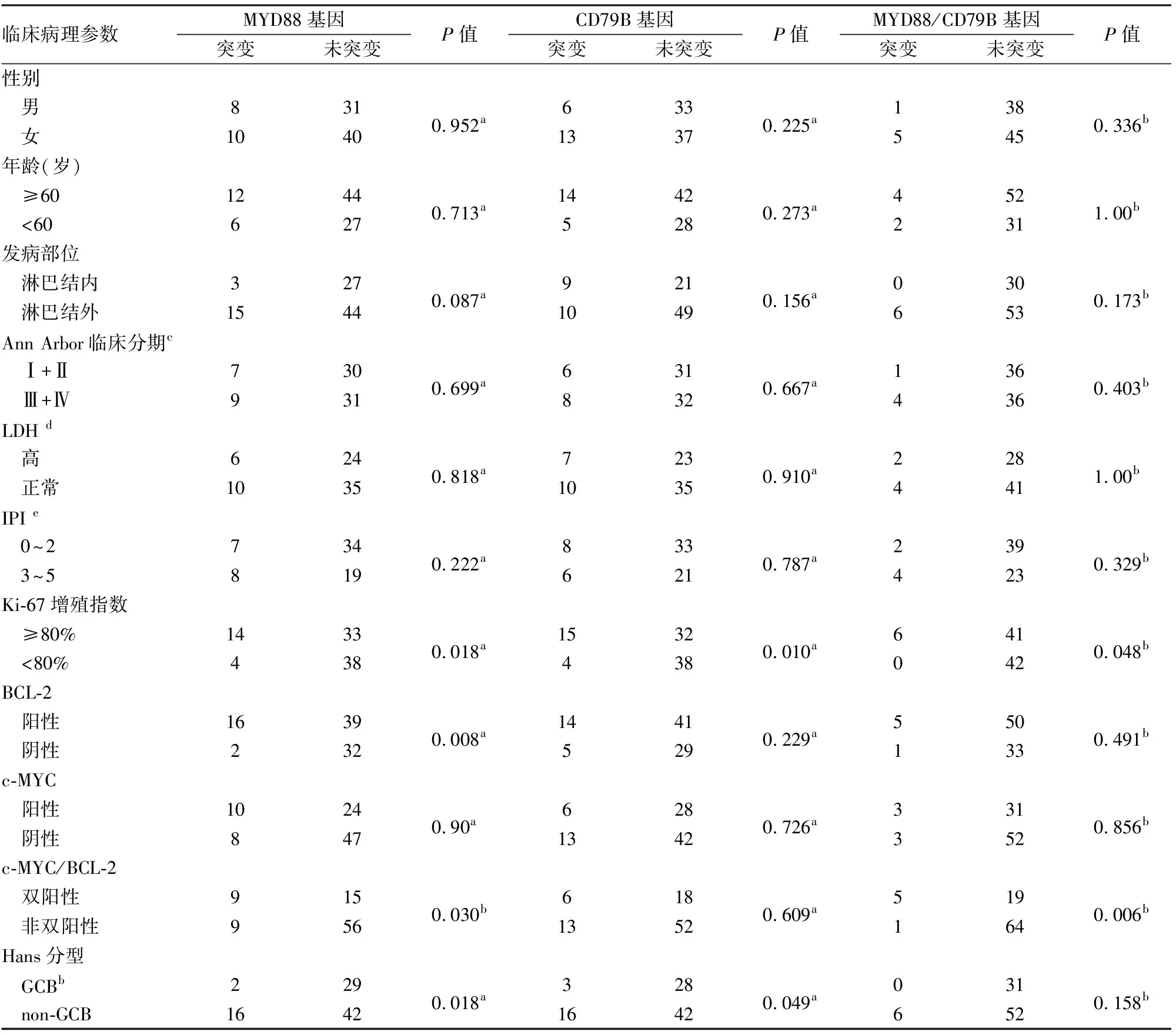
表1 MYD88、CD79B、MYD88/CD79B基因突变与DLBCL临床病理特征的关系
2.3 疗效比较58例患者采用R-CHOP方案治疗4周期后初次评估治疗效果,CR率为53.4%,PR率为36.2%,PD率为10.3%。非CR组MYD88基因突变率(12/27,44.4%)显著高于CR组(3/31,9.7%,P=0.004)。4周期化疗结束后进行中期评估,非CR组MYD88/CD79B基因双突变率(5/27,18.5%)高于CR组(0/32,0,P=0.042,表2);提示MYD88基因突变、MYD88/CD79B基因双突变患者的中期疗效评估时不易达到CR。

表2 MYD88、CD79B、MYD88/CD79B基因突变与疗效评估的关系
2.4 生存分析89例DLBCL患者中位随访时间36个月(1~60个月)。2组生存分析结果显示,MYD88基因突变组与非突变组患者2年OS分别为77.8%与76.1%,PFS分别为55.6%与70.4%,组间比较差异均具有统计学意义(P=0.034、0.021,图2A、B)。MYD88/CD79B基因双突变组与非双突变组患者2年OS分别为42.9%与76.7%,PFS分别为33.3%与69.9%,组间比较差异均具有统计学意义(P=0.041、0.004,图2C、D)。CD79B基因突变组与非突变组患者的2年OS分别为50%与78.3%,PFS分别为45%与71.4%,两组差异无统计学意义(P=0.141、0.085)。进一步统计分析,MYD88基因突变组与MYD88/CD79B基因双突变组OS和PFS差异无统计学意义(P=0.30、0.075,图2E、F)。
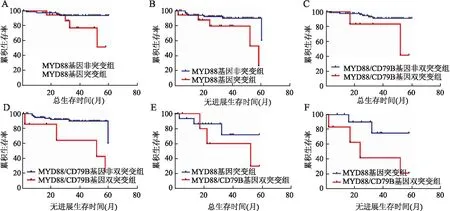
图2 DLBCL患者生存分析:A.MYD88基因突变组和非突变组OS;B.MYD88基突变组和非突变组PFS;C.MYD88/CD79B基因双突变组和非双突变组OS;D.MYD88/CD79B基因双突变组和非双突变组PFS;E.MYD88基因突变组和MYD88/CD79B基因双突变组OS;F.MYD88基突变组和MYD88/CD79B基因双突变组PFS
3 讨论
DLBCL是一组临床和生物学上均具有异质性的肿瘤[9-10]。虽然大部分患者获得较好的疗效,但30%~40%患者发生耐药或复发[11]。Schmitz等[12]对574例DLBCL样本进行外显子测序、基于芯片的DNA拷贝数分析和372个基因的定向扩增重复测序,将DLBCL分为MCD、N1、BN2、EZB四个亚型。近期有学者提出LymphGen分型,即MCD亚型、BN2亚型、N1亚型、EZB亚型、A53和ST2亚型[13]。其中MCD型以MYD88和CD79B基因突变为主要特征,提示MYD88、CD79B基因突变在DLBCL发生发展、治疗及预后评估中可能具有重要作用。
2011年Ngo等[14]首次报道MYD88基因突变在non-GCB型DLBCL中高达29%,而在其他亚型DLBCL中非常罕见。有研究报道MYD88基因在non-GCB型DLBCL中突变率为21.6%~31.2%,而在GCB型中突变率6.0%~9.7%[15-16]。本实验结果显示,non-GCB型DLBCL中MYD88基因突变频率高于GCB型,组间差异有统计学意义。DLBCL中MYD88基因突变与发病部位显著相关,好发于中枢神经系统、睾丸、皮肤、乳腺部位[17-18]。原发淋巴结内DLBCL中MYD88基因突变率低(0~38%,中位值10%)[19]。本实验在排除了特殊类型的DLBCL后,研究显示睾丸(5/5)、卵巢(2/2)、大腿(1/1)、乳腺(2/3)均显示较高的MYD88突变率(66.7%~100%),而淋巴结内MYD88突变率为10%。
Rovira等[20]报道MYD88突变型DLBCL中c-MYC/BCL-2双阳性率显著低于未突变型。Dubois等[21]报道non-GCB型DLBCL中BCL-2阳性更多见于MYD88突变者中,non-GCB型中c-MYC/BCL-2双阳性及c-MYC单一蛋白阳性与MYD88突变均无相关性。本实验中c-MYC/BCL-2双阳性组的MYD88突变率(9/24,37.5%)显著高于非双阳性组(9/65,13.8%,P=0.030)。c-MYC/BCL-2双阳性常见于non-GCB型且预后较差。此外,本实验结果显示,单一BCL-2阳性也与MYD88突变显著相关,而单一c-MYC阳性与该基因突变无相关性。
CD79B是B细胞抗原受体(B-cell receptor, BCR)组成部分,BCR刺激酪氨酸磷酸化的级联反应,激活BTK(bruton agammaglobulinemia tyrosine kinase),促进Ca2+产生,激活蛋白激酶C。蛋白激酶C使CARD11磷酸化,形成CBM复合体,参与NF-κB信号通路[21-23]。CD79B在non-GCB型DLBCL中突变率为21%,而在GCB型中突变率为0.6%~3%[17]。目前,CD79B突变多发生于non-GCB型。本实验中non-GCB型CD79B突变率(27.5%)高于GCB型(6.5%),差异有统计学意义。研究报道MCD型多发生于non-GCB型,non-GCB型DLBCL患者中MYD88/CD79B双突变率约11.5%,在GCB型中双突变率约0.6%[24-25]。本实验中non-GCB型DLBCL中MYD88/CD79B基因双突变率(6/58,10.3%),显著高于GCB型(0/31,0)。
本实验探讨了MYD88、CD79B与MYD88/CD79B基因突变与DLBCL预后的关系,生存分析结果显示MYD88、MYD88/CD79B基因未突变患者的2年OS和PFS均显著高于突变患者(P<0.05);但CD79B基因突变患者2年OS和PFS比较差异无统计学意义(P>0.05)。有文献报道MYD88突变可引发IL-1受体相关激酶介导的NF-κB信号途径激活,导致肿瘤形成,MYD88基因突变影响患者生存预后情况[26-27],本实验结论与之一致。DLBCL的分子分型中MCD型以MYD88和CD79B基因突变为主要特征,MCD型的生存率低于非MCD型患者,提示预后不良。
综上所述,MYD88基因突变及MYD88/CD79B基因双突变与DLBCL患者的治疗反应相关。MYD88基因突变以及MYD88/CD79B基因双突变DLBCL患者的OS、PFS比未突变患者低。本研究未行多因素分析,在未来的实验中将进一步探讨MYD88基因突变以及MYD88/CD79B基因双突变是否为影响患者预后的独立不良因素。
