盐度对典型滨海湿地沉积物汞甲基化的影响
2022-11-04王钊张曼胤胡宇坤刘魏魏张苗苗
王钊 ,张曼胤 *,胡宇坤 ,刘魏魏 ,张苗苗
1.中国林业科学研究院湿地研究所/湿地生态功能与恢复北京市重点实验室,北京 100091;2.中国林业科学研究院生态保护与修复研究所,北京 100091;3.河北衡水湖湿地生态系统国家定位观测研究站,河北 衡水 053000
甲基汞是一种高神经毒性、强亲脂性并经由食物链富集及放大的有机汞化合物(Mehrotra et al.,2005;Huang et al.,2019)。汞甲基化过程主要表现为厌氧条件下的生物甲基化,只有某些特定形态的无机汞化合物才能被具有甲基化能力的微生物所吸收(杜红霞等,2014),换言之,无机汞化合物的生物可利用性和微生物活性是制约汞生物甲基化过程的两个重要因素(Zhang et al.,2014;Zhang et al.,2019;Wang et al.,2022;吉云芸等,2020)。滨海湿地含有丰富含硫官能团(Moreno et al.,2005;Skyllberg et al.,2006;Wang et al.,2022)有机质,能固定输入系统中的汞,是一个天然“汞汇”。此外,滨海湿地的厌氧条件及丰富的甲基化微生物,包括硫酸盐还原菌(SRB)、铁还原菌(FeRB)、产甲烷菌(Compeau et al.,1985;Kerin et al.,2006;Fleming et al.,2006;Parks et al.,2013;Podar et al.,2015;Yuan et al.,2019;Azaroff et al.,2020;龙颂元,2020)等类群,为汞的生物甲基化提供了有利条件。
盐度(海水盐度)是滨海湿地的一个独特的环境因子,海水的潮起潮落、内陆的地表径流以及气候条件的综合作用造就了滨海湿地频繁变化的盐度环境(Oren,2016)。早期研究表明,较低的盐度环境往往与高水平的甲基化程度相关(Blum et al.,1980;Compeau et al.,1987;Barkay et al.,1997;Smylie et al.,2016)。盐度的变化不仅可能会对无机汞化合物的生物可利用性产生影响,而且还可能改变甲基化微生物含量,进而影响汞甲基化过程。Boyd et al.(2017)对大盐湖的汞同位素分析表明,在高盐度的环境下,可被微生物利用的无机汞含量与盐度之间呈现显著的负相关关系,而当盐度介于0.2%—3.1%之间时,汞甲基化率相对较高。Kondo et al.(2007)对科恩河口的研究则说明了盐度的变化对 SRB的含量产生了影响。此外,Chen et al.(2015)和Li et al.(2019)均在实验室模拟研究中发现,甲基汞质量分数随着盐度的变化会出现一个极大值,但这些研究大都是基于野外实验的研究,且对SRB种群数量的测定上采用了培养技术法,存在一定的不足。然而,也有研究表明盐度与甲基汞质量分数和甲基化潜能之间无显著相关关系(Braaten et al.,2014;De Oliveira et al.,2015;Johnson et al.,2015)。
滨海湿地厌氧条件下盐度的变化对汞甲基化过程的影响目前仍缺乏相关研究。前期研究结果表明,江苏盐城滨海湿地具有较高的甲基化潜能(龙颂元等,2019)。所以本研究以江苏盐城滨海湿地为研究对象,通过室内厌氧培养沉积物泥浆溶液的方法,分析不同盐度梯度和培养时间下,重要理化性质(pH和可溶性有机碳(DOC))、甲基汞质量分数及硫酸盐还原菌dsrA功能基因定量特征,探究盐城滨海湿地汞甲基化生成的最适盐度条件,以期为研究滨海湿地汞的迁移转化过程提供理论依据。
1 材料与方法
1.1 研究区概况
研究区为江苏盐城滨海滩涂湿地(图1),主要包括国家级珍禽及大丰麋鹿自然保护区。毗邻黄海,是典型的半日潮型淤泥质平原海岸,气候适宜,受内陆地表径流与近海潮汐作用的双重影响,研究区内滩涂的盐度存在着时空差异。湿地植被类型以互花米草(Spartina alterniflora)群落、盐地碱蓬(Suaeda salsa)群落、芦苇(Phragmites australis)群落和白茅(Imperata cylindrica)群落等为主(表1)。

表1 野外样品采集情况Table 1 Description of sample collection in the field
1.2 野外样品采集与室内盐度模拟实验
于2021年9—10月在研究区新洋港入海口附近、丹顶鹤核心保护区以及大丰麋鹿保护区采集沉积物样品(图1)。尽量保证采样点落于与海岸线相互垂直的样带上,样点间间隔大于150 m(图1)。每个样点设置20 cm×20 cm的样方,样方内采用四分法采集表层0—20 cm土样约1 kg,采集完的土样装入自封袋后快速低温运回实验室。将采集的样品搅拌混匀成均质样后,选取少部分用于理化性质测定,均质样的理化性质为:温度19.8 ℃;pH 5.46;盐度 1.14%;甲基汞质量分数 0.097 μg·kg-1。剩余部分则用于室内模拟盐度梯度的培养实验。
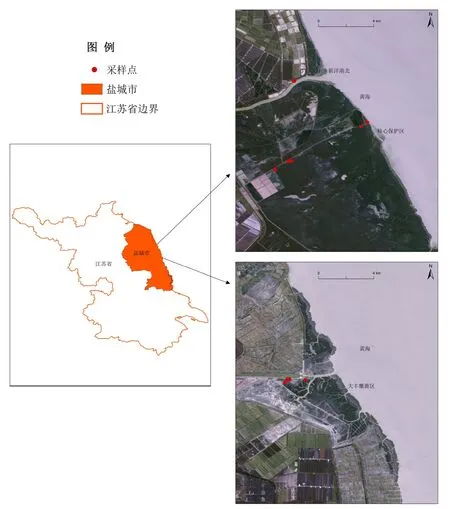
图1 研究区及野外采样点分布Figure 1 Distribution of study region and sampling sites in the field
1.2.1 盐度梯度
盐度反映了单位质量海水中可溶性无机离子的量。蒸发与降水是影响表层海水盐度的主要因素,而内陆区的地表径流也会对涨潮时涌入内陆的海水起稀释作用,该浓缩和稀释过程导致了滨海湿地的盐度变化。Marcet-Dittmar恒比定律(Riley et al.,1967)表明,海水中主要离子的相对含量是恒定不变的,基于此,本研究选取了7种(氯化钠、氯化钾、二水合氯化钙、六水合氯化镁、七水合硫酸镁、碳酸氢钠和溴化钠)能代表海水中主要离子类型的化学试剂,并按照一定的比例混合配制成模拟海水(李航等,2018)。盐城滨海湿地与黄海相邻,世界大洋的平均表层海水盐度为3.2%(Compeau et al.,1983),结合前人的研究基础(Boyd et al.,2017),盐度梯度设置为0.6%、1.2%、1.8%、2.4%和3.0%,同时以去离子水为对照(盐度为0),每个处理5个平行。各盐度梯度海水配制方法:依次称取 NaCl 6.630 g、KCl 0.181 g、CaCl2·2H2O 0.378 g、MgCl2·6H2O 1.307 g、MgSO4·7H2O 1.693 g、NaHCO30.051 g和NaBr 0.021 g溶解于去离子水中,并定容至250 mL,即可得到盐度值为3.0%的模拟海水,用去离子水将该海水溶液分别稀释至0.6%、1.2%、1.8%、2.4%后,可得到5个浓度梯度溶液(Li et al.,2019)。
1.2.2 泥浆溶液的预准备
称取50.00 g均质鲜土装入200 mL酸洗净的厌氧培养瓶中,加入不同盐度梯度的模拟海水溶液(实验组)和去离子水(对照组)120 mL,再向厌氧瓶中添加氧化还原指示剂树脂天青,使其质量浓度为2 mg·L-1,盖上橡胶塞,并用铝盖密封。橡胶导管、玻璃导管和三通旋塞与氮气钢瓶相连,借由0.6 mm微型针头向厌氧瓶内通氮气30—40 min,通完氮气后,指示剂颜色由深蓝变为紫红,再向体系内注入1.5 mL 10 mg·L-1的抗坏血酸,于22 ℃黑暗条件下恒温培养12 h,待到厌氧瓶内指示剂颜色由紫红变为无色,即说明瓶内残留氧气已耗尽(氧化还原电位<-51 mV),此时的厌氧瓶可以用于后续培养。
1.2.3 汞甲基化的厌氧培养实验
厌氧培养实验总共包含6个盐度梯度、5个时间以及5个重复,共150个样。将预先准备好的厌氧瓶放置到预先开启的厌氧培养箱(HYQX-Ⅱ,上海跃进医疗器械有限公司)中,在 21 ℃黑暗条件下培养28 d(Rivera et al.,2019)。培养的第1、8、15、22和29天从培养箱内拿出30个厌氧瓶,取出其中的沉积物,用于测定pH、DOC、MeHg以及异化硫酸盐还原菌功能基因dsrA的qPCR。
1.3 样品测定
pH采用ST20便携式pH计(OHAUS,USA)测定;盐度采用盐度计(WS-600,东莞市盛山电子科技有限公司)测定。
DOC采用高温催化氧化法测定(俞建国等,2012)。称取 1.0625 g邻苯二甲酸氢钾分析纯于118 ℃烘干2 h,溶于1000 mL去离子水制成标准母液,将母液稀释适量倍数构建标准曲线。将样品置于3000 g条件下离心20 min,取经0.45 μm尼龙66滤膜过滤的上清液0.5 mL,加1滴浓硫酸酸化,用 TOC 仪 vario TOC cube(Elementar,Germany)在 850 ℃高温催化测定,并以去离子水作空白试验,实验设置3组平行,加标回收进行质量控制,加标回收率为 85%—102%。该方法检出限为 4 μg·L-1。
甲基汞的萃取:取真空干燥的0.5000 g沉积物样品,加入质量分数为25%的KOH-甲醇溶液,于65 ℃恒温水浴重振荡萃取3 h。冷却至室温后,加水,于4000 r·min-1下离心2 min,取上清液,加四丙基硼化钠溶液反应,经 MERX-M 全自动烷基汞分析系统(Model Ⅲ,Brooks Rand Labs)测定(周心劝等,2018)。以石英砂代替样品进行空白试验,实验设置3组平行,加标回收进行质量控制,加标回收率为80%—105%,该方法检出限为0.2 μg·kg-1,标准品为 ERM-CC580,参考质量分数为 (75±4)μg·kg-1。
采用Real-time PCR法对硫酸盐还原菌的功能基因dsrA进行绝对定量,实验使用的引物为前序引物:DSR1F-ACSCACTGGAAGCACGGCGG;反向引物-DSR-R:GTGGMRCCGTGCAKRTTGG。20 μL反应体系为:10 μL 2 X ChamQ SYBR Color qPCR Master Mix(诺唯赞生物科技有限公司,南京),0.8 μL前序引物,0.8 μL反向引物,0.4 μL 50X ROX Reference Dye 1,2 μL DNA 模板,其余均为 dd H2O。扩增条件为:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,于72 ℃退火延伸1 min,共40个循环。为了验证扩增子序列并构建标准曲线,将硫酸盐还原菌的dsrA功能基因连接至 Pmd18-T,然后转化到大肠杆菌JM109细胞中。对含有靶基因插入片段的阳性克隆进行测序,选取最丰富的克隆用于质粒DNA提取。用NanoDrop 2000(Thermo Fisher Scientific,USA)测量纯化的质粒DNA浓度,采用10倍稀释系列,设置3个重复,用ABI 7300型荧光定量PCR仪(Applied Biosystems,USA)进行反应测定,生成标准曲线。样品测定时,并以未添加模板的20 μL反应体系作为阴性对照,所有处理均设置3组平行。
1.4 数据分析
应用Origin 2021b进行t-检验、单因素方差分析以及Kruskal-Wallis非参数检验。采用t-检验分析各盐度处理和不同培养时间下甲基汞质量分数与均质样背景值之间的差异显著性,单因素方差分析或 Kruskal-Wallis非参数检验比较同一时间不同盐度处理和同一盐度不同时间下pH、DOC、甲基汞质量分数及SRB绝对含量的差异显著性。应用R语言中ggplot2包进行线性拟合,探究pH、DOC和SRB的绝对含量与甲基汞质量分数的相关性。
2 结果与分析
2.1 模拟盐度下pH和DOC质量浓度的变化趋势
同一盐度不同时间下 pH均表现出一定差异(图2a)(P<0.05)。当盐度为0—2.4%时,pH均在培养第8天时达至最大,盐度为3.0%时,pH则在培养第22天时达至最大;同一时间不同盐度下pH也表现出一定差异(图2a)(P<0.05)。当培养时间为15—29 d时,pH表现为随盐度的增加而增加。模拟盐度培养下pH表现为弱酸性或中性,于6.00—7.18范围内波动。
同一盐度不同时间下 DOC均表现出显著差异(图2b)(P<0.05)。当盐度为0.6%—3.0%时,DOC均于培养第8天时达至最大,较培养1 d时分别提高 151%、83%、42%、44%、67%,当培养15 d后,DOC基本保持稳定,且均显著低于起始状态。对照组中,DOC则于培养第15天时达至最大,较培养1 d时显著提高了72%,而后在培养第29d才显著低于起始状态;同一时间不同盐度下 DOC也表现出显著差异(图 2b)(P<0.05)。培养早期(培养1 d和8 d),DOC随盐度表现为倒U型,分别在盐度为0.6%和1.8%处最低,较对照组分别显著降低42%和34%,当培养15 d和22 d时,DOC随盐度的增加而减少,且盐度组均显著低于对照组,培养29 d的DOC在较低位波动。
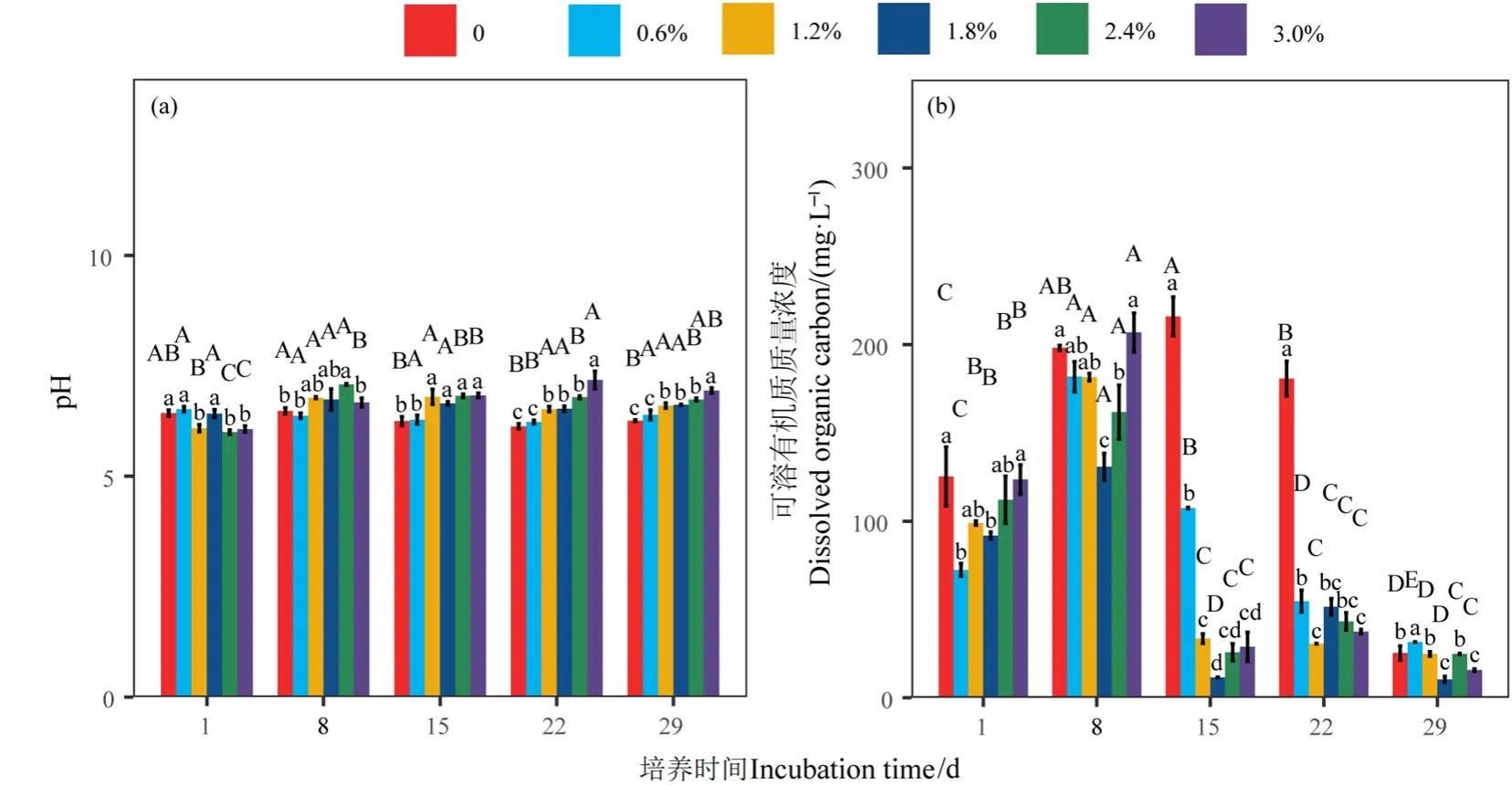
图2 不同盐度和时间下pH和DOC的差异Figure 2 Differences in pH and DOC among different salinity levels and incubation time
2.2 模拟盐度下各实验组甲基汞质量分数与背景值的比较
模拟盐度下甲基汞质量分数与培养前混合均质样背景值的比较见表2。结果显示,培养1 d且盐度为0和1.8%时,甲基汞质量分数较背景值差异不显著(P>0.05);培养22 d且盐度为0.6%时,甲基汞质量分数较背景值差异不显著(P>0.05);培养29 d且盐度为0.6%、1.2%和1.8%时,甲基汞质量分数也较背景值差异不显著(P>0.05),其余处理下甲基汞质量分数均显著高于背景值(P<0.05)。

表2 模拟盐度下沉积物甲基汞质量分数与混合均质样本底值的差异Table 2 Differences in methylmercury contents between the sediments under simulated salinity and the background level
2.3 模拟盐度下甲基汞质量分数的变化趋势
同一盐度不同时间下甲基汞质量分数均表现出显著差异(图3a)(P<0.05)。当盐度为0、0.6%、1.2%、2.4%和3.0%时,甲基汞质量分数均于培养8 d时最大,较培养1 d时分别增加37%、22%、53%、31%和82%。盐度为1.8%时,甲基汞质量分数则于培养15 d时最大,较培养1 d时显著增加2.1倍,甲基汞质量分数随时间变化表现为先增后减的趋势;同一时间不同盐度下甲基汞质量分数也表现出显著差异(P<0.05)(图3a)。当培养1、8、15、22 d时,甲基汞质量分数均在盐度1.2%时最大,分别较对照组显著提高41%、57%、48%和119%;当培养29d时,甲基汞质量分数则在盐度2.4%时最大,较对照组显著提高74%,甲基汞质量分数随盐度变化基本表现为先增后减的趋势。
2.4 模拟盐度下SRB绝对含量的变化趋势
同一盐度不同时间下 SRB绝对含量均表现出显著差异(图3b)(P<0.05)。当盐度为 0—3.0%时,SRB绝对含量均于培养15 d时最大,较培养1 d时显著增加125%、141%、128%、33%、109%和184%,SRB绝对含量随时间变化表现为先增后减的趋势;同一时间不同盐度下 SRB绝对含量也表现出一定差异(图3b)(P<0.05)。当培养1 d时,SRB绝对含量先随盐度增加而增加,于盐度1.8%处最大,较对照组显著增加119%,后随盐度增加而减少,至盐度3.0%时较对照组差异不显著;当培养8 d时,SRB绝对含量先随盐度增加而增加,于2.4%处较对照组显著增加112%,后随盐度增加而减少,但较对照组差异不显著;当培养15 d时,SRB绝对含量随盐度增加而增加,直至盐度 3.0%时较对照组显著增加71%;当培养22 d时,SRB绝对含量基本随盐度的增加而增加,盐度3.0%时较对照组显著增加38%;当培养 29 d时,SRB绝对含量先随盐度增加而增加,盐度1.2%时较对照组显著增加197%,后随盐度增加而减少,盐度1.8%、2.4%和3.0%时较对照组差异均不显著。
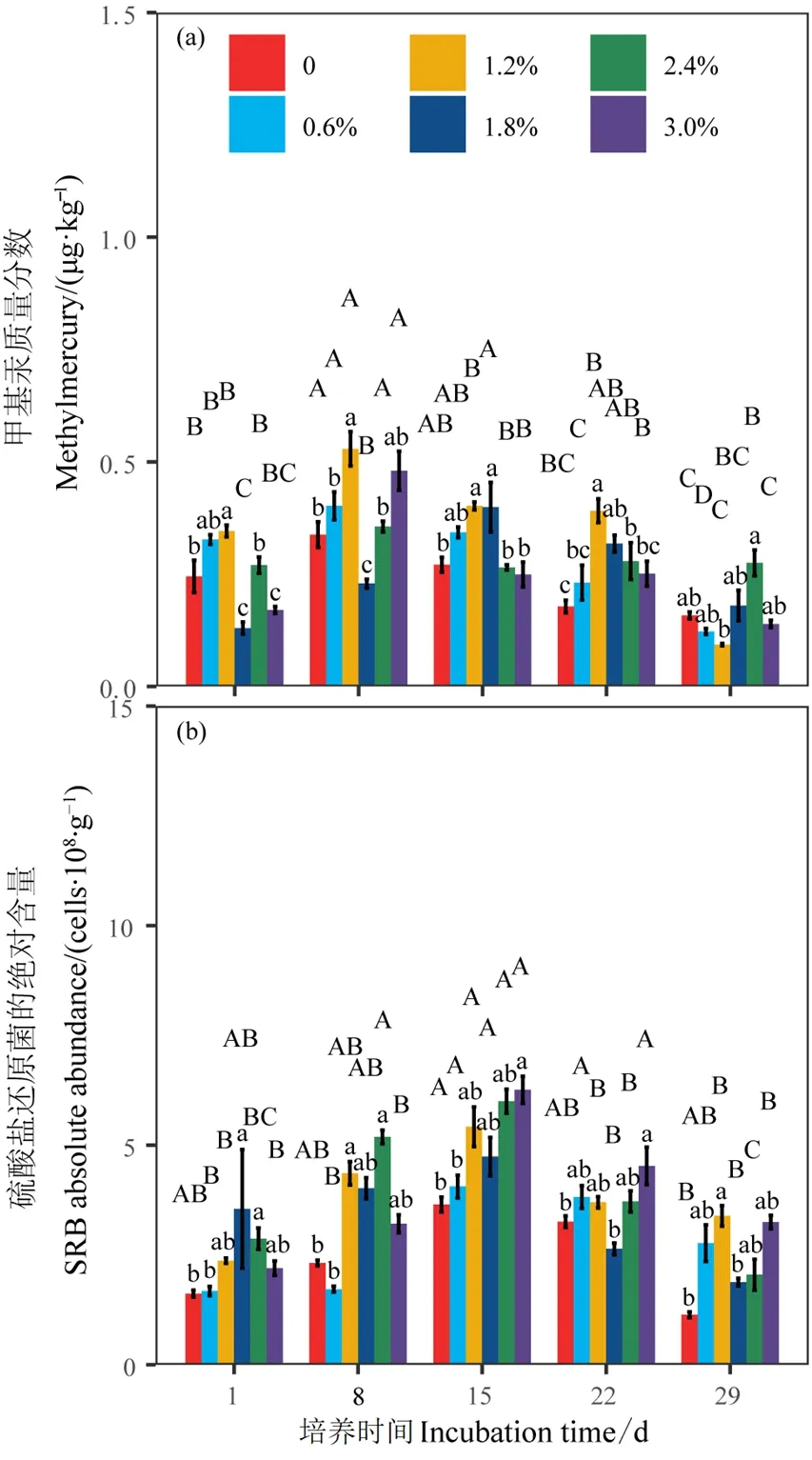
图3 不同盐度和时间下甲基汞质量分数与SRB绝对含量的差异Figure 3 Differences in methylmercury content and absolute abundance of sulfate-reducing bacteria among different salinity levels and incubation time
3 讨论
3.1 模拟盐度下甲基汞质量分数特征
已有研究证实,盐度是影响河口沉积物汞甲基化的重要因素,但相关报道不多。本研究中,甲基汞质量分数随盐度增加表现出先增后减趋势,且于盐度1.2%时甲基化程度最高(图3a)。这可能与Hg2+和Cl-之间的络合作用有关(Hsu-Kim et al.,2013)。低盐度环境下,Cl-易与Hg2+形成HgCl2,其可通过细胞膜被微生物吸收利用,而高盐度环境下过量的Cl-可能会进一步与HgCl2结合,形成不易被微生物所利用的[HgCl3]-或[HgCl4]2-(Barkay et al.,1997),汞甲基化的原料减少了,也就降低了甲基化程度。这一结果表明,一定盐度环境(1.2%)可能有利于汞的甲基化。本研究结果与之前关于盐度对汞甲基化的研究相一致,Compeau et al.(1984)研究表明,还原条件下0.4%盐度的汞甲基化程度较高,高盐度(2.5%)下汞甲基化程度被抑制的同时生成的甲基汞也不稳定;Blum et al.(1980)发现,高盐度(3%)的甲基化速率只有低盐度(0.1%)的40%,且这种抑制作用主要表现在还原条件下。然而,Compeau et al.(1983)研究海水中阴离子对汞甲基化的影响表明,添加 0.01—0.5 mol·L-1的 Cl-会显著降低汞甲基化速率。需要明确指出的是,本实验中模拟盐度添加液中还含有和,它们的存在也可能对 Cl-的作用产生干扰,使不同的研究得到不一致的结论,因此还需要开展更系统深入的研究。
本研究还发现,甲基汞质量分数也随时间增加表现出先增后减的趋势,且于培养8 d时甲基化程度最高。可能的原因是,一方面,本实验模拟盐度添加液中含有一定浓度的,的添加可能在一定程度上刺激某些微生物,使其将其他形式的汞转化为甲基汞(Jeremiason et al.,2006),然而,在还原条件下,易被转化为硫化物,硫化物的积累可能通过形成硫化汞沉淀降低汞的生物有效性,进而抑制甲基汞的形成(Ma et al.,2019);另一方面,DOC也是影响汞甲基化过程的重要因素。线性拟合分析也表明,DOC能较好地解释甲基汞的变化(图4b)(P<0.05)。本研究中,DOC随时间的变化趋势与甲基汞质量分数随时间的变化趋势基本相一致,在 DOC大量存在时,其上巯基官能团也与Hg2+有较强亲和力,会抑制硫化汞沉淀的形成(Ravichandran et al.,1999;Gilmour et al.,2018;Mazrui et al.,2018),此外,与DOC结合的含汞化合物也具有能被微生物吸收利用的可能(Jonsson et al.,2012)。因而,当环境中DOC较高时,可能能在一定程度上促进汞甲基化,当环境中 DOC较低时,会抑制汞甲基化。
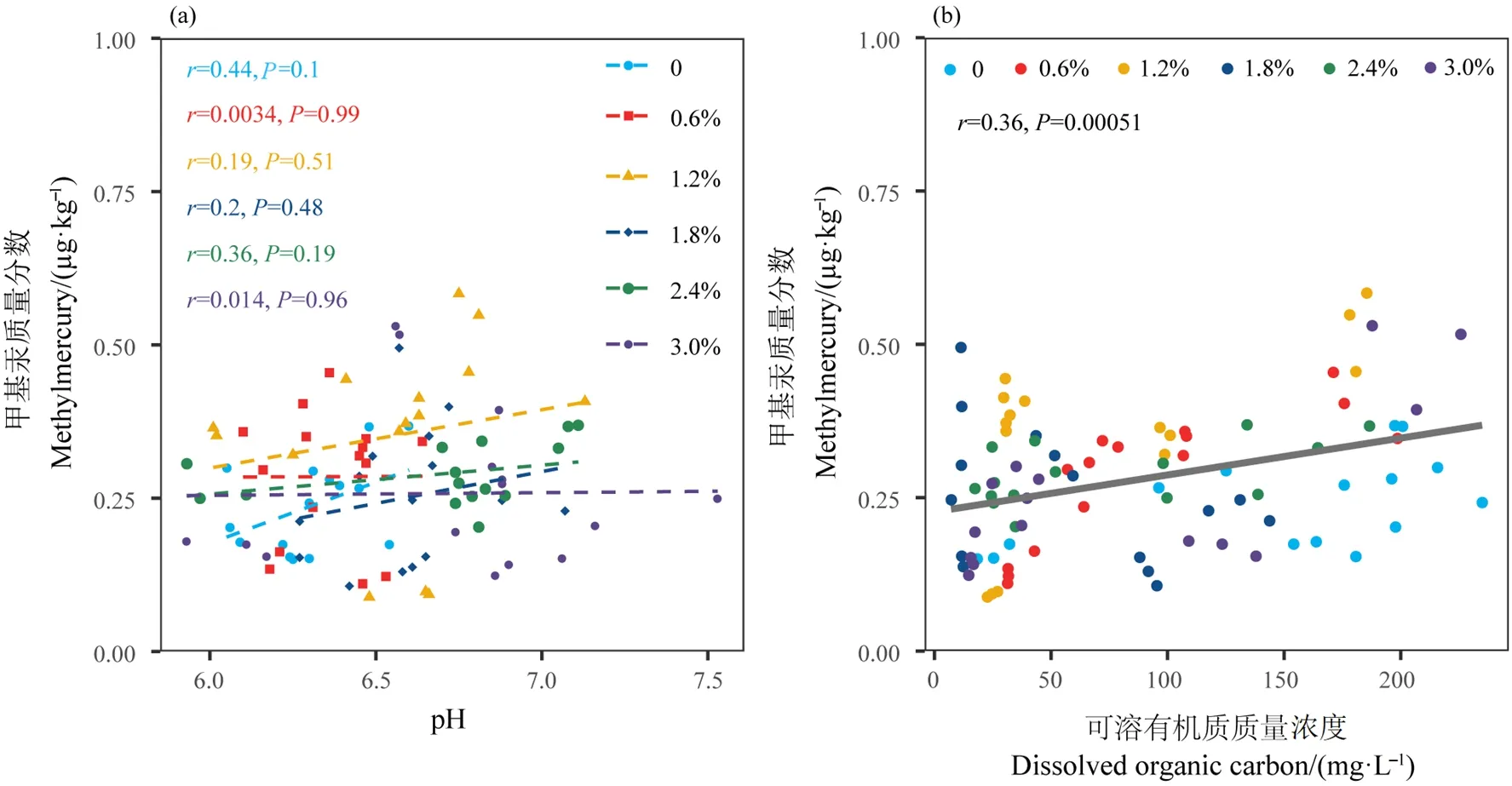
图4 pH和DOC与甲基汞质量分数之间的关系Figure 4 Relationships between pH, DOC and methylmercury content
除了上述考虑的Cl-、和DOC外,pH也是影响汞甲基化的重要因素(Singh et al.,1999;赵蕾,2016)。本研究发现,盐度处理的pH呈弱酸性或中性(6.00—7.18),且并不能很好地解释甲基汞的变化(图4a)(P>0.05)。pH较低时,环境中H+浓度较高,与Hg2+竞争吸附活性位点时更易于被土壤胶体吸附,从而释放Hg2+,提高汞的生物有效性,促进汞甲基化;反之,当pH较低时,则削弱汞甲基化作用(Steffan et al.,1988;Ullrich et al.,2001)。然而本研究却得出不一致结论,可能的原因是盐度处理导致环境中影响汞甲基化的其他因素也发生变化,对pH的影响形成了干扰。
3.2 模拟盐度下影响汞甲基化的微生物因素
本研究发现,SRB绝对含量随盐度增加基本表现为增加的趋势,而随时间增加则表现为先增后减趋势,且于15 d时含量最高(图3b)。SRB随盐度变化的趋势,一方面原因可能是本实验处理下 pH处于弱酸性或中性(6.00—7.18),较适合硫酸盐还原菌的生长,另一方面原因可能是一些 SRB为轻度嗜盐型,能在盐度 0—4%环境下生存(Boyd et al.,2017;李新荣等,1999)。SRB随时间变化的趋势,可以从以下方面来解释。有报道表明,溶解氧与 SRB绝对含量呈显著负相关关系(张玉等,2016),此外,也能作为碳源促进SRB生长(Castro et al.,2000)。本研究营造了厌氧环境的同时,模拟盐度添加液中也含有,因而在培养早期可能会促进 SRB生长,使其含量增加。同时模拟液中还含有,SRB会以为电子供体,为电子受体进行代谢活动,代谢过程中不断积累H2S,当H2S达到一定浓度时会对SRB产生毒害作用(Orem et al.,2011),导致培养后期SRB绝对含量的减少。
本研究中,SRB绝对含量与甲基汞质量分数无显著线性相关性(图5)(P>0.05)。大量研究表明,SRB是滨海湿地参与汞甲基化过程的主要微生物(Compeau et al.,1985;Leloup et al.,2005)。在一定范围内,甲基汞质量分数会随还原活动的增强而增加(Shao et al.,2012),但在高盐度条件下,还原的硫化物对汞甲基化的抑制作用(Hammerschmidt et al.,2008)可能会将SRB对汞的甲基化作用掩盖,使得两者间表现出复杂的非线性关系。

图5 SRB绝对含量与甲基汞质量分数之间的关系Figure 5 Relationship between absolute abundance of SRB and methylmercury content
本研究在考虑海水盐度时,将其视为一个复杂的多因子综合体,若要深入解释海水盐度对沉积物汞甲基化过程的影响,需要单独考虑这些海盐离子对汞甲基化的影响。
4 结论
(1)海盐处理下,随着盐度(0—3.0%)的增长,甲基汞质量分数总体呈现先增加后减少的趋势。1.2%盐度下,沉积物汞甲基化程度最高;随着培养时间(1—29 d)的增长,甲基汞质量分数总体也呈现出先增加后减少的趋势,培养8 d时,沉积物汞甲基化程度最高。
(2)海盐处理下,随着盐度(0—3.0%)的增长,SRB的绝对含量总体增加,表明海水盐度未对SRB生长产生盐胁迫;随着培养时间(1—29 d)的增加,SRB的绝对含量表现为先增加后减少的趋势,当培养时间超过15 d时,SRB的生长会受到抑制。
(3)本实验条件下,SRB绝对含量与甲基汞质量分数间无显著线性相关性(P>0.05),DOC对甲基汞质量分数随时间的变化具有较高的解释度(r=0.36,P<0.05)。
