岩藻糖基转移酶II对前列腺癌细胞生物学功能的影响及机制
2022-11-03王若妍胡铭倩瞿闻馨范赛荣
王若妍,胡铭倩,瞿闻馨,范赛荣
温州医科大学 检验医学院(生命科学学院),浙江 温州 325035
前列腺癌的发病率在男性所有恶性肿瘤中高居第二,2020年全球约有141多万人新患前列腺癌,约有37.5万人因前列腺癌而丧生[1-2]。据我国2020年对前列腺癌的专项统计发现,2017年我国男性前列腺癌新增患者数、死亡人数、发病率及病死率均大幅增加[3]。肿瘤的发生发展过程中往往伴随着异常的糖基化修饰,直接影响着肿瘤细胞的生长、黏附、转移、规避免疫监视等[4-6],已逐渐被认为是肿瘤的又一新特征[7]。岩藻糖基化是与癌症最密切相关的糖基化修饰之一,由岩藻糖基转移酶(fucosyltransferase, FUT)催化介导[8-9]。研究表明,FUT在多种肿瘤中存在异常表达,如乳腺癌、结直肠癌、肝癌、胰腺癌等,且与肿瘤的分期、预后等具有一定的相关性[10-11]。研究表明FUT2在肺腺癌中异常表达,且参与了肺腺癌细胞生物学功能的调控[12],但FUT2与前列腺癌的相关性未见相关报道。为此我们以FUT2为研究对象,探讨FUT2对前列腺癌生物学功能的影响,为前列腺癌的早期诊断及分子靶向治疗提供潜在的靶标和理论依据。
1 材料和方法
1.1 材料 临床前列腺癌组织芯片购自西安百思达生物科技有限公司。前列腺癌PC-3细胞株购自上海细胞生物所。FUT2低表达载体psi-U6.1/eGFP/Puro-FUT2、空载载体psi-U6.1/eGFP/Puro-NC均由上海吉玛制药技术有限公司构建;胎牛血清FBS购自美国Hyclone公司;DMEM培养基、F-12培养基、PBS均购自美国Gibco公司;β-catenin抗体购自美国Santa Cruz公司;ICAM-1抗体、Cyclin D1抗体、FUT2抗体、β-actin抗体、Tubulin抗体、GAPDH抗体购自美国Abcam公司。
1.2 方法
1.2.1 免疫组织化学实验:将组织芯片烤至石蜡融化后脱蜡、复水、洗涤,加适量枸橼酸钠缓冲液,加热至沸腾,中高火8 min而后冷却,反复3次后自然冷却,PBS洗涤,3% H2O2孵育后洗涤,之后5% BSA封闭,孵育一抗,4 ℃过夜。孵育二抗,37 ℃恒温箱孵育1 h,DAB显色,苏木素复染并冲洗,乙醇脱水,透明后封片。
1.2.2 脂质体转染构建FUT2低表达的细胞株和空载细胞株:采用脂质体转染技术将FUT2的两种不同序列的RNA干扰质粒、无义对照质粒依托脂质体载体转入PC-3细胞;筛出阳性的单克隆细胞团,构建稳定传代的FUT2低表达细胞株和空载细胞株。
1.2.3 MTT实验:胰酶消化对数期细胞,制成单细胞悬液,以5 000个细胞/孔接种至96孔板,加入带有MTT试剂的培养基,培养24 h后检测吸光度。同样方法分别检测培养48 h和72 h后的细胞,最后将数据整理分析。
1.2.4 克隆形成实验:取生长对数期的实验组和对照组细胞消化计数,将细胞悬液稀释,以3 000个细胞/孔接种12孔板,培养10 d。出现肉眼可见的克隆时,用结晶紫染液染色后相机拍照。
1.2.5 Transwell小室实验:将细胞消化成单细胞悬液,调整悬液浓度,吸取200 μL至Transwell小室上室,下室加入600 μL含有20% FBS的培养基,轻轻摇晃放置培养箱中48 h拿出,将小室甲醛固定后染色,用ddH2O清洗后显微镜下拍照观察。
1.2.6 Transwell基质胶实验:Matrigel基质胶与培养液按1∶9比例混合后向每个小室的上室加入40 μL置于细胞培养箱中,12 h后将细胞消化成单细胞悬液,调整悬液浓度,吸取200 μL至提前加入Matrigel基质胶的Transwell小室上室,下室加入600 μL含有20% FBS的培养基,轻轻摇晃放置培养箱中48 h拿出,将小室甲醛固定后染色,用ddH2O清洗后显微镜下拍照观察。
1.2.7 Western blot实验:提取细胞总蛋白并测定蛋白浓度,配置浓度为10%的分离胶和浓度为5%的浓缩胶,上样,进行稳压电泳分离待测蛋白,转膜,封闭,1×TBST洗涤3遍后根据目的蛋白分子量切目的条带及内参,一抗4 ℃摇床孵育过夜,孵育结束,1×TBST进行洗涤,采用二抗室温孵育1 h,1×TBST洗涤后曝光。
1.3 统计学处理方法 采用SPSS19.0统计软件分析。计量资料用±s表示,2组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 FUT2在前列腺癌组织中的表达情况 免疫组织化学实验结果分析表明:FUT2在前列腺癌组织中的表达水平显著高于其在正常前列腺组织中的表达水平(P<0.05),见图1。

图1 FUT2在前列腺癌组织中的表达情况(免疫组化染色,×200)
2.2 FUT2低表达稳转细胞株的鉴定 采用脂质体转染构建FUT2低表达的细胞株和空载细胞株,Western blot检测FUT2蛋白表达水平。结果表明,与空载对照(NC)组比,干扰FUT2表达后,PC-3细胞中的FUT2蛋白表达显著下调,差异有统计学意义(P<0.05),见图2,表明FUT2低表达的前列腺癌PC-3细胞株构建成功。

图2 FUT2低表达稳转细胞株的鉴定
2.3 FUT2对前列腺癌细胞克隆增殖的影响 MTT实验结果显示,与空载对照(NC)组相比,FUT2低表达的前列腺癌PC-3细胞的增殖能力显著降低(P<0.05)。平板克隆实验结果显示,与NC组相比,FUT2低表组细胞的单克隆团数量明显减少(P<0.05),表明干扰FUT2的表达能抑制PC-3细胞的单克隆形成能力。见图3。
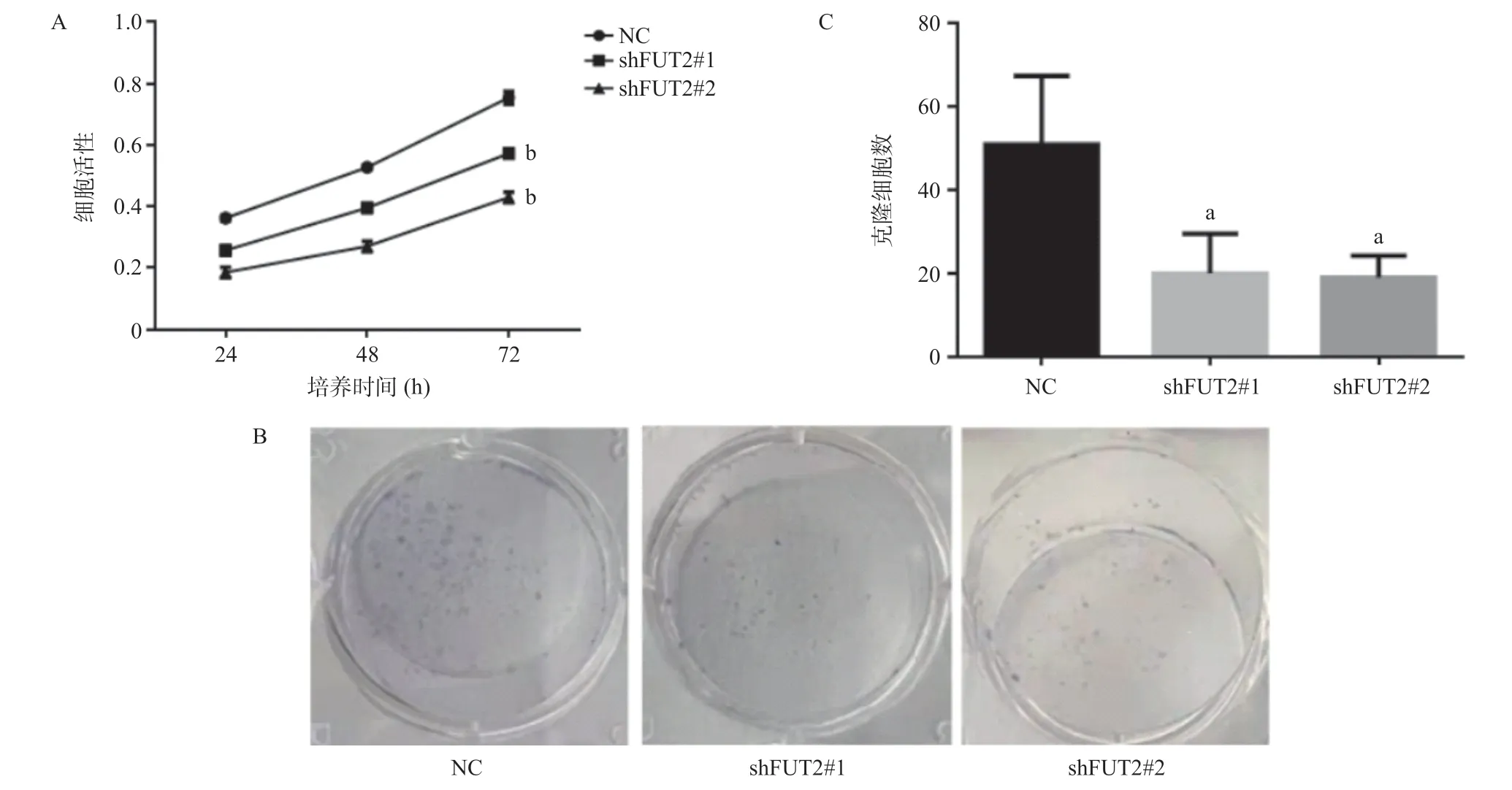
图3 FUT2对前列腺癌细胞克隆增殖能力的影响
2.4 FUT2对前列腺癌细胞迁移的影响 Transwell小室实验结果表明,与NC组比,FUT2低表达组(shFUT2#1和shFUT2#2)迁移至下室的细胞数目明显减少(P<0.05),见图4。
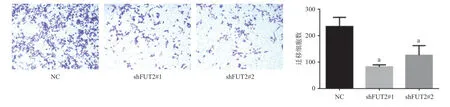
图4 FUT2对PC-3细胞迁移能力的影响(×100)
2.5 FUT2对前列腺癌细胞侵袭的影响 Transwell基质胶实验表明,与NC组比,FUT2低表达组(shFUT2#1、shFUT2#2)细胞数目显著减少(P<0.05),提示下调FUT2的表达能抑制人前列腺癌细胞的侵袭能力,见图5。

图5 FUT2对PC-3细胞侵袭能力的影响(×100)
2.6 FUT2对Wnt/β-catenin信号通路中关键分子β-catenin和Cyclin D1表达的影响 Western blot结果显示,与NC组相比,FUT2低表达组中β-catenin蛋白的表达水平并无明显变化,但是Wnt/β-catenin信号通路的下游关键信号分子Cyclin D1的表达水平在FUT2低表达组显著降低(P<0.05),见图6,提示FUT2可能参与了Wnt/β-catenin信号的传导。
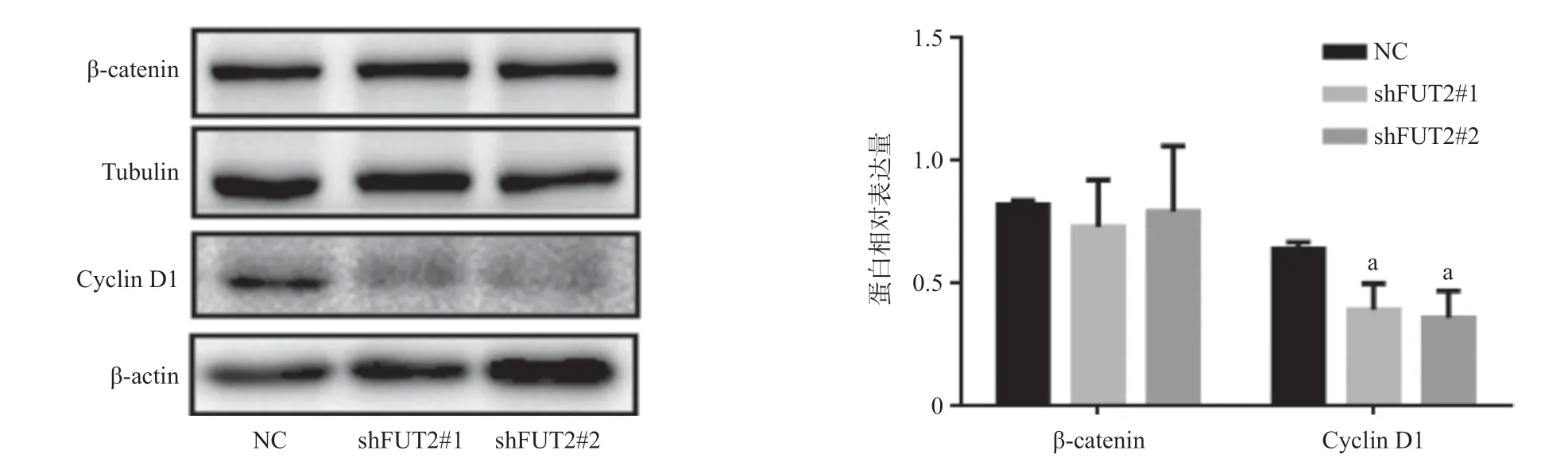
图6 FUT2对β-catenin和Cyclin D1蛋白表达的影响
2.7 FUT2对ICAM-1蛋白的表达影响 ICAM-1是一种黏附分子,可以作为受体分子介导细胞的黏附,同时也具有信号转导受体的功能。Western blot结果表明,FUT2低表达组(shFUT2#1、shFUT2#2)中ICAM-1的表达量显著高于NC组(P<0.05),见图7,提示干扰FUT2能促进ICAM-1的表达,进而影响细胞的黏附能力。

图7 FUT2对ICAM-1蛋白表达的影响
3 讨论
糖基化是蛋白质翻译后修饰最为常见的一种修饰方式,通过糖基化修饰赋予了蛋白质更为多样的结构及功能,以执行细胞内的各种复杂多样的生命活动。许多细胞膜表面受体及转录因子都存在糖基化修饰位点,影响蛋白质功能的发挥。蛋白质的异常糖基化现象在肿瘤中较为常见,在乳腺癌、肺癌、结直肠癌和前列腺癌中均有发现由糖基转移酶异常表达而催化产生的异常糖基化现象[14]。FUT作为介导岩藻糖基化修饰的关键酶,在肿瘤的发生发展中往往存在异常的表达,与肿瘤的发生发展密切相关[13,15]。
基于前列腺癌组织芯片的检测结果发现FUT2在前列腺癌与正常前列腺组织中的表达量存在差异;通过脂质体转染技术将空载载体和低表达载体转染到前列腺癌PC-3细胞中,采用抗药性筛选得到稳定低表达的FUT2前列腺癌细胞株,一系列生物学功能研究表明,FUT2能促进前列腺细胞的增殖、迁移和侵袭,进而影响前列腺癌的发生发展。
Wnt/β-catenin信号通路与器官形成、组织再生等有关,越来越多的研究报道证实,在肿瘤中经常出现经典Wnt信号通路被激活的现象,与肿瘤的发生发展存在密切的联系[16-17]。Cyclin D1是Wnt/β-catenin信号通路下游的关键信号分子,其表达水平的升高往往提示Wnt/β-catenin信号通路的活化。本研究结果表明干扰FUT2的表达能显著抑制Cyclin D1的表达水平,提示FUT2可能参与了Wnt/β-catenin信号通路的调控。同时本研究发现干扰FUT2的表达并不影响β-catenin的表达。作为Wnt/β-catenin信号的核心分子,β-catenin的磷酸化水平及其核浆分布将决定了该信号通路的活化状态[18]。因此,FUT2是否参与了Wnt/β-catenin信号通路的调控有待进一步深入探讨。另一方面,Cyclin D1作为一种S期周期蛋白对细胞周期具有重要的调控作用[19],这可能与下调FUT2表达能抑制PC-3细胞增殖相关。此外,FUT2对调黏附因子ICAM-1表达水平的调控作用,可能与前列腺癌细胞的迁移侵袭能力相关。
综上所述,FUT2在前列腺癌组织中表达水平异常升高,干扰FUT2的表达能抑制前列腺细胞的增殖、迁移、侵袭等生物学功能,表明FUT2在前列腺癌的发生发展过程中具有一定的调控作用,可能是前列腺癌诊疗潜在的靶标,但相关的作用机制有待进一步深入探讨研究。
