超声造影LI-RADS在隐匿性乙肝患者肝细胞癌诊断中的应用
2022-11-03颜建飞陈方红卢伟业陈志辉潜潇
颜建飞,陈方红,卢伟业,陈志辉,潜潇
丽水市中心医院 超声科,浙江 丽水 323000
从2007年至2016年肝细胞癌(hepatocellular carcinoma, HCC)发病率每年增加23%,乙型肝炎病毒(hepatitis B virus, HBV)感染是HCC高发病率的主要原因[1-2]。在慢性HBV感染患者中,以血清乙型肝炎表面抗原阴性和乙型肝炎核心抗体阳性为特征的人群数量最近有上升趋势,无论是否有乙肝表面抗体阳性,都被称为隐匿性乙肝感染(occult HBV infection, OBI),OBI患者的HCC患病率可能高达40%~75%[3]。2017年美国放射学会发布了超声造影肝脏成像报告和数据系统(contrast-enhanced ultrasound liver imaging report and data system, CEUS LI-RADS),该系统对肝癌高风险患者的技术、解释、报告和数据收集进行了标准化[4]。TERZI等[5]研究证实CEUS LI-RADS 5类(LR-5)对HCC具有高度特异度,使其能够作为可靠的非侵入性诊断;但这些研究仅涉及肝硬化和“显性”慢性乙型肝炎患者。CEUS LI-RADS是否对OBI患者诊断HCC有帮助,目前缺乏证据。本研究旨在探讨CEUS LI-RADS的诊断性能以及诊断算法对OBI患者诊断HCC的可行性。
1 对象和方法
1.1 对象 回顾性分析2018年1月至2021年12月丽水市中心医院病例系统中448例OBI患者,41例患者因诊断不明确被排除,36例患者因肝硬化被排除,37例患者因缺乏动态超声造影(contrast-enhanced ultrasound, CEUS)图像被排除,最终334例OBI患者的334个肝结节的CEUS资料。患者年龄为34~81(56.1±11.6)岁,结节特征见表1。纳入标准:①年龄≥18岁;②OBI患者(乙肝核心抗体阳性和表面抗原阴性);③抗丙型肝炎病毒抗体阴性;④影像系统中记录存储了动态影像资料;⑤具有明确的诊断结果,病理活检(包括手术或穿刺)或综合临床影像[5](包括CT增强或磁共振增强与临床病例资料随访结合)。排除标准:①任何原因引起的肝硬化(病毒性、酒精性、非酒精性脂肪肝、遗传性、血管性等);②脂肪肝或结节位置深,影像质量差;③诊断不明确的。本研究通过医院伦理委员会审批(2022-113),所有患者均于CEUS检查前签署知情同意书。
1.2 仪器与方法 采用Logic E9超声诊断仪(美国GE公司),6C1凸阵探头(频率为1~6 MHz);RS80A超声诊断仪(韩国三星公司),7C1凸阵探头。患者取平卧位或左侧卧位,常规超声描述病灶的数目、大小、位置、回声及肝脏背景。然后选取目标病灶进行CEUS检查。在肘正中静脉注射2.0 mL六氟化硫微泡,超声造影剂需在2~3 s内匀速推注,然后用5~10 mL 0.9%氯化钠溶液以2 mL/s的推注速度冲管。在注射造影剂后开始计时,连续记录动态成像80 s,间断扫描病灶并记录5 min以确定廓清特征。
1.3 CEUS LI-RADS图像分析 所有CEUS均由两位分别有12年肝脏超声和9年CEUS经验的超声科副主任医师进行双盲、随机和独立检查,且对病理检查结果和其他影像学表现不知情。当意见不一致时,由第3位有20年肝脏超声和CEUS经验的超声科主任医师重新评估,直到达成共识。根据CEUS LI-RADS 2017版[6]对所有结节进行分类,并被分为LR-1类~LR-5类或LR-M类:动脉期高增强定义为与周围实质相比,完全或部分(既非环状也非周围间断)高回声。廓清是指在动脉后期或门脉期、延迟期开始的相对于肝脏的整体或部分的低强化。早期廓清发生在注射对比剂后60 s内。当确定为良性时划分为LR-1类;当最大径<10 mm的实性结节或任何大小的非肿块样特征在所有阶段均显示等强化时划分为LR-2类;当不符合其他分类标准,且有中等概率为HCC或良性时划分为LR-3类;当超声图像特征提示HCC可能但不能明确诊断HCC时划分为LR-4类;当确定为HCC时划分为LR-5类。当发现可能或肯定是恶性,但不是HCC的特征时[呈动脉期环状增强或早期廓清和(或)2 min内显著廓清]划分为LR-M类。根据甲胎蛋白(alpha fetoprotein, AFP)值是否>25 μg/L分为两亚组分析(AFP正常值<20 μg/L[7],由于每个检验单位略有差异,丽水市中心医院AFP正常值<25 μg/L)。
1.4 统计学处理方法 采用SPSS25.0软件进行统计分析。计量资料以±s表示;计数资料以百分比表示,组间比较用配对χ2检验。从精确度、灵敏度、特异度、阳性预测值(positive predictive value,PPV)和阴性预测值(negative predictive value,NPV)等方面评估总体诊断能力,并计算诊断优势比(odds ratio, OR)。P<0.05为差异有统计学意义。
2 结果
2.1 OBI患者结节特征 AFP在21.0%(70/334)患者中升高。以222例病理和112例综合影像学临床随访为参考标准。其中234个(占70.1%)为恶性,100个(占29.9%)为良性。234例恶性肿瘤包括120例HCC、66例肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC)、34例转移癌、6例混合肝细胞胆管癌(cholangiocarcinoma, CHC)和8例其他恶性肿瘤,见表1。

表1 OBI患者结节特征
2.2 各种LI-RADS分类的结节病理类型 按LR-4、LR-5、LR-M分类诊断为HCC的比例分别为18.2%(4/22)、74.5%(70/94)和29.9%(46/154)。LR-5类的结节除70例HCC外,其他24例包括2例ICC、2例CHC、2例转移癌、6例其他恶性肿瘤和12例良性结节。各种LI-RADS分类结节的不同病理类型见表2。

表2 OBI患者按LI-RADS分类的334个结节不同病理类型的比率[个(%)]
2.3 LR-5类对OBI患者及不同亚组的诊断HCC的性能 308例有AFP记录的患者,其中HCC 118例(占38.3%),根据AFP是否>25 μg/L对患者进行亚组分析。AFP>25 μg/L组70例,60例HCC,6例ICC,2例CHC,2例转移瘤。其中LR-5类40例,包括38例HCC和2例ICC,其他30个结节为LR-M类。LR-5类诊断AFP>25 μg/L组HCC的灵敏度、特异度、精确度、PPV和NPV见表3。AFP≤25 μg/L组238例,其中58例HCC,60例ICC,26例转移瘤,4例CHC,其他恶性肿瘤14例,良性结节96例。LR-5类诊断AFP≤25 μg/L组HCC的灵敏度、特异度、精确度、PPV和NPV见表3。LR-5类在AFP>25 μg/L组的PPV显著高于AFP≤25 μg/L组,差异有统计学意义(χ2=15.438,P<0.001);两个亚组间的灵敏度和特异度比较差异无统计学意义(χ2=0.814、0.519,P>0.05),见表3。
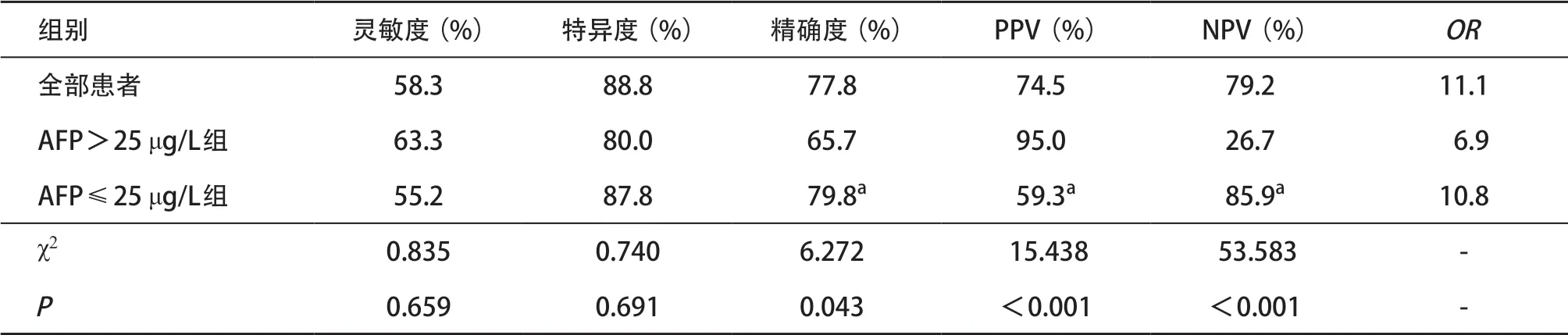
表3 LI-RADS LR-5类对OBI患者HCC的诊断性能
2.4 OBI患者CEUS影像图 AFP>25 μg/L OBI患者超声影像:CEUS显示动脉期高强化,晚期轻度廓清,根据CEUS LI-RADS 2017版为LR-5类,直接采取手术,手术证实为HCC,见图1。AFP≤25 μg/L的OBI患者超声影像:CEUS动脉期高强化,晚期轻度廓清,根据CEUS LI-RADS 2017版为LR-5类,采取穿刺活检措施,穿刺病理结果为HCC,见图2。

图1 男,67岁,OBI患者,AFP 427.13 μg/L,手术证实为HCC,根据CEUS LI-RADS 2017版为LR-5类

图2 男,45岁,OBI患者,AFP 2.18 μg/L,穿刺病理为HCC,根据CEUS LI-RADS 2017版为LR-5类
3 讨论
据报道,先前HBV感染可导致HBV或HCV血清结果阴性患者有HCC发病的风险[8-10]。目前国内外文献中很少有关于OBI患者的HCC诊断。本研究首先探索CEUS LI-RADS系统在OBI患者中预测HCC风险的诊断性能。发现LR-5类对OBI患者诊断HCC的灵敏度、特异度和PPV不够高;但在AFP>25 μg/L的OBI患者中,LR-5类诊断HCC的PPV比较高。
本研究结果表明,OBI患者的HCC发生率远低于HCC高危风险患者。TERZI等[5]和ZHENG等[11]的研究显示高危患者HCC病变发生率为75%~81%,本研究OBI患者的HCC发生率为38.3%。欧洲研究协会[12]提出了肝细胞癌中度风险的概念,但没有具体确切的定义;基于本研究HCC的实际患病率,认为OBI患者为中度风险。除HCC外,其他恶性肿瘤也占较大比例,其中ICC占19.8%,转移癌占10.2%。因此,OBI患者HCC的诊断较为困难,随着近年来OBI发病率的增加,HCC的诊断标准对患者的治疗至关重要。
本研究OBI患者LR-5类的比例也低于HCC高危风险患者。TERZI等[5]和ZHENG等[11]既往研究报道高危患者中LR-5类结节占52%~57%,但本研究LR-5类结节并不多见(占28.1%),OBI患者HCC发病率低可能是其主要原因[13]。本研究LR-5类结节中HCC比例(74.5%)也低于高危风险患者HCC的比例(97%~99%)[5,11]。本研究结果显示,OBI患者中许多非HCC结节造影表现与HCC难区分,其原因可能是部分非HCC恶性肿瘤CEUS表现类似典型的HCC造影特征,即动脉期高增强后伴有晚期轻度廓清[14];另外的原因可能是OBI患者中一些不典型良性结节,部分FNH和炎性结节被分配到LR-5类,在OBI患者中较难区分HCC和这些非典型良性结节的图像特征。因此,OBI患者用LR-5类作为HCC诊断标准的特异度不够高。此外由于HCC的总体发生率低(35.9%),LR-5类在OBI患者中作为HCC预测因子的PPV较低,表明CEUS LI-RADS系统对OBI人群的非侵入性诊断HCC性能未令人满意。
血清AFP至今仍被广泛用作HCC的筛查[15]。本研究50.8%的HCC患者AFP>25 μg/L,并且探讨CEUS LI-RADS在这些OBI患者中的诊断性能如何。本研究发现在AFP>25 μg/L的情况下进行HCC诊断时,大多数非HCC恶性肿瘤和所有良性结节都被排除在外;应用LR-5类诊断HCC的PPV明显提高,但灵敏度几乎没有增加。基于高PPV,本研究提出LR-5类可能是AFP>25 μg/LOBI人群中HCC可靠的诊断算法,有13.0% OBI患者诊断为HCC。对AFP≤25 μg/L的OBI患者,19.2%患者为LR-1/2/3类。对于这些良性(LR-1和LR-2)或LR-3患者不需要进行活检,临床定期随访即可。对于剩余67.9%的患者包括AFP>25 μg/L的LR-M类和AFP≤25 μg/的LR-4/5/M类,则还需要进行活检。
本研究有一些局限性:首先,回顾性研究可能会导致选择偏差,影响普遍性,并非所有常规超声检测到的肝结节都需要接受CEUS检查,许多良性病变如囊肿和血管瘤通过常规超声可以得到明确诊断;本研究不同类型结节的发生率不能反映其在OBI患者中的真实发病率。其次,一些良性病变缺乏病理标准和确切随访信息而无法确诊,也没有被纳入分析,这导致不同LR类别结节的分布有可能不同。
