马铃薯StBI-1 基因鉴定及其抗疫霉菌的功能探索
2022-11-03高贤贤孔乐辉史青尧单卫星强晓玉
高贤贤孔乐辉史青尧单卫星强晓玉
(西北农林科技大学农学院,陕西杨凌 712100)
细胞死亡是植物生命进程中的重要生理活动,不仅参与植物正常生长发育过程,还在植物响应生物与非生物胁迫中发挥重要作用[1]。为应对病原菌侵染,植物进化形成了PTI(PAMP-Triggered Immunity)和ETI(Effector Triggered Immunity)两层先天免疫反应系统[2]。病原菌侵染可引发植物PTI免疫反应,进而产生活性氧迸发并诱发植物细胞死亡;而植物ETI免疫反应通常会引发超敏反应(Hypersensitive Reaction,HR),HR 相关的细胞死亡可有效阻止病原菌在植物体内定殖和扩展[3-4]。在哺乳动物体系中,细胞凋亡由Bcl-2基因家族编码的蛋白调控,当细胞感知凋亡信号后,Bcl-2家族蛋白通过调节线粒体中细胞色素C的释放以促进或抑制细胞凋亡产生[5]。然而,植物中尚未鉴定到Bcl-2同源基因,但研究发现植物Bax inhibitor 1(BI-1)可抑制细胞凋亡相关蛋白BAX 诱导的细胞死亡,进一步揭示了动植物之间可能存在保守的细胞死亡机制[6]。
BI-1最初在人类cDNA 文库中筛选鉴定出来,可抑制酵母中Bax诱导的细胞死亡。BI-1编码定位于内质网膜的跨膜蛋白,是高度保守的、广泛存在于真核生物中的一类细胞死亡调节因子[7-9]。动物细胞中BI-1通常与多种疾病如癌症、糖尿病等相关,BI-1可调节内质网中Ca2+含量以及活性氧的产生进而调控免疫反应中的细胞死亡[10]。在植物中,BI-1也被证实参与各类生物和非生物胁迫[11]:过氧化氢和水杨酸可诱导拟南芥AtBI-1上调表达,并且过表达At BI-1可抑制Bax、过氧化氢和水杨酸诱导的细胞死亡[12];大麦中,过表达HvBI-1可抑制细胞死亡进而显著减少根部内生真菌印度梨形孢在植物根部的定殖[13];病毒侵染可诱导烟草中NbBI-1上调表达,当Nb-BI-1缺失后,植物体内病原菌的累积量显著增加[14];在拟南芥中过表达小麦TaBI-1可显著增强植物对Pseudomonas syringaepv.Tomato(Pst)DC3000的抗病性;另外,TaBI-1可正向调控水杨酸相关基因的表达[15]。
卵菌,尤其是疫霉属,是影响农业生产的一类重要病原菌,而由致病疫霉菌引发的马铃薯晚疫病是马铃薯生产中破坏性最大的一类病害,每年可造成巨大经济损失,是马铃薯产业可持续发展的关键制约因素之一[16]。并且随着病原菌毒性变异加快,品种抗性丧失问题尤为严重,因此亟需探索和挖掘新型抗病基因资源用于马铃薯抗病分子育种。尽管大量研究揭示了BI-1在植物响应生物和非生物胁迫中发挥作用,但是有关马铃薯StBI-1基因的鉴定分析及其影响植物抗疫霉菌的生物学功能尚不甚明了。本研究通过对拟南芥AtBI-1蛋白进行序列比对分析,鉴定到与之相似度为77.22%、且具有Bax inhibitor 1-like结构域的马铃薯BI-1 蛋白。基于此,本研究以马铃薯‘大西洋’品种cDNA 为模板,克隆获得马铃薯StBI-1基因。通过分析马铃薯响应致病疫霉菌侵染时StBI-1基因的表达模式,揭示StBI-1受致病疫霉菌侵染而诱导上调表达。基于农杆菌介导的烟草瞬时表达体系初步揭示过表达StBI-1可显著增强植物对疫霉菌的抗性,为挖掘马铃薯抗晚疫病新型基因资源及深入解析其抗病分子机理奠定理论基础。
1 材料与方法
1.1 材料
马铃薯‘大西洋’品种和‘陇薯12’品种,本氏烟草(Nicotiana benthamiana)为试验材料。生长条件:温度23℃,光照时间14 h 光照/10 h黑暗。
1.2 方法
1.2.1StBI-1基因系统进化树的构建 以At-BI-1蛋白序列为模板,首先利用NCBI(https://www.ncbi.nlm.nih.gov/)数据库BLASTP功能在马铃薯蛋白数据库中鉴定马铃薯中BI-1蛋白,并利用MEGA-X 软件构建系统进化树。利用在线网站SMART(http://smart.embl-heidelberg.de/)分析蛋白结构域。
1.2.2StBI-1表达模式分析 根据马铃薯St-BI-1基因序列设计引物,F:5'-TCCTCACAACATTGGCTTGC-3'; R: 5'-AGGACCAATAGAAGCGCCTT-3'。以St EF1α作为内参基因(F:5'-CAGAAGAAGGGAAAGTGAACAG-3';R:5'-CCGCCTATCAAGTACCCAGT-3')。马铃薯叶片接种致病疫霉菌游动孢子,并分别于3 hpi、6 hpi、12 hpi、24 hpi、36 hpi、48 hpi和72 hpi收取叶片样品,参照TRIZOL(Invitrogen)试剂说明书,提取马铃薯叶片RNA,按照Ta KaRa公司反转录试剂盒(Prime ScriptTMRT regent kit)说明书进行反转录得到马铃薯cDNA。实时定量PCR 检测基因表达模式,实时定量PCR 程序为:95 ℃预变性10 min;95 ℃变性15 s,55 ℃退火20 s,72 ℃延伸45 s,40个循环,基因相对表达量的计算采用2-△△Ct法。
1.2.3StBI-1基因克隆和载体构建 利用Primer 5软件设计分别带有XholⅠ和EcoR Ⅰ酶切位点的特异性引物F:5'-GGAGAGGACACGCTCGAGATGGAAGGTTTCACATCGT TCTT-3';R:5'-TAATTAACCCCATAAGCTTCTAGTTTCTCCTCTTCTTCTTCT-3'。以马铃薯品种‘大西洋’cDNA 为模板扩增St BI-1基因,将扩增产物连接到植物表达载体p Kannibal上并进行测序验证,测序正确的质粒为p Kannibal-StBI-1。将p Kannibal-StBI-1与双元载体p ART27分别用NotⅠ单酶切后进行连接转化,测序成功后即得到植物过表达载体p ART27::StBI-1。
1.2.4 农杆菌介导的烟草瞬时表达 将p ART27::StBI-1 转入农杆菌感受态GV3101中,28℃、200 r/min 培养;待菌液培养至橙黄色后,室温稍静置离心收集菌体,用含有乙酰丁香酮(终浓度为200μmol/L)的MES 重悬液重悬菌体;紫外分光光度计测量菌液OD600值,将菌液浓度调至0.3~0.5;重悬液在室温条件下孵育1 h后用1 m L 注射器注射烟草并作好标记;烟草叶片喷水保湿过夜,黑暗培养1 d,次日恢复正常条件,2~3 d后进行接菌试验。
1.2.5 病原菌的培养与接种 稳定表达GFP的寄生疫霉菌转化子1121以及致病疫霉菌88069用于侵染本氏烟草叶片。培养方式及离体叶片接种方式分别参考已报道的方法[17-18]。
1.2.6 Western Blot 收取注射区烟草叶片,用Hepes 缓冲液(250 mmol/L 蔗糖,50 mmol/L HEPES-KOH,5% 甘油,1 mmol/L Na2MoO4·2H2O,25 mmol/L NaF,10 mmol/L EDTA)提取蛋白样品。参考已报道的方法进行免疫印迹检测StBI-1蛋白表达情况[19]。
1.2.7 数据分析 利用Microsoft Excel 2010软件进行试验数据处理、显著性分析以及制图。
2 结果与分析
2.1 StBI-1 基因的鉴定与分析
从拟南芥数据库TAIR(https://www.arabidopsis.org)网站中下载拟南芥AtBI-1(AT5G47120)编码的蛋白序列,在马铃薯蛋白数据库中进行BLAST 检索,检索得到数条蛋白序列,将这些同源性较高的蛋白与AtBI-1进行蛋白多序列对比,并利用最大似然法构建系统进化树(图1-a)。其中马铃薯中与At BI-1亲缘关系最为接近的是NP_001305552.1(图1-a),两者相似度为77.22%。将编码这个蛋白的基因命名为St-BI-1,该基因全长747 bp,编码248个氨基酸。同时在SMART 网站对St BI-1基因所编码的蛋白进行分析,发现与其AtBI-1蛋白相似,包含7个跨膜域,并且包含Bax inhibitor-1-like结构域(图1-b)。

图1 StBI-1系统进化树及蛋白结构域分析Fig.1 Functional domain analysis and phylogenetic analysis of StBI-1
2.2 StBI-1 基因响应致病疫霉菌侵染的表达模式分析
为了揭示StBI-1响应致病疫霉菌侵染的表达模式,首先对炼苗后转移至土壤基质生长3周的马铃薯品种‘大西洋’和‘陇薯12’叶片分别进行致病疫霉菌游动孢子接种处理,并分别于3 hpi、6 hpi、12 hpi、24 hpi、36 hpi、48 hpi和72 hpi收取叶片样品,提取RNA 并反转录合成c DNA。进一步,利用实时荧光定量PCR 检测StBI-1基因的转录表达水平。结果表明,2个马铃薯品种中StBI-1响应致病疫霉菌侵染的表达模式相似(图2),在接菌24 hpi内,St BI-1基因的表达水平略有上调;而从36 hpi至72 hpi,StBI-1基因受致病疫霉菌侵染而显著诱导上调表达。同时通过比较分析发现,在响应致病疫霉菌侵染时,马铃薯抗病品种‘陇薯12’中St BI-1基因表达量始终高于马铃薯‘大西洋’品种,并呈现显著性差异(图2)。该结果揭示了StBI-1在马铃薯响应致病疫霉菌侵染时处于表达活跃状态,可能在马铃薯与致病疫霉菌的互作过程中具有重要功能。

图2 实时定量PCR 检测致病疫霉菌侵染阶段‘大西洋’和‘陇薯12’中StBI-1 表达模式Fig.2 Quantitative reverse transcription PCR analysis for the expression of StBI-1 in‘Atlantic’and‘Longshu 12’leaves at different time points after P.infestans inoculation
2.3 利用农杆菌介导的烟草瞬时表达体系分析StBI-1 抗疫霉菌的免疫功能
为了进一步探究StBI-1影响植物抗疫霉菌的潜在生物学功能,构建p35S::St BI-1-4myc植物表达载体用于功能验证(图3-a)。借助农杆菌介导的烟草瞬时表达体系,在烟草叶片上瞬时表达p35S::StBI-1-4myc和p35S::empty vector,并于表达2 d后,收取注射区叶片,Western Blot检测StBI-1蛋白表达情况。结果显示,表达St-BI-1-4myc的叶片中检测到StBI-1蛋白,且条带大小与预测大小一致(图3-b)。之后,对叶片进行寄生疫霉菌游动孢子接种处理,并于接菌36 h 后,统计病斑大小。结果显示,过表达StBI-1叶片病斑面积显著小于对照组,统计学分析表明两者病斑直径存在显著性差异(图4)。以上结果表明,过表达StBI-1可增强植物对寄生疫霉菌的抗病性。

图3 StBI-1 过表达载体构建和验证Fig.3 Construction and verification of StBI-1 overexpression vector
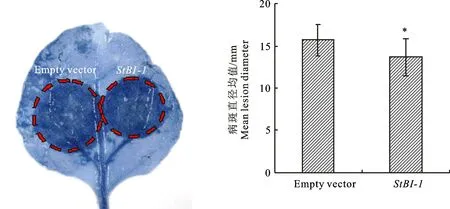
图4 过表达StBI-1 增强植物对寄生疫霉菌的抗性Fig.4 Overexpression of StBI-1 enhanced plant resistance to P.parasitica
此外,进一步分析了StBI-1影响植物抗致病疫霉菌的免疫功能。借助农杆菌介导的烟草瞬时表达体系,在烟草叶片上瞬时表达p35S::StBI-1-4myc和p35S::empty vector,并于2 d后,对叶片进行致病疫霉菌游动孢子接种处理,接菌6 d后,统计病斑大小。结果显示,过表达StBI-1叶片病斑面积显著小于对照组,并且统计学分析表明两者病斑直径存在显著性差异(图5)。该结果揭示了过表达StBI-1也可增强植物对致病疫霉菌的抗病性。

图5 过表达StBI-1 增强植物对致病疫霉菌的抗性Fig.5 Overexpression of StBI-1 enhanced plant resistance to P.infestans
3 讨论
由疫霉属卵菌引发的植物病害严重威胁着马铃薯生产及可持续农业发展,并且疫霉菌毒性变化较快,导致品种抗性丧失问题极为突出。因此亟需挖掘新型抗病基因资源,并深入解析其免疫作用机制,以有效推进马铃薯抗病分子育种。本研究鉴定并克隆马铃薯StBI-1基因,并初步探究其响应致病疫霉菌侵染的表达模式及抗疫霉菌的免疫功能,研究结果揭示St BI-1在植物与疫霉菌的互作过程可能发挥重要作用。
前人报道表明病原菌入侵以及非生物胁迫均可诱导植物BI-1表达上调[20]。例如,植物损伤或病原菌入侵均可诱导拟南芥AtBI-1上调表达;小麦条锈菌侵染或高温条件下,小麦TaBI-1转录水平均呈现上调;盐胁迫可诱导棉花Gh BI-1表达水平上升[15,21-22]。本研究发现,St BI-1可响应致病疫霉菌侵染而诱导上调表达,尤其在接菌后36~72 h上调表达水平更为显著(图2),并且在马铃薯抗病品种‘陇薯12’中StBI-1基因的表达量更高(图2)。致病疫霉菌作为兼性营养型病原菌,其在入侵植物后期则转入死体营养生长阶段[16],推测在植物与致病疫霉菌互作后期,StBI-1可能通过抑制植物细胞死亡而阻止病原菌的进一步扩展。
为有效应对病原菌入侵,植物进化形成了PTI和ETI两层免疫系统[2]。而植物的免疫反应通常会伴随细胞死亡事件的发生[4],作为植物免疫应答的关键机制,细胞死亡在植物响应生物和非生物胁迫中扮演着重要角色。植物与病原菌互作过程中,植物免疫系统引发超敏性细胞死亡通常被认为是阻止活体营养型病原菌和兼性营养型病原菌定殖和扩展的有效策略[3]。作为一个保守的细胞死亡调节因子,BI-1被证实参与调节植物与病原菌互作中的细胞死亡事件,并且BI-1与不同蛋白相互作用来影响内质网Ca2+含量以及活性氧的累积进而调控植物细胞死亡[23-24]。此外,BI-1也被证实参与调节内质网应激介导的细胞死亡,而前期研究揭示了寄生疫霉菌可引发拟南芥植株产生内质网应激,并诱导内质网应激信号通路UPR(unfolded protein response)[25-26]。由此推测,StBI-1可能通过调节内质网应激介导的细胞死亡而影响植物对疫霉菌的抗性。本研究中初步证实StBI-1参与植物对疫霉菌的响应,过表达StBI-1可显著抑制疫霉菌在植物中扩展。然而StBI-1是否调控致病疫霉菌侵染引发的植物细胞死亡尚不清楚,后续我们将借助农杆菌介导的遗传转化技术制备过表达StBI-1和RNAi沉默St BI-1的马铃薯稳定转化植株,在明确St-BI-1影响马铃薯抗晚疫病的免疫功能基础上,通过分析病菌侵染的寄主细胞内活性氧累积水平、钙离子流的变化及内质网应激反应等,以期深入解析马铃薯响应致病疫霉菌侵染时产生的植物细胞死亡作用机制,进而揭示StBI-1参与调控马铃薯抗晚疫病的作用机制,为马铃薯新型抗病基因资源挖掘和抗病分子育种提供理论基础。
