细胞焦亡与血管重塑相关疾病的研究进展*
2022-11-03陈颖弘吴学铭综述李鹏云审校
陈颖弘,李 倩,吴学铭 综述,李鹏云 审校
(西南医科大学医学电生理学教育部重点实验室/四川省心血管疾病防治协同创新中心/心血管医学研究所,四川泸州 646000)
细胞焦亡(pyroptosis)又叫细胞炎性坏死,是新近发现并证实的一种程序性细胞死亡方式,与炎症反应密切相关。其典型特征是细胞膜肿胀破裂,促炎因子和细胞质内容物释放到细胞外,引发机体产生炎症反应。目前研究发现,细胞焦亡广泛参与感染性疾病、神经系统相关疾病及动脉粥样硬化等疾病的发生、发展,靶向细胞焦亡可有效改善这些疾病相关的病理学过程。近年来研究证实,在心肌缺血、高血压、糖尿病等血管重塑性疾病的发生、发展过程中,核苷酸结合寡聚化结构域样受体蛋白3(nucleotide binding oligomerization domain-like receptor protein 3,NLRP3)炎性小体、半胱天冬酶(caspase)、Gasdermin D (GSDMD)、白细胞介素(IL)-1β等细胞焦亡相关因子参与血管重塑过程。然而,细胞焦亡如何影响血管重塑性疾病的发生、发展需要进一步研究。探究细胞焦亡在血管重塑方面的作用及其机制,可为靶向细胞焦亡治疗心血管疾病提供潜在的治疗靶点,为多种心血管疾病的临床防治研究奠定理论基础。
1 细胞焦亡的分类及其机制
程序性细胞死亡是由基因调控的细胞主动死亡过程。以往细胞凋亡被认为是程序性死亡的唯一形式,但近期研究发现细胞主动死亡的方式还包括细胞焦亡和程序性坏死。细胞焦亡与凋亡、坏死等其他细胞死亡方式在形态特征、发生和调控机制上均有不同。细胞焦亡除了具有与细胞凋亡相似的细胞核皱缩、外吐小泡、DNA断裂等现象之外,也可表现出细胞肿胀破裂、炎性内容物释放等细胞坏死的特征。相关研究发现,细胞焦亡是依赖caspase家族切割GSDMD蛋白导致细胞死亡的方式,包括依赖caspase-1的经典途径和依赖caspase-4/5/11的非经典途径[1]。
caspase是一类存在于细胞质内,具有同源性相似结构特征、含半胱氨酸的天冬氨酸蛋白水解酶,为细胞焦亡信号通路的核心。在正常细胞中,caspase通常以非激活的酶原形式(pro-caspase)存在于细胞质中,被激活后才能进行底物识别和切割。迄今为止,在人体内已经发现了13种caspase,在小鼠中有11种caspase。根据结构和功能的差异,caspases主要可分为促凋亡类和促炎性类:其中凋亡类主要包括caspase-2/3/6/7/8/9/10,它们以级联放大的方式对细胞内蛋白进行高效切割,进而导致细胞凋亡;促炎性类主要包括caspase-1/4/5/11/12/13,主要介导炎症反应,可促进细胞因子如IL-1β前体(pro-IL-1β)和IL-18前体(pro-IL-18)激活形成成熟有活性的IL-1β和IL-18,最终引起细胞焦亡[2]。
Gasdermins是细胞焦亡的效应执行蛋白,普遍表达于多种细胞和组织类型中。人类的Gasdermins由Gasdermin A(GSDMA)、Gasdermin B(GSDMB)、Gasdermin C(GSDMC)、GSDMD、Gasdermin E(GSDME)和Pejvakin(PJVK)组成[3]。除PJVK外,大多数Gasdermins都有两个保守的结构域,N末端成孔结构域和C端阻遏物结构域。Gasdermins的N末端具有细胞毒性,可插入细胞膜并形成较大的寡聚孔,破坏质膜完整性,引起胞内钾离子(K+)外流、细胞外钠离子(Na+)和钙离子(Ca2+)内流,破坏正常的离子稳态和渗透屏障。渗透压变化一旦超过细胞的代偿能力,大量液体进入细胞,最终导致细胞膨胀、破裂和死亡,即细胞焦亡[4-5]。
1.1 经典途径
由caspase-1介导的细胞程序性死亡是焦亡的经典途径(图1)。细胞通过病原体相关分子模式(pathogen associated molecular patterns,PAMPs)和损伤相关分子模式识别危险信号(damage associated molecular patterns,DAMPs),激活细胞质内的模式识别受体(pattern recognition receptors,PRRs)。PRRs被激活后,其热蛋白结构域可以募集细胞质中的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a carboxy-terminal,ASC),并与之结合成复合体,共同招募pro-caspase-1,组装形成炎性小体[6-7]。该炎性小体使相邻的两个pro-caspase-1发生水解,成为具有酶活性的caspase-1分子,继而活化pro-IL-1β和pro-IL-18,导致细胞焦亡。激活后的caspase-1分子,不仅能介导促炎症细胞因子IL-1β和IL-18的成熟和分泌,还可以进一步切割下游GSDMD目的蛋白,将GSDMD蛋白分割成亲脂性N端结构域和亲水性C端结构域,其中N端结构域与生物膜结合,在膜内侧聚集形成孔道,使水分子进入细胞,触发细胞焦亡[8]。
1.2 非经典途径
非经典焦亡途径依赖于caspase-4/5/11的激活(图1)。在细菌等信号刺激下,小鼠的caspase-11或人类的caspase-4/5/11被活化,识别并结合脂多糖,进一步切割GSDMD形成含有切割活性的N端结构域,促进细胞焦亡[9]。虽然caspase4/5/11并不直接介导IL-1β和IL-18的产生,但GSDMD介导的K+外流可诱导NLRP3炎症小体的产生和IL-1β的激活[10]。同时,激活的caspase-4/5/11在NLRP3和ASC存在下可以与caspase-1相互作用,促进其激活,引起经典途径的细胞焦亡。进一步研究发现,细胞膜上的缝隙连接蛋白-1 (pannexin-1)在调控小分子物质进出细胞膜方面起着关键性的作用。活化的caspase-11通过裂解细胞膜通道蛋白pannexin-1导致ATP的释放并激活细胞膜上的P2X7通道,细胞内外离子平衡被打破,促进细胞焦亡[11]。
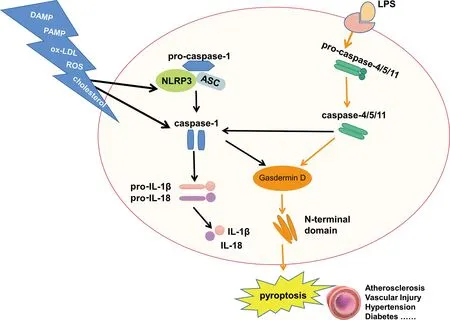
图1 细胞焦亡的经典途径和非经典途径
2 细胞焦亡与血管重塑性疾病
2.1 细胞焦亡与动脉粥样硬化
动脉粥样硬化时管壁内常有炎症细胞浸润,这些炎症细胞分泌的基质金属蛋白酶可以降解弹性蛋白和胶原,导致动脉中膜变薄,使血管发生正性重塑。正性重塑虽然可以代偿管腔的狭窄,但由于其斑块内含大量的巨噬细胞、坏死核心及薄纤维帽,更容易发生破裂,导致心脑血管突发事件。以往研究认为细胞凋亡与动脉粥样硬化的发生和发展密切相关。然而,凋亡的重要成分caspase-3在晚期动脉硬化病变中却很少被激活,敲除caspase-3不能改善动脉粥样硬化病变[12]。提示有新的细胞死亡方式参与动脉粥样硬化的发生和发展过程。
近年来越来越多的研究表明细胞焦亡在促进动脉粥样硬化斑块的不稳定中发挥重要的作用。动脉粥样硬化早期病变主要涉及血管内皮功能受损、脂肪沉积和单核细胞的招募聚集和浸润。研究表明血管内皮细胞的焦亡可通过激活caspase-1通路促进单核细胞向内膜和血管炎症处募集,而抑制caspase-1可显著减少外周血中单核细胞招募到血管内膜中[13]。在晚期病变中,巨噬细胞和平滑肌细胞的焦亡可使斑块的不稳定性增加。研究证实,巨噬细胞吞噬氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)和胆固醇晶体后可产生NLRP3炎性小体和caspase-1,激活IL-1β和IL-18,进而发生细胞焦亡[14-16]。此外,TNF-α可通过抑制NLRP3和IL-1β的激活来调控人平滑肌细胞的炎症反应,延缓动脉粥样硬化斑块的形成。焦亡的平滑肌细胞还可释放ox-LDL和促炎细胞因子,如IL-1β和IL-18,促进动脉粥样硬化的发生和发展[17-18]。大量的细胞焦亡和炎性因子的释放使炎症加剧,促进了斑块核心的形成,增加其不稳定性,故动脉斑块中的细胞焦亡与血管炎症反应和斑块破裂有密切联系。以上研究结果提示,NLRP3炎症小体与动脉粥样硬化关系密切,靶向NLRP3治疗可能成为动脉粥样硬化的一种代替策略。
2.2 细胞焦亡与冠心病
冠心病是由于冠状动脉狭窄、缺血引起的心脏功能异常的器质性病变。冠状动脉的重塑在冠心病的发生发展过程中发挥了重要作用。冠心病早期的偏心性斑块增加了血管壁的局部剪切力,刺激血管内皮扩张,伴有不稳定斑块的形成,使冠状动脉发生正性重塑,以维持正常的管腔面积和功能。随着病变的发展,斑块被纤维成分替代,并有钙盐沉积,使动脉管壁变硬,此时逐渐转为失代偿状态,表现为负性重塑[19]。细胞焦亡在冠心病发生发展过程中涉及经典和非经典两种途径。目前为止,大多数研究从细胞焦亡经典途径中各个环节释放的炎症因子含量、其是否增厚冠状动脉内壁面积、心脏功能能否得到改善等多方面来探讨与冠心病的联系。相关研究证实,随着冠脉血管病变程度的加重,血清中炎症小体NLRP3的水平也逐渐升高,进而促使冠状动脉血管壁IL-1β水平增加,激活caspase-1介导细胞焦亡参与冠心病的发生和发展[20-21]。相关研究证实,急性冠脉综合征患者外周血中的NLRP3小体表达量显著增多,且与冠状动脉病变程度及分叉病变的数目呈正相关[20-21]。NLRP3的高表达激活了caspase-1的活性,引起其下游IL-1β、IL-18等炎症因子通过GSDMD-NT细胞膜打孔作用大量释放,引起细胞焦亡,导致较为剧烈的炎症级联反应,进一步破坏血管内皮细胞并促进平滑肌细胞的迁移,增加冠状动脉壁厚度,促进冠状动脉粥样硬化的发展[22-23]。其他研究也发现,炎症小体caspase-1活性明显增强也会诱导促炎因子IL-1β、IL-18的激活,增加冠心病患者体内脂蛋白、胆固醇的水平,增强炎症反应和组织损伤[22,24]。抑制caspase-1的表达后,IL-1β、IL-18水平降低,进而抑制细胞焦亡和局部炎症反应,减轻冠脉血管损伤并改善心脏功能。提示靶向caspase-1抑制其下游的炎症通路可作为治疗冠心病的潜在靶点。此外,由于GSDMD是细胞焦亡经典途径和非经典途径的共同底物,IL-1β等其他炎症因子可通过GSDMD-NT打孔作用大量释放,引起细胞焦亡和炎症反应,导致多种缺血性疾病的发生。目前有发现靶向抑制GSDMD和GSDMD-NT的一些药物,可通过抑制细胞焦亡进而减缓冠心病的进展[23-24]。以上研究表明,靶向细胞焦亡信号通路中的NLRP3,caspase-1及GSDMD等可有效改善冠心病的病程,有望成为研究冠心病发生发展机制的重要切入点。由于目前细胞焦亡非经典途径研究较少,在冠心病发生发展中的作用和机制仍需进一步研究。
2.3 细胞焦亡与高血压
高血压病早期血流动力学异常,血管随之发生适应性改变。然而,长期慢性高血压会导致不良的血管重塑。在高血压发病过程中,大中动脉重构主要是通过增加内膜中层厚度、增大中心弹性动脉腔径来适应增加的周围血管壁应力,而远侧的肌性动脉腔径无变化。微循环障碍主要表现为小动、静脉数量减少,造成终端微循环组织缺失[25]。大动脉顺应性下降促进斑块形成,甚至管腔狭窄导致血流动力学异常[26]。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)是血管壁的主要结构细胞之一,在高血压等病理条件下,VSMCs的增殖迁移和表型改变导致血管重塑[27]。
近年来,越来越多的实验证明细胞焦亡参与调控高血压病血管重塑。研究发现,高血压大鼠VSMCs的NLRP3炎症小体和IL-1β表达明显增加,促进了大鼠VSMCs的增殖和表型转化,导致主动脉中膜厚度增加和血管管腔狭窄,引起外周阻力增加,血压上升又进一步加重了血管重塑,血管结构和功能受损,形成恶性循环[28-29]。另有研究发现,pro-caspase-1 mRNA的表达在高血压大鼠的主动脉和肾动脉中有上调趋势,这也间接证明了细胞焦亡在高血压引起的血管重塑中发挥了重要作用[20]。以上研究表明,引起细胞焦亡的NLRP3炎症小体在高血压状态下大中动脉VSMCs的表型转化引起的血管重塑中发挥重要作用。早期检测发现高血压VSMCs相关焦亡小体的表达增加,提示VSMCs焦亡可成为高血压病的一个诊断和治疗靶点。
2.4 细胞焦亡与糖尿病
血管重塑是始于糖尿病早期并贯穿糖尿病整个病理过程的血管结构和功能性的变化。在糖尿病早期,由于高血糖、胰岛素抵抗等因素的影响,血管内皮损伤激活内皮细胞和巨噬细胞释放大量炎症因子,NO分泌减少和内皮素表达增加进一步加重血管内皮细胞和VSMCs损伤。糖尿病血管的病理变化与动脉粥样硬化类似。糖尿病时,病变的小血管以VSMCs增生为主,从血管壁中膜迁移进入内皮下层的VSMCs异常增殖并合成大量的细胞外基质,导致微循环结构和功能改变;此外小血管还出现内皮细胞损伤、基底膜增厚,血管壁有无定型的玻璃样物质沉积等现象,造成小动脉的硬化[30]。
细胞焦亡介导的炎症反应在此阶段发挥了重要作用,在患有微血管和大血管并发症的患者中,细胞内线粒体的分解代谢增加,活性氧积聚增多,触发NLRP3炎性小体通路,一些炎症因子如caspase-1、IL-6等均有所增加[31]。另有研究发现,VSMCs中的糖基化终产物与其受体相互作用可激活细胞内GSDMD介导的焦亡信号通路,促进炎症和血栓形成[32-33]:细胞焦亡释放的炎症因子导致细胞焦亡相关因子IL-6、IL-8等分泌增加,进而促进糖尿病微血管的炎性病变和病理性重构。此外,当炎症小体被抑制后caspase-1水平会相应降低,一方面使糖尿病心肌对缺血再灌注损伤的敏感性降低,减缓心肌缺血再灌注损伤,缓解血管失代偿状态,减少了高糖、高胰岛素等造成细胞焦亡的危险因素。另一方面也减少了胰岛素抵抗,从而缓解糖尿病病理症状[34]。上述研究表明,靶向NLRP3、caspase-1等细胞焦亡相关的信号通路蛋白将为糖尿病的防治策略提供新思路。
3 小 结
血管重塑是多种疾病的代偿反应之一,在心血管疾病的发生、发展中至关重要。 细胞焦亡释放的炎症因子及激活的炎症反应是动脉粥样硬化、冠心病、高血压、糖尿病等血管重塑性疾病的重要发病机制。尽管目前多项动物研究证实,抑制细胞焦亡过程中的GSDMDs、NLRP3、caspase-1等关键蛋白可减轻炎症反应,有效延缓相关疾病的进展。GSDMDs激动剂或拮抗剂的研发将有可能改善血管重塑伴随的炎症反应。然而,对细胞焦亡和GSDMDs家族的研究还尚未成熟,具体的分子机制仍需进一步探索。
