ACTN4通过靶向NDUFV1对食管鳞状细胞癌的细胞增殖的影响
2022-11-02程晓敏谢一清康利平孙璋然耿慧武刘晓颖
冯 成,程晓敏,谢一清,康利平,孙璋然,范 旭,耿慧武,刘晓颖
食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)是我国常见的消化道恶性肿瘤,发病率和病死率居高不下,急需有效的诊断和治疗手段。α-辅肌动蛋白(alpha-actinins, ACTNs)定位于细胞-细胞和细胞-细胞外基质的接触部位,通过将膜受体与细胞骨架相连来调节不同信号通路的转导途径[1]。α-辅肌动蛋白家族有四个成员,α-辅肌动蛋白-4(alpha-actinin-4, ACTN4)作为成员之一,在细胞中的分布广泛,并能够参与多种细胞生命活动,如细胞增殖、细胞运动及上皮间质转化(epithelial-mesenchymal transformation, EMT)等[2-3]。同时,在细 胞信号转导过程中ACTN4也发挥着重要作用,如参与核因子κB(nuclear factor kappa-B,NF-κB)、Wnt / β-catenin等多种信号通路的调控[4-5]。在肝癌细胞中,ACTN4能够调控AKT/mTOR通路促进癌症的进展[6]。ACTN4已经被证实可以通过影响NF-κB的活性促进肿瘤细胞的迁移能力。该研究在ESCC中探究ACTN4的表达情况及其对细胞增殖的影响。
1 材料与方法
1.1 主要试剂与仪器
1.1.1试剂与抗体 RPMI-1640培养基、DMEM(高糖)培养基和Opti-MEM购于美国GE公司;胎牛血清购于美国CLARK Bioscience公司;胰酶消化液购于德国Bio-Froxx公司;Lipofectamine RNAiMAX和Lipofectamine 2000试剂购于美国Thermo-Fisher公司;一抗稀释液、青链霉素溶液、Western及IP细胞裂解液、苯甲基磺酰氟(PMSF)购自上海碧云天生物技术有限公司;DAB显色试剂盒购于北京中杉金桥生物技术有限公司;二甲亚砜(DMSO)购于德国Sigma-Aldrich公司;ACTN4、NADH ∶泛素氧化还原酶核心亚基V1(NADH ∶ubiquinone oxidoreductase core subunit V1, NDUFV1)和β-actin抗体购于武汉Proteintech公司。
1.1.2主要仪器 BSC-2级生物安全柜(1300 SERIES A2)、二氧化碳恒温培养箱(VIOS160i)(美国Thermo Fisher公司);倒置光学显微镜(TS-100,日本尼康公司);倒置荧光显微镜(Dmil LED,德国Leica公司);高速冷冻离心机(Allegra 30r,美国Beckman Coulter公司);恒压电泳仪(PowerPac Basic,美国BIO-RAD公司)。
1.1.3shRNA ACTN4 shRNA质粒由本实验室保存,序列见表1。

表1 针对ACTN4的shRNA序列
1.1.4组织和细胞 91例食管鳞状细胞癌组织于2016—2017年分批取自安徽医科大学第一附属医院普胸外科,经胸腹腔镜根治术切除的食管组织,在确保病理检测的前提下切取小部分组织分别保存于-80 ℃及福尔马林固定、包埋。所有患者于术前已阅读并签署“组织取材知情同意书”,并上报所在医院医学伦理部备案。食管鳞状细胞癌细胞ECA109和人胚胎肾细胞HEK 293T细胞为本实验室保存。
1.2 实验方法
1.2.1免疫组化实验 选取91例ESCC的组织芯片梯度复温;将组织芯片置于45 ℃二甲苯溶液中脱蜡25 min,重复1次;将组织芯片依次放入100%乙醇10 min,100%乙醇3 min,95%乙醇3 min,85%乙醇3 min,75%乙醇3 min,双蒸水1中3 min,双蒸水2中3 min,梯度脱蜡至水;3% H2O2去除内源过氧化氢酶30 min,PBS清洗3次;1%脱脂牛奶封闭30 min;4 ℃孵育一抗过夜,次日PBS清洗3次;室温孵育二抗30 min,PBS清洗3次;DAB溶液显色(时间根据情况而定),双蒸水终止反应;苏木精溶液染核1 min,双蒸水清洗,烘干后封片,镜下观察并委托武汉塞维尔生物技术有限公司进行扫描。
1.2.2免疫组化实验结果打分细则 对TMA芯片扫描结果进行打分,根据组织的染色强度和染色数目不同,将染色强度分为弱染色、中等染色和强染色三个等级,分别计为1~3分;将染色数目分为0~25%,26%~50%,51%~75%,76%~100%四个等级,分别计为1~4分。将二者相乘可得ACTN4在组织中的相对表达量得分。
1.2.3细胞培养 ECA109细胞使用含8%胎牛血清的RPMI-1640培养基,HEK 293T细胞使用含8%胎牛血清的DMEM(高糖)培养基,置于37 ℃、5% CO2、95%湿度的培养箱中分别培养;培养的细胞每2 d更换培养基,细胞汇合度大于90%时进行传代,使用胰酶消化液对细胞进行消化,用培养基终止消化反应并计数。
1.2.4shRNA敲低实验 将HEK 293T细胞以1×106个/孔的数量接种到6孔板。次日观察细胞状态及汇合度合适即可进行慢病毒包装,将 shACTN4-1/shACTN4-2/ pLKO.1(空载)、Rev、GAG和VSVG按2 ∶2 ∶2 ∶1的比例用Opti-MEM混合;再以1 ∶1的比例稀释Lipofectamine 2000试剂,将二者混合静置15 min;弃去6孔板中的培养基,加入上述混合液继续培养24 h;将ECA109细胞以2×105个/孔的数量接种到6孔板。第3日观察ECA109细胞状态及汇合度;HEK 293T细胞培养到24 h时,收取培养基离心保留上清液;弃尽ECA109细胞6孔板中的培养基,加入上述上清液并标记为4组:①未处理组(正常培养基);②pLKO.1组(阴性对照,pLKO.1慢病毒颗粒感染);③shACTN4-1组(shACTN4-1慢病毒颗粒感染);④shACTN4-2组(shACTN4-2慢病毒颗粒感染)。继续培养6 h后更换新鲜培养基;继续培养48 h后,可通过荧光显微镜观察慢病毒感染效率;若感染效率良好,则将细胞消化后转移至T25细胞培养瓶中,并用嘌呤霉素(4 μg/ml)药筛2 d,之后梯度降低嘌呤霉素浓度继续药筛,1周后检测shRNA敲低效果。
1.2.5Western blot实验 加入适量Western及IP细胞裂解液(含1% PMSF)裂解细胞,冰上静置30~40 min;4 ℃、14 000 r/min离心20 min;转移上清液,Bradfrod法测定蛋白浓度;样品加入上样缓冲液沸水浴5~10 min,每个样品取30 μg进行SDS-PAGE凝胶电泳,转移蛋白至PVDF膜;5%脱脂牛奶封闭1.5 h,TBST清洗3次,每次10 min;孵育一抗4 ℃过夜,次日TBST清洗3次;再室温孵育二抗1.5 h,TBST清洗3次;显影。
1.2.6细胞克隆形成实验 按照步骤1.2.4中进行操作,转染后48 h胰酶消化细胞后进行计数。按照1 000~2 000个/每孔将细胞接种到新的6孔板进行克隆形成实验,每3 d更换培养基,持续培养10 d后,观察单个克隆直径达到1 mm取出6孔板弃尽培养基,PBS清洗2次,预冷的70%甲醇固定10 min,结晶紫染色20 min,流动水洗去浮色,烘干后拍照记录。
1.3 统计学处理采用SPSS 16.0软件对实验数据进行统计分析。实验重复3次,所有计量资料取小数点后3位并用表示,使用t检验分析两组结果之间的差异性,P<0.05为差异有统计学意义;相关性分析采用斯皮尔曼相关(Spearman)系数法进行分析,依据两列成对等级的各对等级数之差来进行计算的,相关系数用ρ表示。
2 结果
2.1 ACTN4在ESCC组织中表达情况ESCC组织与正常食管上皮组织交替排列(n=91)(图1A),在ESCC组织中ACTN4呈现普遍的特异性高表达,且主要在细胞质内表达;在正常食管上皮组织中ACTN4同样在细胞质中存在,但表达量较低,并且随着食管上皮继续向表层分化,ACTN4的表达量逐渐减少(图1B)。TMA芯片打分结果显示ESCC组织中ACTN4的表达量高于正常食管上皮组织,二者差异有统计学意义(图1C)。进一步通过Spearman相关系数对打分结果和病例的病理信息进行统计分析(表2),结果显示ACTN4的表达与ESCC病例中临床病理特征均无相关性,但ACTN4在ESCC组织中的表达量高于正常食管上皮组织。据此推测ACTN4在ESCC中的表达上调是一个早期事件。
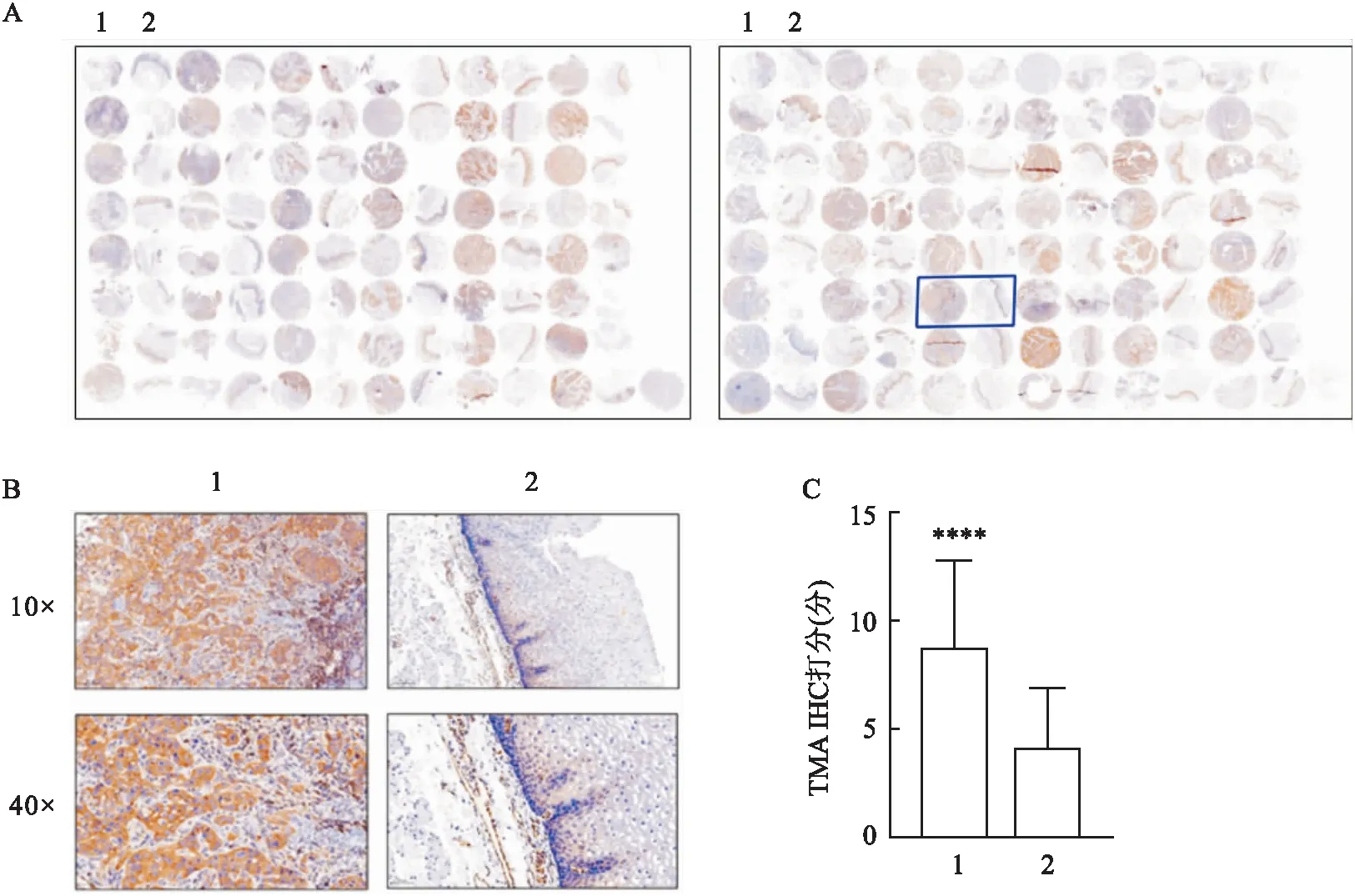
图1 IHC法检测ESCC组织中ACTN4的表达A:TMA组织芯片扫描图;B:ESCC组织和正常食管上皮组织ACTN4 DAB显色结果;C:TMA组织芯片IHC结果打分柱状图;1:ESCC组织;2:正常食管上皮组织;与正常食管上皮组织比较:****P<0.000 1
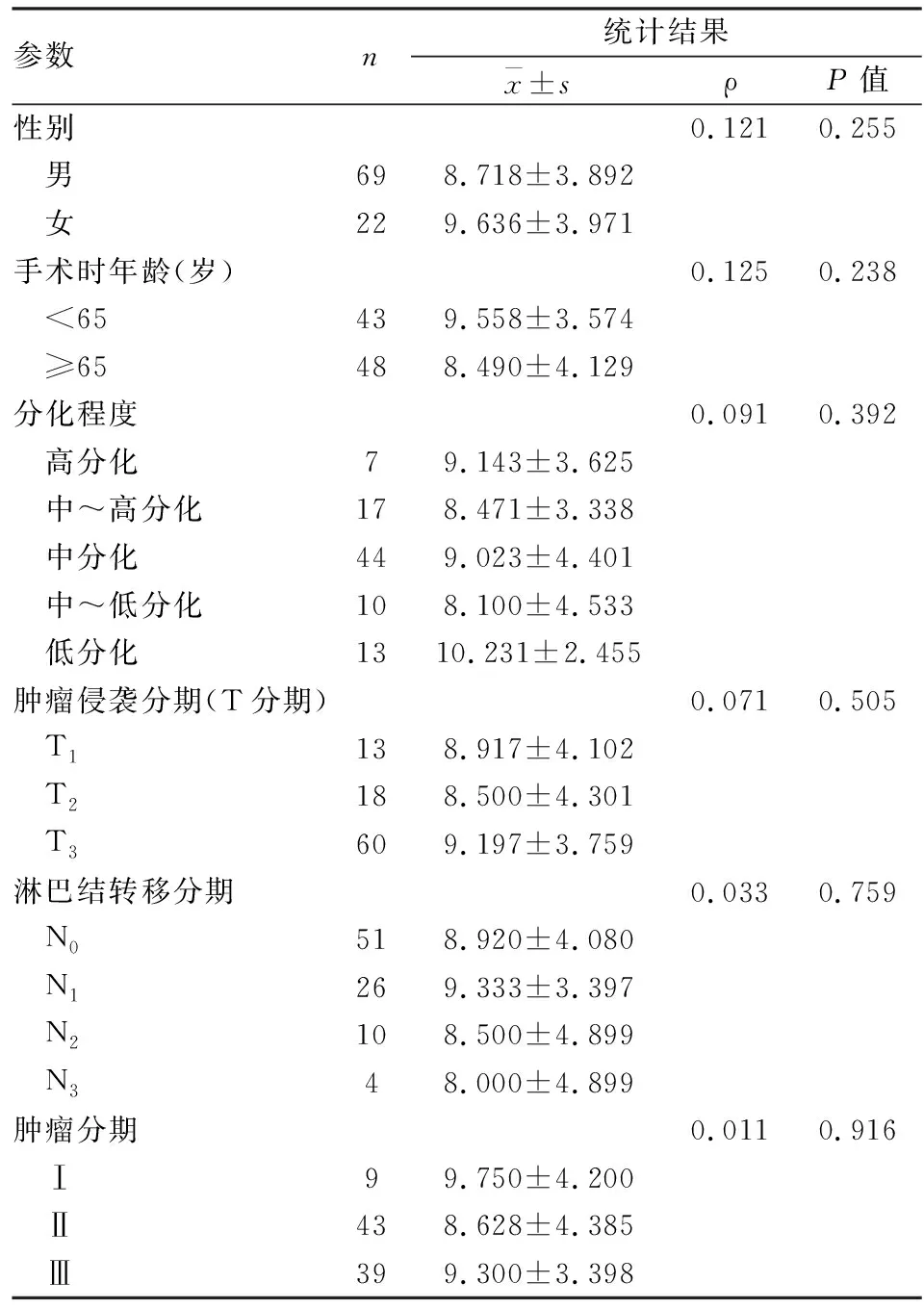
表2 TMA芯片打分和病理资料间的统计学分析
2.2 ACTN4稳定低表达ECA109细胞株的构建荧光显微镜观察慢病毒的感染效率,如图2A所示,绿色荧光占比可达约85%,表明ACTN4 shRNA慢病毒良好的感染效率。经过嘌呤霉素药筛后,细胞培养至汇合度90%~95%时收集细胞沉淀进行Western blot,结果显示shRNA敲低组相比于阴性对照组(pLKO.1)ACTN4的蛋白水平降低(图2B)。该结果表明,ACTN4稳定低表达的ECA109细胞株构建成功。

图2 ACTN4稳定低表达的ECA109细胞株的构建A:ECA109细胞感染ACTN4 shRNA慢病毒质粒48 h的感染效率图;BF:自然光;GFP:绿色荧光;B:ECA109细胞感染ACTN4 shRNA慢病毒质粒嘌呤霉素药筛后蛋白表达;1:pLKO.1组(阴性对照);2:shACTN4-1组;3:shACTN4-2组;4:未处理组
2.3 ACTN4 shRNA敲低对ECA109的细胞增殖的影响克隆形成实验结果显示,相比于阴性对照组,ACTN4 shRNA敲低组克隆的数量和大小都有明显降低(图3)。该结果提示,敲低ACTN4抑制了ESCC细胞的增殖,即ACTN4能够促进ESCC的细胞增殖。

图3 ACTN4稳定低表达ECA109细胞克隆形成染色结果1:pLKO.1组(阴性对照);2:shACTN4-1组;3:shACTN4-2组
2.4 ACTN4 shRNA敲低对NDUFV1蛋白表达的影响利用之前构建的ACTN4稳定低表达ECA109细胞株进行Western blot,结果显示,ACTN4敲低的ECA109细胞中NDUFV1蛋白水平降低。见图4。

图4 ACTN4 shRNA敲低下调NDUFV1蛋白表达1:pLKO.1组(阴性对照);2:shACTN4-1组;3:shACTN4-2组
3 讨论
癌症是威胁人类健康的主要杀手,食管鳞状细胞癌作为病死率极高的癌症,深入研究其发生发展并寻找有效的诊断和治疗手段非常必要。ACTN4属于肌动蛋白结合蛋白家族,最初被认为是一种与癌细胞运动密切相关的非肌肉型α-肌动蛋白。ACTN4具有许多不同功能,如参与细胞骨架的构建、调节核转录因子的活性及病毒的复制等[7-8]。研究显示,在多种肿瘤中ACTN4表达升高:在唾液腺癌和舌癌中发现其基因拷贝数存在异常,且其基因所在的染色体19q区域发生了异常扩增[9];在结直肠癌和肺癌中ACTN4呈现高表达且与淋巴结转移存在相关性[10]。ACTN4基因可能作为促癌因子参与某些肿瘤的侵袭、转移及细胞周期调控。研究[11]显示,ACTN4能够与远端上游元件结合蛋白1(FUBP1)相互作用调节原癌基因MYC的表达促进乳腺癌的发生发展;ACTN4已经被证实与EMT密切相关,能够调控NF-κB信号转导促进EMT的激活和发展,从而促进肿瘤细胞的迁移和侵袭。本课题组前期研究[12]表明,在黑色素瘤中ACTN4可以参与调节受体相互作用蛋白激酶1(RIPK1)的稳定性并激活NF-κB从而促进黑色素瘤的细胞增殖。这些研究表明ACTN4在肿瘤发生发展和转移中的重要性。本研究结果显示ACTN4在ESCC组织中表达上调,但其表达与目前掌握的病理资料中的临床病理特征无相关性;shRNA技术和克隆形成实验结果表明,ACTN4敲低抑制ESCC细胞的克隆形成能力,即ACTN4能够促进ESCC的细胞增殖。表明在ESCC发生的早期ACTN4就发生了高表达并通过促进细胞增殖促进ESCC的发展,且一直持续到恶性阶段,提示ACTN4作为ESCC早期诊断的预测标志物的可能;ACTN4促进细胞增殖的具体机制仍待探究。值得注意的是多项研究[13-14]表明ACTN4可影响细胞周期及细胞迁移能力,从而影响其生物学行为,进一步表明ACTN4可能为潜在的肿瘤治疗靶点。
研究显示,NDUFV1能够参与线粒体呼吸链氧化磷酸化为细胞提供能量的过程,NDUFV1的缺陷是线粒体功能障碍的常见原因,且与肌病、脑肌病和神经退行性疾病(如帕金森病和利氏综合征)有关[15];在肺癌细胞中敲除NDUFV1,细胞的存活和耐药能力显著降低[16]。本研究表明,在ESCC细胞中ACTN4敲低抑制了NDUFV1的蛋白表达。由此推测,ACTN4敲低所致的NDUFV1表达降低可能导致ESCC细胞内线粒体功能障碍,从而抑制ESCC细胞的增殖。这为进一步探究ACTN4在ESCC中的具体分子机制奠定了基础。
ACTN4参与了不同信号通路的调控,且越来越多的ACTN4相互作用蛋白被发现,丰富了ACTN4在肿瘤中的蛋白调控网络及作用机制研究,推动了以ACTN4为靶点的抗癌化合物的研发。如鞣花酸能够破坏ACTN4与β-catenin的相互作用从而抑制乳腺癌的转移[17]。基于不同肿瘤存在异质性及化疗药物存在毒副反应等问题,以及ACTN4可否作为肿瘤治疗的靶点仍需进一步探究。
