姜黄素对脂多糖诱导肺细胞损伤的作用及其机制研究*
2022-11-02邹国涛曾毅文钟绍文潘云波
邹国涛,曾毅文,钟绍文,潘云波
(重庆医科大学附属永川医院 儿科,重庆 402160)
急性肺损伤(acute lung injury,ALI)是一种危及生命的疾病,发病率和病死率较高,严重影响患者的生活质量[1]。重症监护病房ALI 患者病死率达35%~40%[2]。其特征是肺内过度炎症反应、肺泡-毛细血管屏障破坏及肺水肿导致的气体交换严重受损[3]。大量研究表明,革兰阴性菌感染是引起ALI的重要原因之一,而革兰阴性菌外膜的主要成分脂多糖(Lipopolysaccharide,LPS)可引起肺损伤和炎症反应[4]。因此,深入探究LPS 诱导的ALI 炎症发生机制将有助于确定新的治疗靶点。
长链非编码RNA(lncRNA)是一类长度>200 nt的非编码RNA,其在转录沉默/激活、染色体修饰、核内运输等方面具有重要作用[5]。有研究表明,一些lncRNAs 能够通过调节炎性介质的表达水平来增强或抑制炎症反应[6],例如lncRNA THRIL 在脓毒症小鼠的肺中高表达,对其敲降可减轻脓毒症小鼠肺部炎症反应,减少促炎细胞因子的产生[7]。最近研究表明,姜黄素能够缓解ALI 中炎症反应对ALI 具有一定的保护作用[8]。然而目前关于姜黄素在ALI 中的作用机制还有待进一步探究。本研究拟采用体外实验探讨姜黄素通过介导THRIL 表达对LPS 诱导的ALI 的调控机制。
1 材料与方法
1.1 细胞与主要试剂
人正常肺上皮细胞(BEAS-2B)购自美国ATCC细胞库,LPS 购自美国Sigma 公司,姜黄素购自上海生工生物工程股份有限公司,lncRNA THRIL 敲降和过表达载体购自广州瑞宝生物科技有限公司,DMEM 培养基、胎牛血清购自美国Gibco 公司,流式双染试剂盒(Annexin V-FITC/PI)购自日本TaKaRa株式会社,RNA 提取试剂盒购自北京全式金生物科技有限公司,逆转录试剂和SYBR Green PCR Master Mix 检测试剂盒由北京索莱宝公司提供,DH-5α 大肠杆菌和T4 连接酶购自北京擎科生物科技有限公司;Lipofectamine®2000 转染试剂和pcDNA3.1 载体购自美国Invitrogen 公司,CCK-8 检测试剂盒购自美国Med Chem Express 公司,ELISA 试剂盒购自美国Abcam 公司。
1.2 载体构建
根据NCBI 基因数据库中提供的人lncRNA THRIL(NR_110375.1)的序列,设计引物及酶切位点(结合pcDNA3.1 载体上的酶切位点),选择限制性内切酶XHoⅠ和HindⅢ。提取人BEAS-2B 全基因组DNA,通过聚合酶链反应(polymerase chain reaction,PCR)扩增lncRNA THRIL,全长1 978 bp。PCR 引物序列正向:5'-ACAACCCTAATATCCCCACTCG-3',反向:5'-CGCCCAGGTGTCAATGGTCGTG-3',均22 bp。随后PCR 产物和pcDNA3.1 载体使用限制性内切酶XHoⅠ和HindⅢ酶切,利用T4 链接酶4℃过夜。连接后产物使用热激法转大肠杆菌DH-5α,接种于含有氨苄青霉素的LB 平板中,置于37℃培养箱中过夜,次日挑取5 个菌落测序验证。挑选测序正确的菌落扩增培养,摇菌过夜,提取重组质粒用于后续的研究。THRIL 敲降载体的构建同上。
1.3 细胞培养及处理
将BEAS-2B 细胞接种在含有10%胎牛血清、100 u/mL 青霉素和100 μg/mL 链霉素的DMEM 培养基中,置于37℃、5%二氧化碳培养箱中,细胞融合度>90%时用胰蛋白酶消化、传代。培养细胞至稳定传代,分组并进行以下处理:对照组细胞使用DMSO 溶剂处理;LPS 组使用1 μg/mL LPS 刺激细胞24 h;姜黄素组使用5 μmol/L 的姜黄素处理24 h;先使用2.5 μmol/L、5 μmol/L 和7.5 μmol/L 的姜黄素处理2 h,再使用1 μg/mL 的LPS 处理细胞22 h,并分别作为LPS+姜黄素2.5 μmol/L 组、LPS+姜黄素5 μmol/L 组、LPS+姜黄素7.5 μmol/L 组。lncRNA THRIL 过表达载体、敲降载体及空载体( 阴性对照)均使用Lipofectamine®2000 转染进入细胞,分为过表达阴性对照组、过表达THRIL 组、敲降阴性对照组、敲降THRIL 组。在转染24 h 后按照上述LPS 和姜黄素的处理条件进一步处理,分为LPS+姜黄素组、LPS+姜黄素+过表达阴性对照组、LPS+姜黄素+过表达THRIL组、LPS+敲降阴性对照组、LPS+敲降THRIL 组。
1.4 实时荧光定量聚合酶链反应检测lncRNA THRIL及炎症因子表达
实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction,qRT-PCR)检测lncRNA THRIL、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(Interleukin-1β,IL-1β)、白细胞介素6(Interleukin-6,IL-6)表达。收集各组细胞,用TRIzol 提取总RNA,随后测定RNA的浓度,参照逆转录试剂盒说明书将2 μg 总RNA 合成cDNA,使用SYBR Green PCR Master Mix 检测试剂盒在ABI 7500 仪器上进行qRT-PCR。实验所得数据 用2-ΔΔCt法分析,以GAPDH为内参计算各基因mRNA 相对表达量。所有引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。

表1 qRT-PCR引物序列
1.5 流式细胞术检测细胞凋亡
各组细胞在6 孔板中采用胰蛋白酶消化、收集,PBS 洗涤,添加300 μL 缓冲液重悬细胞,在细胞悬液中分别加入15 μL Annexin V-FITC 和5 μL PI,避光反应15 min,加入200 μL 的缓冲液,上机,利用Flow Jo 软件分析细胞凋亡情况。
1.6 CCK-8检测细胞活性
将对数生长期细胞消化并制备细胞悬液,在96孔板中接种细胞悬液(100 μL/孔),将培养板放在培养箱中预培养24 h,按照1.4 的方法处理细胞后再培养24 h,向每孔加入10 μL CCK-8 溶液,将培养板置于培养箱内孵育4 h,用酶联免疫检测仪(美国赛默飞世尔科技公司)测定450 nm 处的吸光度。
1.7 酶联免疫吸附试验检测炎症因子水平
取各组处理后的细胞培养基上清,4 200 r/min 离心10 min,离心直径20 cm,收集上清液。按照酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒说明书要求操作,将50 μL 上清液加入板孔中,再加入50 μL 抗体溶液,密封并在振荡器上室温孵育1 h。然后清洗每个孔并加入100 μL TMB显影液,暗室孵育10 min 后每孔加入100 μL 终止液,在振荡器上摇匀,测定450 nm 处的吸光度值。
1.8 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 姜黄素对LPS 诱导的BEAS-2B 细胞中lncRNA THRIL表达的影响
对照组lncRNA THRIL mRNA 相对表达量为(1.05±0.16),LPS 组为(2.97±0.21),姜黄素组为(1.11±0.13),LPS+姜黄素2.5 μmol/L 组为(2.46±0.25),LPS+姜黄素5 μmol/L 组为(1.58±0.33),LPS+姜黄素7.5 μmol/L 组为(1.28±0.24),经方差分析,差异有统计学意义(F=36.870,P=0.000)。姜黄素组与对照组比较,差异无统计学意义(P>0.05),LPS 组较对照组升高(P<0.05),LPS+姜黄素2.5 μmol/L 组、LPS+姜黄素5 μmol/L 组、LPS+姜黄素7.5 μmol/L 组较LPS 组降低(P<0.05),并呈剂量依赖性降低。
2.2 不同浓度姜黄素处理对LPS 诱导的BEAS-2B 细胞损伤的影响
对照组细胞凋亡率为(4.43±1.76)%,LPS 组为(34.87±1.55)%,姜黄素组为(9.90±2.76)%,LPS+姜黄素2.5 μmol/L 组为(32.90±2.75)%,LPS+姜黄素5 μmol/L组为(26.83±3.25)%,LPS+姜黄素7.5 μmol/L组为(23.50±3.32)%,经方差分析,差异有统计学意义(F=65.160,P=0.000)。姜黄素组与对照组比较,差异无统计学意义(P>0.05),LPS 组较对照组升高(P<0.05),LPS+姜黄素2.5 μmol/L 组、LPS+姜黄素5 μmol/L 组、LPS+姜黄素7.5 μmol/L 组较LPS 组降低(P<0.05),并呈剂量依赖性降低。见图1。

图1 流式细胞术检测细胞凋亡
各组IL-1β、IL-6 和TNF-α mRNA 相对表达量比较,差异有统计学意义(P<0.05)。姜黄素组与对照组比较,差异无统计学意义(P>0.05),LPS 组较对照组升高(P<0.05),LPS+姜黄素2.5 μmol/L 组、LPS+姜黄素5 μmol/L 组、LPS+姜黄素7.5 μmol/L 组较LPS组降低(P<0.05),并呈剂量依赖性降低。见表1。
表1 各组IL-1β、IL-6和TNF-α相对表达量比较 (±s)
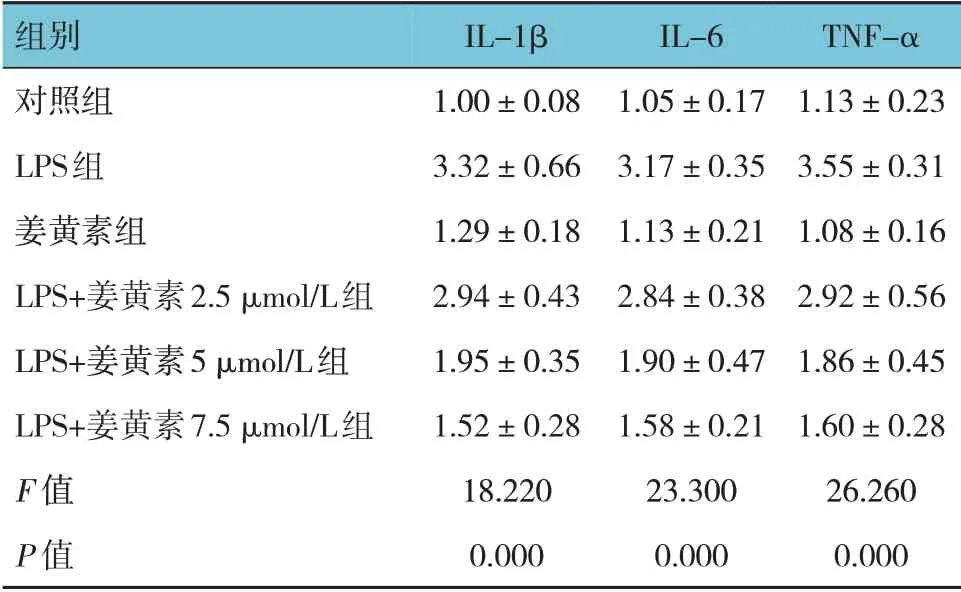
表1 各组IL-1β、IL-6和TNF-α相对表达量比较 (±s)
组别对照组LPS组姜黄素组LPS+姜黄素2.5 μmol/L组LPS+姜黄素5 μmol/L组LPS+姜黄素7.5 μmol/L组F 值P 值IL-1β 1.00±0.08 3.32±0.66 1.29±0.18 2.94±0.43 1.95±0.35 1.52±0.28 18.220 0.000 IL-6 1.05±0.17 3.17±0.35 1.13±0.21 2.84±0.38 1.90±0.47 1.58±0.21 23.300 0.000 TNF-α 1.13±0.23 3.55±0.31 1.08±0.16 2.92±0.56 1.86±0.45 1.60±0.28 26.260 0.000
对照组细胞活性为(100.00±3.08)%,LPS 组为(67.33±3.58)%,姜黄素组为(96.38±2.07)%,LPS+姜黄素2.5 μmol/L 组为(73.49±4.49)%,LPS+姜黄素5 μmol/L组为(79.16±4.55)%,LPS+姜黄素7.5 μmol/L组为(85.92±5.10)%,经方差分析,差异有统计学意义(F=31.750,P=0.000)。姜黄素组与对照组比较,差异无统计学意义(P>0.05),LPS 组较对照组降低(P<0.05),LPS +姜黄素2.5 μmol/L 组、LPS +姜黄素5 μmol/L 组、LPS +姜黄素7.5 μmol/L 组较LPS 组升高(P<0.05),并呈剂量依赖性升高。
各组IL-1β、IL-6 和TNF-α 质量浓度比较,差异有统计学意义(P<0.05)。姜黄素组与对照组比较,差异无统计学意义(P>0.05),LPS 组较对照组升高(P<0.05),LPS+姜黄素2.5 μmol/L 组、LPS+姜黄素5 μmol/L 组、LPS+姜黄素7.5 μmol/L 组较LPS 组降低(P<0.05),并呈剂量依赖性降低。见表2。
表2 各组IL-1β、IL-6和TNF-α质量浓度比较 (pg/mL,±s)

表2 各组IL-1β、IL-6和TNF-α质量浓度比较 (pg/mL,±s)
IL-1β 169.06±30.32 706.89±54.74 177.74±35.47 639.27±54.98 IL-6 52.34±10.34 208.46±26.48 64.31±12.27 188.78±16.58组别对照组LPS组姜黄素组LPS+姜黄素2.5 μmol/L组LPS+姜黄素5 μmol/L组LPS+姜黄素7.5 μmol/L组F 值P 值TNF-α 76.03±6.32 428.96±36.64 83.37±12.78 397.96±29.22 438.49±49.37 139.43±12.74 271.08±28.98 319.59±36.97 96.65±17.58 162.33±29.76 78.490 0.000 43.350 0.000 103.300 0.000
2.3 敲降THRIL 对LPS 诱导的BEAS-2B 细胞损伤的影响
敲降阴性对照组lncRNA THRIL mRNA 的相对表达量为(1.00±0.06),敲降THRIL 组为(0.31±0.09),经t检验,差异有统计学意义(t=11.680,P=0.000),敲降THRIL 组较敲降阴性对照组降低(P<0.05)。
流式细胞术结果显示,对照组细胞凋亡率为(4.47±1.13)%,LPS 组为(34.73±2.31)%,LPS+敲降阴性对照组为(33.13±4.35)%,LPS +敲降THRIL 组为(25.17±1.03)%,经方差分析,差异有统计学意义(F=87.380,P=0.000),LPS +敲降阴性对照组与LPS组比较,差异无统计学意义(P>0.05),LPS 组较对照组升高(P<0.05),LPS +敲降THRIL 组较LPS+敲降阴性对照组降低(P<0.05)。见图2。
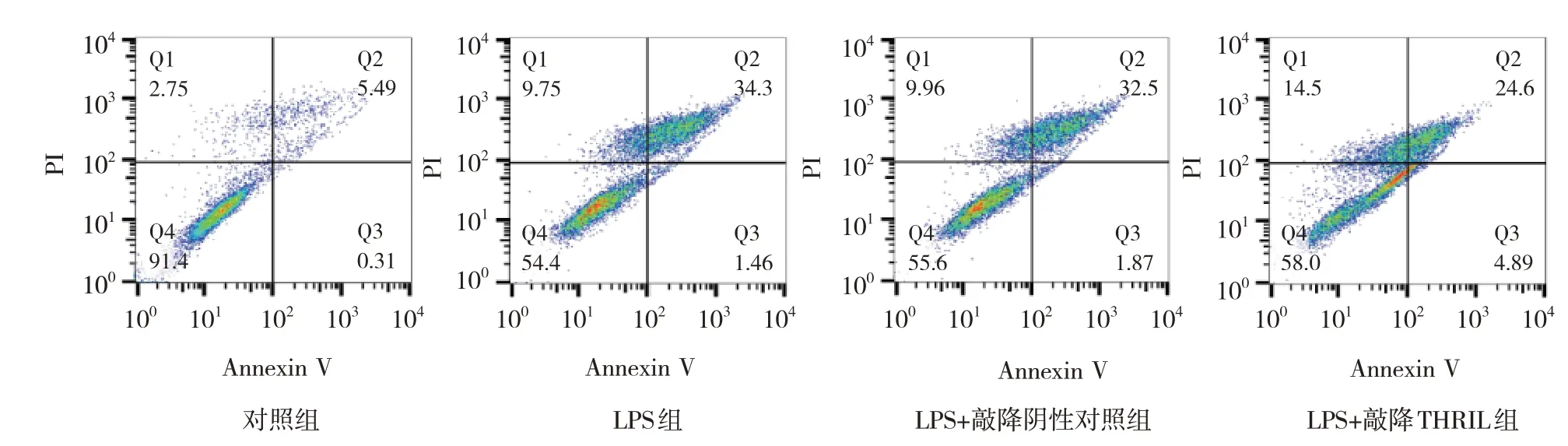
图2 流式细胞术检测细胞凋亡
各组IL-1β、IL-6 和TNF-α mRNA 相对表达量比较,差异有统计学意义(P<0.05),LPS +敲降阴性对照组与LPS 组比较,差异无统计学意义(P>0.05),LPS 组较对照组升高(P<0.05),LPS+敲降THRIL 组较LPS+敲降阴性对照组降低(P<0.05)。见表3。
表3 各组IL-1β、IL-6和TNF-α mRNA相对表达量比较(±s)
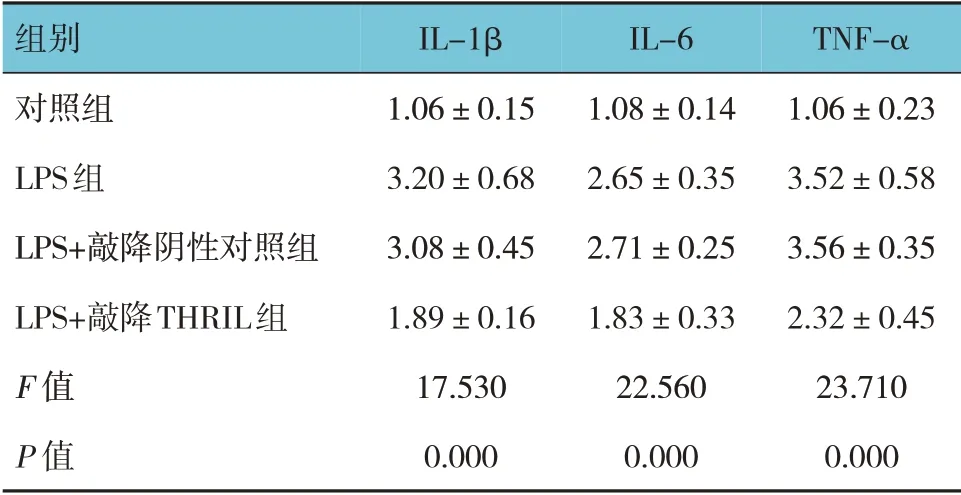
表3 各组IL-1β、IL-6和TNF-α mRNA相对表达量比较(±s)
组别对照组LPS组LPS+敲降阴性对照组LPS+敲降THRIL组F 值P 值IL-1β 1.06±0.15 3.20±0.68 3.08±0.45 1.89±0.16 17.530 0.000 IL-6 1.08±0.14 2.65±0.35 2.71±0.25 1.83±0.33 22.560 0.000 TNF-α 1.06±0.23 3.52±0.58 3.56±0.35 2.32±0.45 23.710 0.000
CCK-8 结果显示,对照组细胞活性为(100.00±2.94)%,LPS 组为(67.86±4.55)%,LPS+敲降阴性对照组为(66.70±3.84)%,LPS +敲降THRIL 组为(81.90±5.55)%,经方差分析,差异有统计学意义(F=38.700,P=0.000),LPS+敲降阴性对照组与LPS组比较,差异无统计学意义(P>0.05),LPS 组较对照组降低(P<0.05),LPS+敲降THRIL 组较LPS+敲降阴性对照组升高(P<0.05)。
各组IL-1β、IL-6 和TNF-α 的质量浓度比较,差异有统计学意义(P<0.05),LPS+敲降阴性对照组与LPS 组比较,差异无统计学意义(P>0.05),LPS 组较对照组升高(P<0.05),LPS+敲降THRIL 组较LPS+敲降阴性对照组降低(P<0.05)。见表4。
表4 各组IL-1β、IL-6和TNF-α的质量浓度比较 (pg/mL,±s)

表4 各组IL-1β、IL-6和TNF-α的质量浓度比较 (pg/mL,±s)
组别对照组LPS组LPS+敲降阴性对照组LPS+敲降THRIL组F 值P 值IL-1β 172.00±24.30 698.83±52.70 709.78±65.97 382.93±64.21 69.070 0.000 IL-6 54.41±13.56 208.00±19.54 214.88±27.22 135.43±21.92 37.780 0.000 TNF-α 75.25±11.82 411.98±36.69 420.74±45.51 217.03±35.38 71.800 0.000
2.4 过表达THRIL 对LPS 诱导的BEAS-2B 细胞损伤的影响
过表达阴性对照组lncRNA THRIL mRNA 相对表达量为(1.02±0.12),过表达THRIL 组为(3.23±0.33),经t检验,差异有统计学意义(t=11.000,P=0.000),过表达THRIL 组较过表达阴性对照组升高(P<0.05)。
CCK-8 结果显示,对照组细胞活性为(100.00±3.29)%,LPS 组为(66.37±3.51)%,LPS+姜黄素组为(80.56±4.62)%,LPS+姜黄素+过表达阴性对照组为(81.21±2.93)%,LPS+姜黄素+过表达THRIL 组为(67.98±4.63)%,经方差分析,差异有统计学意义(F=36.710,P=0.000),LPS+姜黄素+过表达阴性对照组与LPS+姜黄素组比较,差异无统计学意义(P>0.05),LPS 组较对照组降低(P<0.05),LPS+姜黄素组较LPS 组升高(P<0.05),LPS+姜黄素+过表达THRIL 组较LPS+姜黄素+过表达阴性对照组细胞活性降低(P<0.05)。
流式细胞术结果显示,对照组细胞凋亡率为(3.87±0.92)%,LPS 组为(34.43±4.27)%,LPS+姜黄素组为(21.43±3.73)%,LPS+姜黄素+过表达阴性对照组为(21.37±2.44)%,LPS+姜黄素+过表达THRIL组为(32.83±2.97)%,经方差分析,差异有统计学意义(F=46.950,P=0.000),LPS+姜黄素+过表达阴性对照组与LPS+姜黄素组比较,差异无统计学意义(P>0.05),LPS 组较对照组升高(P<0.05),LPS+姜黄素组较LPS 组降低(P<0.05),LPS+姜黄素+过表达THRIL 组较LPS+姜黄素+过表达阴性对照组升高(P<0.05)。见图3。
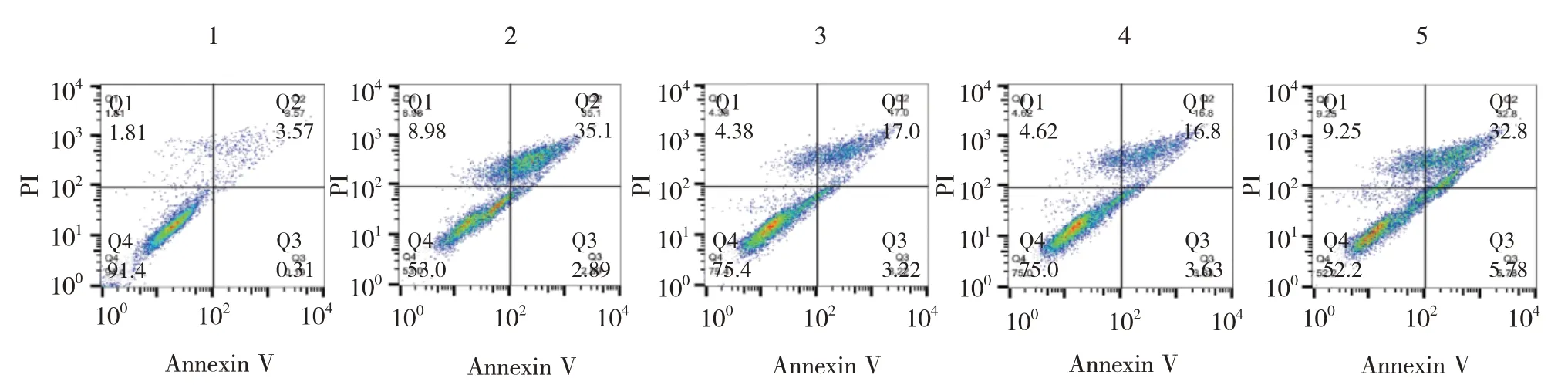
图3 流式细胞术检测细胞凋亡
各组IL-1β、IL-6 和TNF-α mRNA 相对表达量比较,差异有统计学意义(P<0.05),LPS +姜黄素+过表达阴性对照组与LPS+姜黄素组比较,差异无统计学意义(P>0.05),LPS 组较对照组升高(P<0.05),LPS+姜黄素组较LPS 组降低(P<0.05),LPS+姜黄素+过表达THRIL 组较LPS +姜黄素+过表达阴性对照组升高(P<0.05)。见表5。
表5 各组IL-1β、IL-6和TNF-α mRNA相对表达量比较(±s)
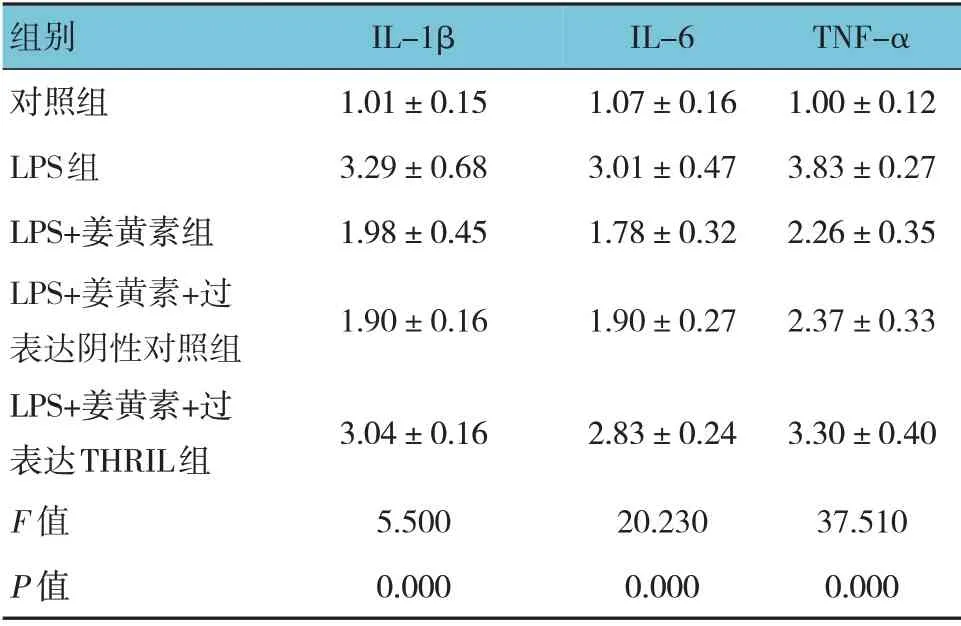
表5 各组IL-1β、IL-6和TNF-α mRNA相对表达量比较(±s)
组别对照组LPS组LPS+姜黄素组LPS+姜黄素+过表达阴性对照组LPS+姜黄素+过表达THRIL组F 值P 值IL-1β 1.01±0.15 3.29±0.68 1.98±0.45 1.90±0.16 IL-6 1.07±0.16 3.01±0.47 1.78±0.32 1.90±0.27 TNF-α 1.00±0.12 3.83±0.27 2.26±0.35 2.37±0.33 3.04±0.16 5.500 0.000 2.83±0.24 20.230 0.000 3.30±0.40 37.510 0.000
各组IL-1β、IL-6 和TNF-α 的质量浓度比较,差异有统计学意义(P<0.05),LPS+姜黄素+过表达阴性对照组与LPS +姜黄素组比较,差异无统计学意义(P>0.05),LPS 组较对照组升高(P<0.05),LPS +姜黄素组较LPS 组降低(P<0.05),LPS+姜黄素+过表达THRIL 组较LPS+姜黄素+过表达阴性对照组升高(P<0.05)。见表6。
表6 各组IL-1β、IL-6和TNF-α的质量浓度比较 (pg/mL,±s)
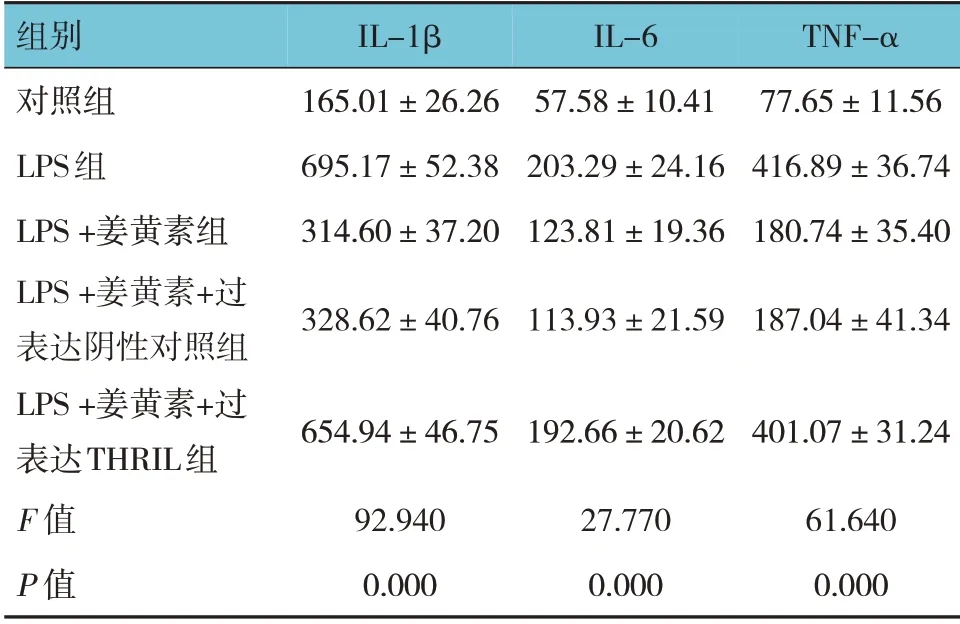
表6 各组IL-1β、IL-6和TNF-α的质量浓度比较 (pg/mL,±s)
组别对照组LPS组LPS+姜黄素组LPS+姜黄素+过表达阴性对照组LPS+姜黄素+过表达THRIL组F 值P 值IL-1β 165.01±26.26 695.17±52.38 314.60±37.20 328.62±4 0.76 IL-6 57.58±10.41 203.29±24.16 123.81±19.36 113.93±21.59 TNF-α 77.65±11.56 416.89±36.74 180.74±35.40 187.04±41.34 654.94±46.75 92.940 0.000 192.66±20.62 27.770 0.000 401.07±31.24 61.640 0.000
3 讨论
ALI 和急性呼吸窘迫综合征是由多种肺损伤引起的肺部变化的连续体,常导致严重的发病率和死亡率[9]。研究表明LPS 能够显著刺激促炎因子的表达,引起系统和全身性炎症反应综合征等炎症反应[10]。本研究利用LPS 诱导了BEAS-2B 细胞损伤并给予姜黄素干预,结果表明,姜黄素能通过抑制lncRNA THRIL 的表达,抑制LPS 诱导细胞凋亡和炎症损伤。
姜黄素是一种天然多酚化合物,原产于姜科植物姜黄根茎中,具有多种生物和药物性质[11]。LIANG 等[12]研究发现姜黄素能够通过降低miR-21的表达,减轻急性肺栓塞小鼠中的肺损伤和炎症反应。并且姜黄素下调ALI 大鼠肺部炎症细胞因子TNF-α、IL-8 和巨噬细胞抑制因子水平,使其存活率提高40%~50%,表明姜黄素对ALI 具有保护作用[13]。本研究结果显示,姜黄素呈剂量依赖性抑制LPS 诱导的炎症因子表达和细胞凋亡,这与前述结果一致,表明姜黄素对LPS 引起的肺细胞损伤有保护作用。先前研究也表明姜黄素在较低浓度时不会产生细胞毒性,而20 μmoL/L 浓度的姜黄素则会显著降低细胞活性[14]。本研究也证实这一点,5 μmoL/L 浓度的姜黄素对细胞活性无显著影响,同时笔者均选用<10 μmol/L 浓度的姜黄素处理细胞,以规避高浓度姜黄素的细胞毒性带来的影响。
最近研究已经揭示了lncRNA 在ALI 中发挥了重要作用,例如lncRNA CASC2 通过调节miR-152-3p/PDK4 通路改善LPS 诱导的人肺上皮细胞损伤[15];敲降lncRNA NEAT1 降低了LPS 诱导的炎症细胞因子的表达,减轻了LPS 诱导的ALI[16]。本研究结果与上述研究一致,lncRNA THRIL 在LPS 诱导的肺细胞中表达显著升高,对其敲降显著抑制了LPS 诱导的细胞凋亡以及炎症因子TNF-α、IL-6 和IL-1β 的表达。
综上所述,本研究显示姜黄素可以抑制LPS 诱导的BEAS-2B 细胞中lncRNA THRIL 的表达,缓解LPS 诱导的细胞凋亡和炎症损伤,表明姜黄素在ALI的治疗中具有重要作用,同时lncRNA THRIL 可能是诊断和治疗ALI 的重要靶点。但姜黄素在LPS 诱导的ALI 中还可能存在其他的调控机制或通路,其中更多、更详细的分子机制还有待进一步深入研究。
