基于共价/非共价结合的蛋白质与花色苷相互作用研究进展
2022-11-02袁婷婷周子艺赵吉春李富华曾凯芳明建
袁婷婷,周子艺,赵吉春,李富华,曾凯芳,2,明建,2*
1(西南大学 食品科学学院,重庆,400715)2(西南大学,食品贮藏与物流研究中心,重庆,400715)
花色苷是一类分布广泛的植物色素,能使花、果实、茎、叶和根等器官呈现红、紫红、蓝等不同颜色。花色苷具有多种生物活性功能,如抗炎和抗癌性、降低心血管疾病的发生率,控制肥胖和减轻糖尿病的作用,因此可将其添加到食品中赋予食品功能特性[1]。由于花色苷苯环上含有多个羟基,其化学性质并不稳定,容易受到温度、光、pH、氧、抗坏血酸、酶、金属离子和其他因素的影响,从而出现褪色、变色、沉淀等现象。这些影响会在很大程度上限制花色苷作为食品成分和添加剂的用途,因此提高花色苷的稳定性尤为重要。目前提高花色苷稳定性的技术有很多,如修饰改性、辅色作用、微胶囊化、纳米复合递送等[2]。此外,还可以添加蛋白质、酚类化合物和多糖来提高花色苷的稳定性,其中,花色苷与蛋白质的相互作用是提高花色苷稳定性的有效方法之一[3]。本文主要介绍了花色苷与蛋白质相互作用形式、影响因素以及相互作用对花色苷和蛋白质的影响,以期为开发富含花青素的蛋白质食品或功能性配料提供理论依据。
1 花色苷与蛋白质的结构和性质
花色苷属于类黄酮化合物,具有典型的C6-C3-C6骨架结构,其基本结构为3,5,7-三烃基-2-苯基苯并吡喃[4]。由于花青素母核2-苯基苯并吡喃阳离子缺乏电子,游离的花青素极不稳定,在自然界中常与糖基结合以花色苷形式存在。B环上的R1和R2可以被不同的取代基(—OH,—OCH3)取代,根据取代基连接位置的差异,可将花青素分为六类,即天竺葵色素、飞燕草色素、矢车菊色素、芍药色素、牵牛色素和锦葵色素(表1)。糖基主要结合在花青素的C-3、C-5、C-7位,少部分与C-3′位连接,最常见的糖是葡萄糖、半乳糖、鼠李糖、阿拉伯糖。花色苷之间的差异在于羟基和甲氧基的数量和位置,糖基性质、数量、位置以及糖残基上脂肪酸或芳香酸进行酯化的程度和性质[5]。

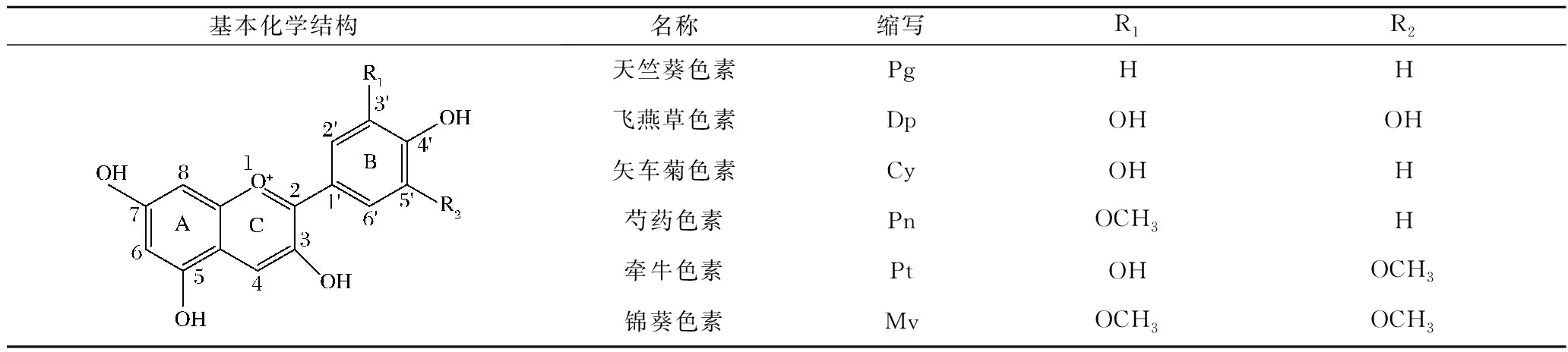
表1 常见花青素的基本结构[5]Table 1 The basic structure of common anthocyanins[5]
2 花色苷与蛋白质相互作用形式
花色苷与蛋白质之间可以通过相互作用形成更稳定的复合物体系,主要有非共价结合和共价结合2种结合方式。
2.1 非共价结合

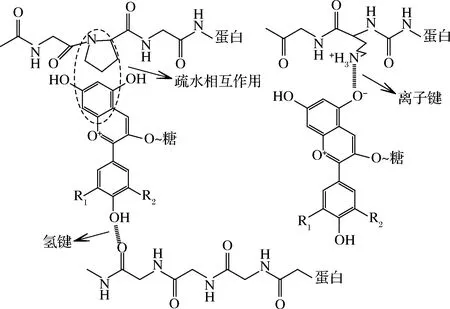
图1 花色苷与蛋白质非共价相互作用机制图Fig.1 Diagram of the non-covalent interaction mechanism between anthocyanin and protein
2.2 共价结合
蛋白质与多酚的共价结合一般是不可逆的,可以通过酶法和非酶法(碱性反应和自由基接枝)形成,其机制如图2、图3所示[11]。酶法主要依赖于多酚氧化酶、漆酶、酪氨酸酶等酶的催化作用,在含氧环境下,处于邻位的酚羟基基团可以被氧化生成O-醌,从而根据亲核加成反应机制与蛋白质结合,形成花色苷-蛋白质共价复合物。基于该形成原理,TANTOUSH等[12]利用漆酶成功使樱桃中酚类物质与β-乳球蛋白发生交联作用,以此提高蛋白质的消化稳定性并降低其致敏性。酶法通常被认为是一种具有高度特异性的有效方法,酶促合成复合物表现出很强的自由基清除活性。然而,其所使用的制备和程序复杂且成本高[11]。非酶法主要分为碱性反应和自由基接枝反应。在碱性条件下,花色苷被氧化后与蛋白质侧链通过共价相互作用形成醌类化合物,这是一种反应性的亲电中间体。活性醌通过酚环与蛋白质侧链上的巯基和氨基发生亲电加成反应,从而形成不可逆的共价键(C—N或C—S)。研究发现,在强碱环境下,C3G更有可能与大豆分离蛋白(soybean protein isolate,SPI)发生共价结合,随着C3G浓度的增加,SPI中巯基含量逐渐降低,C3G与SPI相互作用形成C—N共价键,从而改变了大豆蛋白的结构[13]。而自由基接枝反应是通过氧化还原生成的羟基自由基与蛋白质侧链的活性基团发生反应,促进花色苷与蛋白质之间共价键的形成。研究证明由自由基接枝形成的复合物比碱性反应形成的复合物表现出更高的抗氧化活性。此外,该反应可以在室温下进行,不会产生有毒产物或使抗氧化剂分解,是制备花色苷-蛋白质复合物的有效方法[11]。

图2 通过碱性反应(a)和酶法(b)的蛋白质-多酚共价结合机制[11]Fig.2 Protein-polyphenol covalent binding mechanism through alkaline reaction (a) and enzymatic method (b)[11]

图3 通过自由基接枝法的蛋白质-多酚共价结合机制Fig.3 Mechanism of protein-polyphenol covalent binding via free radical grafting
3 影响花色苷-蛋白质相互作用的主要因素
花色苷与蛋白质相互作用的影响因素较多,主要分为结构因素和环境因素,了解这些因素对相互作用不同程度的影响,有助于扩大花色苷-蛋白质复合物在各领域中的应用。
3.1 花色苷结构
花色苷的结构在其与蛋白质的络合中有重要作用,花色苷B环中的羟基取代基会影响与蛋白质的结合,研究显示在酸性条件下,疏水相互作用为主要作用力,B环中羟基数量较少的花色苷与蛋白质的结合作用较强,而在中性或弱碱性条件下,二者的相互作用力主要为氢键和静电力,蛋白质倾向于与B环中羟基数量较多的花色苷结合[14]。分子对接结果表明,B环中的甲氧基化促进了与电子受体氨基酸的相互作用,从而使溶液呈现出不同程度的颜色变化[15]。研究发现非酰基化形式的花色苷与人血清白蛋白的结合力强于糖基化形式的花色苷,且在糖基化条件相同的情况下,羟基化和甲氧基化对结合力无很强的规律性影响[16]。
3.2 蛋白质结构
蛋白质的结构差异是影响花色苷与蛋白质相互作用的重要因素,未折叠的蛋白质相比于球形蛋白质表现出更强的亲和力。脯氨酸含量被认为是蛋白质-多酚相互作用的重要因素,富含脯氨酸的蛋白质通常有较好的分子柔性,其与多酚的相互作用也更强[17]。花色苷的芳香环倾向于与极性较低的氨基酸残基结合,同时其羟基与蛋白质多肽链的羰基和氨基之间也可能发生氢键结合。研究表明黑米花色苷与β-乳球蛋白主要通过疏水相互作用结合,与酪蛋白结合的主要作用力为氢键,与牛血清白蛋白相互作用力主要为氢键和疏水相互作用,分子对接模拟结果显示C3G主要结合于牛血清白蛋白的结构域Ⅲ上。黑米花色苷与酪蛋白的相互作用对花色苷的稳定性具有一定的保护作用,而其他2种蛋白质对花色苷的保护作用不明显[18]。
3.3 温度
温度使蛋白质结构发生不同程度的变化,从而影响二者的结合亲和力。在酸性条件下,疏水相互作用为主要作用力,且这种相互作用强度随着温度的升高而增强。在中性及弱碱性条件下,极性基团之间的静电相互作用占主导地位,二者亲和力随着温度的升高而降低[14]。在适宜的温度条件下能够提高花色苷-蛋白质复合物的稳定性,研究发现SPI的适当热处理能防止黑豆种皮花色苷提取物的损失,提高花色苷的热稳定性和氧化稳定性,有助于维持大豆制品的营养[19]。温度在一定程度上改变了牛奶蛋白与C3G的结合亲和力和结构构象。随着预热温度的升高,β-乳球蛋白和β-酪蛋白的二级结构都发生了改变,β-螺旋和β-折叠结构含量降低,无规卷曲结构含量增加[8]。
3.4 pH
pH可通过改变花色苷的结构影响蛋白质与花色苷的相互作用形式。在酸性环境中,花色苷主要以黄酮型结构为主,在中性和碱性环境下,主要以阴离子醌型的形式存在,离子间的相互作用为主要作用力。此外,pH也可通过影响蛋白质的性质从而影响二者的相互作用。有研究发现人血清白蛋白在等电点(pI为4.7~4.9)以下为正电状态,而在高pH时为负电状态[14]。当pH值为3时,花青素与酪蛋白之间的相互作用力是由氢键驱动的,而在pH值为7的条件下是通过疏水作用结合的[20]。在中性条件下卵清蛋白与C3G的结合亲和力高于酸性条件,C3G分子在加热过程中发生降解,在酸性条件下其复合物更稳定,这主要归因于C3G在低pH环境中形成较稳定的黄烊盐阳离子[21]。
3.5 其他因素
溶液离子强度、加工技术条件也会影响花色苷与蛋白质的相互作用。如牛血清白蛋白与花色苷的结合常数随着温度的升高而减小,且减小的程度与缓冲溶液的离子强度呈负相关,其复合物的稳定性在蒸馏水中受到的影响比在缓冲液中受到的影响大[22]。研究表明,在过渡金属离子存在的条件下,多酚氧化酶的活性会提高,而Zn2+能降低多酚氧化酶的活性,从而保护紫甘薯花色苷免受酶促降解[23]。花色苷与蛋白质的相互作用还受加工技术的影响。研究发现,经热处理后二者的相互作用增强,而高压处理后,二者的相互作用减弱,经热处理和脉冲电场处理后可溶性蛋白会减少,导致复合物在体外消化过程中的可及性降低[24]。蓝莓花色苷在光、热、抗坏血酸、蔗糖存在下会加速降解,而酪蛋白的存在会提高这4种条件下花色苷的稳定性,但热处理不如光处理效果明显,可能是酪蛋白在高温下发生了变性,空间结构改变,不利于与花色苷结合[7]。
4 蛋白质-花色苷相互作用对花色苷性质的影响
花色苷由于酚羟基的存在使其具有一定的抗氧化活性,但其极不稳定的性质也影响了作为食品成分的用途。因此,花色苷与蛋白质相互作用后可以在一定程度上改善其稳定性、抗氧化活性、生物利用度等。
4.1 稳定性
通常情况下,花色苷的稳定性与羟基化程度呈正相关,而与甲氧基化程度呈负相关。在酸性环境中性质较稳定,而在中性或弱碱性环境中易降解[25]。与蛋白质大分子相互作用后可以延缓花色苷的氧化过程,从而使花色苷的稳定性得到改善。研究发现在不同pH条件下,美拉德反应生成的共聚物糖化乳清蛋白有效提高了C3G的热稳定性[26]。热处理后的乳清蛋白显著提高了花色苷在贮藏过程中的稳定性,花色苷通过氢键与乳清蛋白形成复合物,从而减缓其在抗坏血酸存在下的降解速率[27]。QUAN等[28]研究发现乳清蛋白和大豆蛋白可提高紫甘薯花色苷的热稳定性,但对其贮存稳定性影响不大。研究表明α-酪蛋白和β-酪蛋白均能显著提高蓝莓花色苷的稳定性,当酪蛋白质量浓度为0.1 mg/mL时效果最好,且β-酪蛋白提高蓝莓花色苷稳定性的效果更明显[7]。
4.2 抗氧化活性
花色苷具有一定的抗氧化活性,但外界环境因素的干扰极易影响其抗氧化能力,与蛋白质结合后能改善这一现象。研究发现与α-酪蛋白或β-酪蛋白结合后,花色苷都表现出较少的抗氧化活性损失,并且β-酪蛋白比α-酪蛋白的效果稍好[7]。在恶劣环境(如光照、高温、蔗糖)下,牛血清白蛋白能延缓蓝莓花色苷的降解,并在0.15 mg/mL的理想质量浓度下保持其抗氧化活性[29]。在高温条件下,花色苷与甘露糖蛋白结合后有助于保护其抗氧化活性[30]。也有研究显示,花色苷的羟基与酪蛋白通过氢键结合,使花色苷的抗氧化功能无法正常发挥,从而避免了其抗氧化基团在食品加工贮藏过程中受到破坏[31],该结论在研究人血清蛋白与花青素的相互作用中也得到体现[25]。由此可见,蛋白质可扩大花色苷作为天然色素或功能性成分的应用。
4.3 生物利用度
花色苷的生物利用度很低,在体内的生物利用度约为0.02%~0.26%,在体外约为5.10%。人体对蛋白质的吸收能力较强,花色苷与蛋白质结合后能够提高花色苷的保留率,从而促进人体对花色苷的利用[32]。研究者将樱桃果皮花色苷提取物包埋于WPI中,体外消化结果表明乳清蛋白保护了花色苷不被胃消化,促进了其在肠道中的释放,提高了花色苷的生物利用度[33]。研究显示WPI可以保护其蛋白质腔内的花色苷,从而导致花色苷在模拟胃肠道中缓慢的降解,促进胃肠道对花色苷的利用[9]。这些研究结果都为提高乳体系中花色苷的利用度提供了重要的理论基础。
5 蛋白质-花色苷相互作用对蛋白质功能特 性的影响
蛋白质的功能特性主要有乳化性、起泡性、表面疏水性、消化性、热稳定性等,作为食品成分常常影响食品的风味和质量,蛋白质和花色苷的相互作用会改变蛋白质的结构,从而影响蛋白质的功能性质。
5.1 乳化性
乳化活性(emulsification activity index,EAI)和乳液稳定性(end system identifier,ESI)是反映蛋白质与其他成分形成油水界面乳液层能力以及乳液稳定性的重要指标[34]。EAI反映蛋白质通过快速吸附在新形成的液滴表面并降低其在油水界面的界面张力来形成和稳定乳液的能力,ESI可以描述为乳液抵抗分离和保持分散的强度。研究发现,随着花色苷浓度的增加,SPI的EAI和ESI均呈现上升趋势,且这种现象与二者的相互作用类型无关[13]。研究表明,花色苷可通过非共价相互作用与乳清蛋白结合,改变蛋白质结构和表面特征,抑制油滴聚集,增强乳液稳定性。同时,花色苷在WPI乳液中氧化形成醌,与蛋白质分子侧链上的亲核基团发生共价相互作用,从而改变构象和表面特性,再次提高蛋白质乳化性以稳定乳液[35]。这些都为提高食品乳液稳定性提供了一定的参考价值。
5.2 消化性
蛋白质与花色苷的相互作用对蛋白质的消化性也会产生一定的影响。花色苷可以提高SPI的消化率,因为SPI与花色苷发生共价相互作用后,其结构发生改变,易于被消化酶水解[36]。可溶性氮释放量越高,消化吸收能力越强。黑米花色苷和SPI结合后,形成的复合物体系可溶性氮释放速率更快、释放量更高,花色苷的加入提高了蛋白质的消化吸收速率[37]。然而,蛋白质的消化是一个复杂的过程,在很大程度上取决于蛋白质的种类和结构,以及与其他食物基质组分的相互作用,因此花色苷对蛋白质消化率的影响还应进行更深入的研究。
5.3 表面疏水性
表面疏水性不仅是蛋白质与极性溶剂接触时表面疏水位点的指标,也是反映蛋白质变化的指标。卵清蛋白与C3G结合后其表面疏水性显著下降,C3G的结合引入了更多的亲水基团(如羟基),这可能会增加蛋白质的表面亲水性。同时,C3G引起的结构变化可能会影响亲水基团和疏水基团的位置,从而改变蛋白质的表面疏水性[21]。研究显示,二酰化花青素使α-淀粉酶或α-葡萄糖苷酶的表面疏水性降低,其作用机制可能是二酰化花青素与表面疏水基团相互作用,破坏了α-淀粉酶和α-葡萄糖苷酶原来的疏水结构[38],这为花色苷降低血糖的研究提供了一定的理论基础。表面疏水性的变化对蛋白质的其他功能特性也会产生一定影响,如表面疏水性的变化会导致蛋白质表面亲水基团的数量发生改变,影响其与水分子的接触面积和气水界面膜的形成,进而影响蛋白质的发泡性能。同时,表面疏水性会影响蛋白质在油水界面油侧的吸附能力,从而对乳化性能也产生一定的影响[34]。
5.4 其他性质
SPI二级和三级结构的变化会影响其空间构象和表面电荷密度,从而改变其功能,如起泡性等。研究发现,通过共价和非共价相互作用和花色苷结合后,SPI的起泡性得到了明显的改善,尤其是共价结合部分,有效地提高了蛋白质膜的稳定性[13]。研究发现,蛋白质与花色苷的相互作用可以提高蛋白质的热稳定性,适当的热处理可使蛋白质产生一定程度的变性,二级结构发生改变,对花色苷表现出更高的亲和力[39]。蛋白质与花色苷的相互作用也会影响蛋白质的营养价值,TANTOUSH等[12]将以花色苷为主的天然酚类提取物与β-乳球蛋白进行交联,从而促进消化后多肽的生物利用率,保持β-乳球蛋白生物活性,同时降低乳球蛋白的致敏性并提高其在食品中的安全性。MENG等[40]研究发现C3G可通过非共价相互作用提高乳蛋白的抗氧化能力和对Fe2+的螯合能力,有助于开发食品中的生物活性物质。
6 结论与展望
花色苷是良好的天然着色剂,具有抗氧化、抗炎、抗癌等生理活性,但其性质极不稳定,限制了其在食品、化妆品、医药等领域中的应用。近年来,花色苷与蛋白质之间的相互作用成为了研究热点。二者的相互作用不仅改善了花色苷的性质,使其得到了更大程度的利用,同时也改善了蛋白质的起泡性和乳化性,提高了蛋白质的消化率,赋予其更高的营养价值。所以,应广泛研究不同来源的蛋白质和花色苷之间形成的复合物,改善食品的感官性状,以开发新型功能食品。此外,在复杂的食品基质中,多糖、蛋白质和花色苷三者相互作用的影响因素及对其功能特性的改善也应进行研究,为生产具有特定功能的复合物提供一定的理论依据,进一步提高食品的营养价值和商业价值。许多研究表明多酚与蛋白质的相互作用对多酚的生物利用度和蛋白质的消化率有一定的负面影响,但目前在花色苷与蛋白质的相互作用研究中还鲜有类似的结论,因此还需要更全面地研究相互作用对二者的影响,为改善食品的加工条件和参数提供依据,以开发更具营养价值的新型食品。随着科技的发展,用于表征大分子与小分子相互作用机制的技术也在不断更新,然而目前将这些新型技术用于分析花色苷与蛋白质相互作用的研究还十分有限。单一技术无法全面解析蛋白质的结构变化,需结合多种分析手段深入研究二者的相互作用机制,进一步扩大其应用领域。
