利用贝莱斯芽孢杆菌提高红曲米发酵生产中抗黄曲霉污染的能力
2022-11-02李昱涵付瑞燕
李昱涵,付瑞燕
(安徽农业大学 茶与食品科技学院,安徽 合肥,230036)
红曲米是以籼米等稻米为原料,经红曲霉发酵后烘干而成的棕红色至紫红色的米粒[1]。红曲中的色素是一种天然色素,安全性高、着色稳定性强,且具有防腐的功效,在中国及周边国家被广泛地应用于食品行业中,至今已有一千多年的食用历史[2]。在生产中,红曲米的污染问题不容忽视,因为这会影响红曲的产量和含量。刘春梅等[3]指出红曲米生产中由菌种本身造成的污染率约为4.31%,由接种操作引起的污染率约为1.76%。分析可能的污染源有车间空气及环境、接种操作过程带入杂菌等,因此发酵过程的每一步都要避免杂菌污染的风险。李晓楼[4]提出发酵红曲米的过程中要加强卫生管理,可加入占种曲质量0.2%的体积分数为99.5%的乙酸来减少黄曲霉毒素和其他杂菌毒素的产生。黄曲霉是自然环境中较为常见的霉菌,其孢子可扩散至空气中传播。本课题组发现,用纯种红曲霉发酵制备的红曲米被黄曲霉污染的机率较高,然而,在用市售红曲米作为曲种发酵的过程中出现污染黄曲霉的情况并不经常发生。市售红曲米的生产过程一般较为粗放,并非绝对的无菌环境,这种开放式生产可能给红曲米的发酵过程引入了某种能抑制黄曲霉的菌种。基于此种推测,课题组拟从市售红曲米中分离筛选出1株能够抑制黄曲霉孢子生长且不会影响红曲霉产色素的菌株,旨在红曲米发酵中将其作为辅助菌株以提高红曲米大规模发酵生产过程的鲁棒性,即不要求严格的无菌操作,也能保证发酵的正常进行。
1 材料与方法
1.1 实验材料
1.1.1 市售红曲米及籼米
市售红曲米产自福建省古田县程久红粬有限公司,籼米(福临门丝泉米)产自中粮米业(巢湖)有限公司。
1.1.2 仪器与设备
SW-CJ-2FD超净工作台,苏州净化设备有限公司;PHS-3C pH计,上海雷磁仪器有限公司;752紫外可见记录分光光度计,上海精密科学仪器有限公司;SPX-150B-Z生化培养箱,上海博迅医疗生物仪器股份有限公司;DHG-9101-1SA电热恒温干燥箱,上海三发科学仪器有限公司。
1.1.3 菌株
紫色红曲霉M9和贝莱斯芽孢杆菌Y5为实验室研究团队从市售红曲米上分离所得。
1.1.4 培养基
红曲霉培养基(g/L):葡萄糖60,蛋白胨20,可溶性淀粉30。
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)培养基(g/L):马铃薯200(切块后用水煮沸30 min,纱布过滤,收集滤液),葡萄糖20。
芽孢杆菌培养基(g/L):蛋白胨10,牛肉膏15,NaCl 15。
乳酸菌培养基(g/L):蛋白胨5,牛肉膏5,酵母浸粉5,葡萄糖20,乳糖20,中性红0.05,CaCO310。
酵母菌培养基(g/L):葡萄糖1,酵母浸粉2.5,醋酸钠8.2,KCl 1.8。
1.2 实验方法
1.2.1 红曲米的制备及色价的测定
称取30 g籼米,在100 mL pH为3.5的自来水中浸泡10 h,然后将水沥干,将米装入250 mL的烧杯中,用6层纱布封口,121 ℃灭菌20 min,灭菌结束后用无菌玻璃棒搅开蒸熟的米粒,待其冷却至室温后,接种经2层纱布过滤的红曲霉M9种子液2 mL,用无菌玻璃棒搅拌均匀,在32 ℃下培养,每隔24 h加1次无菌水并搅拌,前2 d加水量为2 mL,从第3天开始加水量为4 mL。红曲米发酵10 d后,将红曲米置于60 ℃的恒温干燥箱中进行烘干,之后将红曲米粉碎并过60目筛,收集红曲米粉,测定其色价。根据GB 1886.19—2015《食品安全国家标准 食品添加剂 红曲米》中的方法提取红曲米粉中的色素并进行其色价的测定。
1.2.2 市售红曲米中优势菌株的分离纯化
称取10 g以市售红曲米为曲种所制备的红曲米,将其置于带有玻璃珠的90 mL无菌生理盐水中,在180 r/min下振荡30 min,取上清液进行梯度稀释,涂布在各分离培养基平板上,32 ℃下培养2~5 d,经划线分离获得纯种。
1.2.3 污染红曲米的黄曲霉菌株的分离纯化及其鉴定
挑取红曲米发酵过程中污染杂菌的黄绿色米粒,置于PDA平板上进行培养,用划线法和稀释平板法将污染菌分离纯化。采用形态学观察与分子生物学鉴定相结合的方式,确定该菌株的微生物学地位。
1.2.4 市售红曲米中具有抗黄曲霉污染能力的菌株的筛选
1.2.4.1 菌种准备
红曲霉M9孢子液按6%的接种量接入红曲霉培养基中,32 ℃下150 r/min振荡培养5 d,经2层纱布过滤,制备浓度为1×104个/mL的孢子液备用,以下简称为M9。
将黄曲霉LQ菌株孢子液在PDA平板上划线接种,32 ℃下培养3 d后,用生理盐水冲洗平板上的孢子,制备浓度为10个/mL的孢子液备用,以下简称为LQ。
从市售红曲米中分离纯化出的17个待筛菌株以2%的接种量接入相应的培养基,在32 ℃下振荡培养18 h后,取发酵液在8 000 r/min下离心5 min,收集菌体,用生理盐水重悬后,将菌悬液稀释20倍备用。
1.2.4.2 黄曲霉LQ菌株孢子液添加量对红曲米发酵的影响
按1.2.1所述方法制备红曲米,在冷却至室温的灭菌米粒中按以下方案加入如前所述制备的红曲霉M9孢子液和黄曲霉LQ孢子液。实验组在米中加入3 mL菌液,菌液的组成为M9孢子液∶LQ孢子液∶生理盐水,其体积比依次为1∶1∶1、3∶1∶1、5∶1∶1、7∶1∶1、9∶1∶1,依次标记为A、B、C、D、E,对照组在米中所加入的3 mL菌液组成为1mL M9孢子液+2 mL生理盐水,分别将以上制备好的实验组和对照组的3 mL菌液混匀后取2 mL加入米中。
1.2.4.3 具有抗黄曲霉污染能力的菌株的筛选
在冷却至室温的灭菌米粒中按以下方案加入如前所述制备的菌液。实验组为红曲霉M9+黄曲霉LQ+X菌株(17个待筛菌株中的1种)这3种菌液各1 mL,混匀后取2 mL菌液接种在籼米上;对照组为这3种菌液与生理盐水的不同组合,均为混匀后取2 mL 菌液接种在籼米上,对照组(1)为1 mL M9+2 mL生理盐水,对照组(2)为1 mL LQ+2 mL生理盐水,对照组(3)为1 mL LQ+1 mL M9+1 mL生理盐水,对照组(4)为1 mL M9+1 mL X菌株菌液+1 mL生理盐水。
1.2.4.4 辅助菌株的确定及其鉴定
在冷却至室温的灭菌米粒中按以下方案加入如前所述制备的菌液。实验组为1 mL M9 +1 mL LQ +1 mL X菌株菌液,混匀后取2 mL菌液接种在籼米上,对照组为1 mL M9 +2 mL生理盐水。选取所制备红曲米色价最高的实验组中所用的待筛菌株作为辅助菌株。采用形态学观察与分子生物学鉴定相结合的方式,确定该菌株的微生物学地位。
1.2.5 贝莱斯芽孢杆菌Y5提高红曲米发酵过程抗污染能力的工艺优化
1.2.5.1 贝莱斯芽孢杆菌Y5的接种时间对红曲米发酵的影响
在冷却至室温的灭菌米粒中按以下方案加入如前所述制备的菌液。实验组为添加体积比为1∶1∶1的红曲霉M9孢子液、黄曲霉LQ孢子液、与M9接种时间间隔0、1、2、3 d的贝莱斯芽孢杆菌Y5菌液。对照组分别为1 mL M9 +2 mL生理盐水和1 mL M9+1 mL LQ +1 mL生理盐水,每组菌液的总加入量为2 mL。
1.2.5.2 贝莱斯芽孢杆菌Y5的接种量对红曲米发酵的影响
在冷却至室温的灭菌米粒中按以下方案加入如前所述制备的菌液。实验组为添加体积比为1∶1∶1的红曲霉M9孢子液、黄曲霉LQ孢子液、稀释10、20、30、40倍的贝莱斯芽孢杆菌Y5菌液,M9和LQ接种后1 d接入Y5菌株菌液。对照组分别为1 mL M9 +2 mL生理盐水和1 mL M9 +1 mL LQ +1 mL生理盐水,每组菌液的总加入量为2 mL。
1.2.5.3 红曲霉M9和贝莱斯芽孢杆菌Y5的混菌比例对红曲米发酵的影响
在冷却至室温的灭菌米粒中按以下方案加入如前所述制备的菌液。实验组为红曲霉M9孢子液∶稀释20倍的贝莱斯芽孢杆菌Y5的菌液体积比依次为1∶1、2∶1、4∶1、8∶1、10∶1,M9和LQ接种后1 d接入Y5菌液,对照组为1 mL M9 +2 mL生理盐水,每组菌液的总加入量为2 mL。
1.2.6 贝莱斯芽孢杆菌Y5提高红曲米发酵过程抗污染能力的验证实验
待灭菌米粒冷却至室温后,在粗放条件下(即不在无菌条件下)加入如前所述制备的1 mL红曲霉M9孢子液+1 mL生理盐水,间隔1 d后加入1 mL稀释20倍的贝莱斯芽孢杆菌Y5菌液,对照组为1 mL M9+2 mL 生理盐水,持续观察各批次中实验组与对照组发酵过程中的染菌情况,共进行10个批次的红曲米发酵验证实验,计算染菌率。
1.2.7 数据处理
所有试验均为3次重复,实验结果使用SPSS软件进行显著性分析。
2 结果与分析
2.1 市售红曲米中优势菌株的分离纯化
将市售红曲米作为曲种发酵红曲米,取发酵至第11天的红曲米,利用乳酸菌、芽孢杆菌和酵母菌培养基,采用稀释平板法与三区划线法相结合分离纯化,最终得到17株菌。
2.2 污染红曲米的黄曲霉菌株的分离纯化及其鉴定
如图1所示,图1-a为从红曲米上分离纯化出来的污染菌LQ菌株在平板上生长的形态,可见呈黄绿色的孢子粉密集,图1-b为其显微形态,可见菌丝有分隔、较短且为疏松的放射状,具有长而粗糙的分生孢子梗,顶端具有近球形的顶囊。
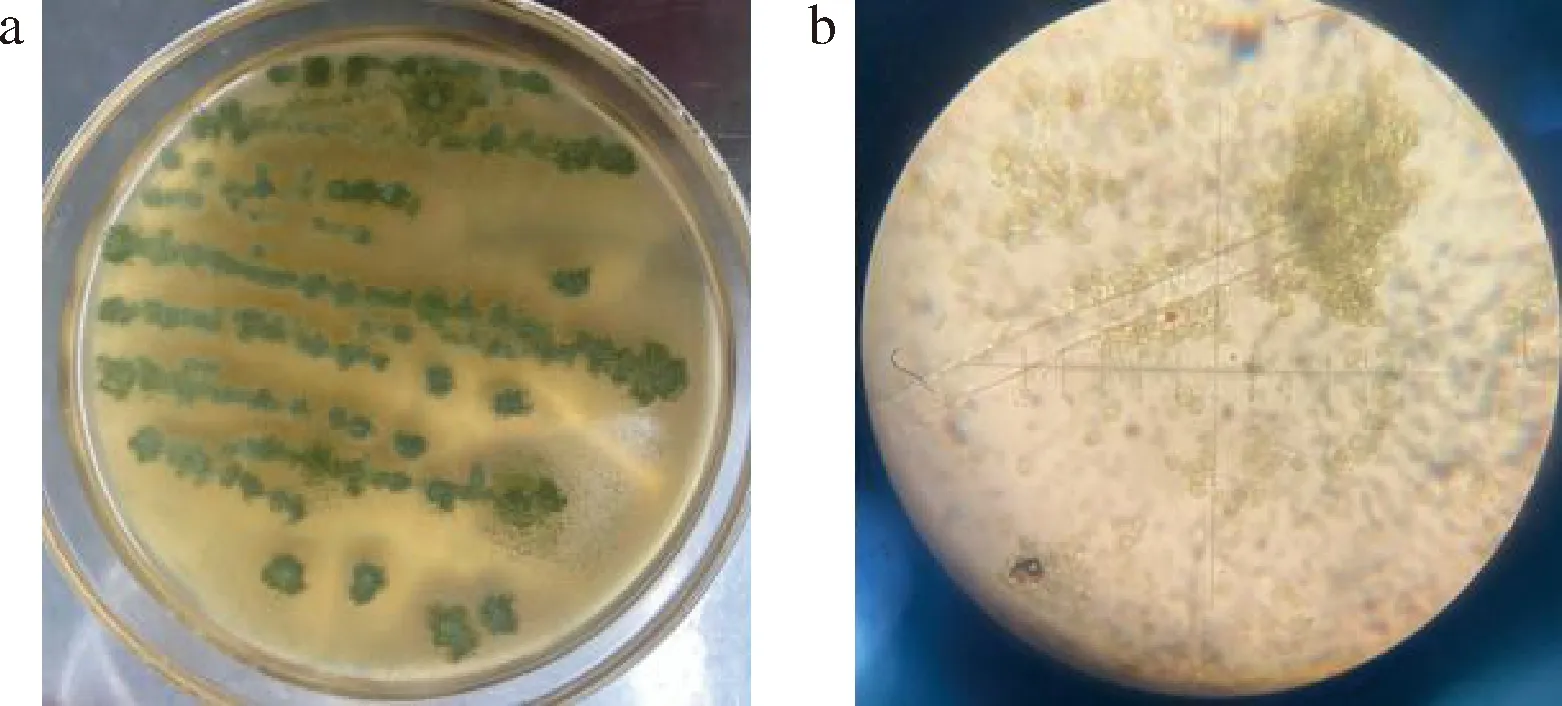
a-菌落形态;b-显微形态图1 菌株LQ菌落形态和显微形态Fig.1 Colony morphology and micromorphology of strain LQ
菌株LQ采用真菌ITS序列鉴定,使用Sanger测序,将所得序列用NCBI上BLAST软件进行比对,鉴定结果表明污染红曲米的菌株LQ与黄曲霉(Aspergillusflavus)的相似度为99.8%,结合形态学特征观察的结果,菌株LQ被鉴定为黄曲霉。
2.3 市售红曲米中具有抗黄曲霉污染能力的菌株的筛选
2.3.1 黄曲霉LQ菌株孢子液添加量对红曲米发酵的影响
为寻找合适的黄曲霉LQ孢子液在红曲米种子液中的添加量,本实验探究了黄曲霉LQ孢子液添加量对红曲米发酵的影响,如图2所示,发酵第3天,A组[V(红曲霉M9)∶V(黄曲霉LQ)∶V(生理盐水)=1∶1∶1]米粒表面长出的白色菌丝、黄绿色孢子的米所占的比例最大,红色米粒的比例最少,表明黄曲霉的此种污染程度使得在红曲米发酵初期已明显阻碍了红曲霉M9在籼米上的生长,而E组[V(红曲霉M9)∶V(黄曲霉LQ)∶V(生理盐水)=1∶1∶1]米粒上已无明显的黄曲霉的生长,其发酵程度与红曲霉M9单菌发酵的对照组的近似。故在后续实验中,在2 mL 的种子液中定量加入2/3 mL的黄曲霉LQ孢子液。
2.3.2 市售红曲米中具有抗黄曲霉污染能力的菌株筛选
前面从市售红曲米中共分离得到17株菌株,为从中筛选到具有抗黄曲霉污染能力的菌株,设置了4组对照组,若对照组(1)中红曲霉M9生长正常,对照组(2)中黄曲霉LQ生长正常,对照组(3)中黄曲霉LQ的生长阻碍红曲霉M9的生长,对照组(4)中X菌的加入未使红曲霉M9的发酵受到明显抑制,并且实验组中因为X菌的加入使得黄曲霉LQ的生长受到抑制,则表明X菌株具有抗黄曲霉污染能力。结果表明,这17株菌中的Y5、J5和J6菌株具有抗黄曲霉污染能力,可以完全抑制黄曲霉产孢,直至发酵结束籼米中都不会出现明显的黄曲霉污染。

图2 黄曲霉LQ孢子液在籼米中的加入量对红曲米发酵的影响Fig.2 Effect of addition of A.flavus LQ spore suspension into indica rice on the fermentation of red fermented rice
2.3.3 辅助菌株的确定及其鉴定
在黄曲霉LQ孢子液加入量为2/3 mL的条件下,分别将Y5、J5和J6菌株与红曲霉M9进行混菌发酵。实验显示,与对照组相比,3株待选菌虽然均可抑制黄曲霉的污染,但与红曲霉M9的混菌发酵所制得的红曲米色价均较低,其中Y5菌的加入所导致的红曲米色价降幅为38.7%,而J5和J6菌株与红曲霉M9混菌发酵制备的红曲米色价比对照组分别降低了62.1%和62.3%,故确定Y5菌株为辅助菌株。
Y5菌株的菌落形态和显微形态如图3所示。将菌株Y5的16S rDNA序列使用Sanger测序,将所得序列用NCBI上BLAST软件进行比对,结果表明Y5菌株与贝莱斯芽孢杆菌(Bacillusvelezensis)菌株的序列相似度达99%,结合其形态学特征观察结果,鉴定其为贝莱斯芽孢杆菌。

a-菌落形态;b-显微形态图3 Y5菌株的菌落形态和显微形态Fig.3 Colony morphology and micromorphology of strain Y5
以上实验表明贝莱斯芽孢杆菌Y5菌可有效地抑制黄曲霉LQ的生长,但其加入也会明显降低红曲米的色价。为此,后续实验尝试通过优化混菌工艺条件,以降低Y5菌株对红曲米发酵带来的不利影响。
2.4 贝莱斯芽孢杆菌Y5提高红曲米发酵过程抗污染能力的工艺优化
2.4.1 贝莱斯芽孢杆菌Y5菌株的接种时间对红曲米发酵的影响
贝莱斯芽孢杆菌Y5菌株是细菌,生长速度快于属于真菌的红曲霉M9,从前述实验结果可知,当Y5菌株与M9菌株同时接入籼米时,会阻碍红曲米的正常发酵,为此通过延后Y5菌株的接种时间,以期在红曲米不被黄曲霉污染的前提下,不影响M9菌株的正常生长,从而提高红曲米的色价。
在黄曲霉LQ孢子液加入量为2/3 mL的条件下,将Y5与M9菌株进行混菌发酵。结果显示,在M9菌株接种1 d后(间隔1 d)接种Y5菌株,所制备的红曲米色价为(2 026.0±5.3)U/g,该色价虽然低于对照组色价[(2 556.4±10.8)U/g],但显著高于间隔0 d加入菌株Y5所制得的红曲米色价[(1 642.1±7.2)U/g],尤其值得注意的是间隔2 d及以上再加入Y5菌株则无法抑制黄曲霉LQ生长,从而导致红曲米无法继续正常发酵(红曲米色价为0),故Y5菌株的接种时间确定为间隔1 d加入。
2.4.2 贝莱斯芽孢杆菌Y5接种量对红曲米发酵的影响
贝莱斯芽孢杆菌Y5作为辅助菌株,其接种量过大将不利于主发酵菌红曲霉M9的生长,但接种量过小也不利于其发挥抑制黄曲霉LQ污染的作用,为此本实验探索了Y5菌株的菌液浓度对红曲米混菌发酵的影响。在黄曲霉LQ孢子液加入量为2/3 mL的条件下,将Y5与M9菌株进行混菌发酵,如图4所示,当Y5菌株的菌液稀释20倍,即菌液浊度(OD560)为0.19时,发酵所制备的红曲米色价最高,故Y5菌株接种量确定为稀释20倍的Y5菌株菌液。

图4 贝莱斯芽孢杆菌Y5接种量对红曲米色价的影响Fig.4 Effect of inoculation volume of B.velezensis Y5 on the pigment value of red fermented rice注:图中不同小写字母代表差异显著(P<0.05)(下同)
2.4.3 红曲霉M9和贝莱斯芽孢杆菌Y5的混菌比例对红曲米发酵的影响
红曲霉M9的生长可提高色价,但黄曲霉污染会严重抑制其生长;贝莱斯芽孢杆菌Y5不能产色素,但其可抑制一定浓度的黄曲霉LQ孢子在籼米中的生长。为了在黄曲霉孢子存在条件下尽可能地提高红曲米色价,本实验优化了M9菌株和Y5菌株的混菌比例。如图5所示,当M9∶Y5混菌比例为8∶1时,红曲米色价[(2 091±15.5)U/g]超过了M9单菌发酵组[(2 029.5±15.5)U/g],因此红曲霉M9和芽孢杆菌Y5的混菌比例确定为8∶1。

图5 红曲霉M9和贝莱斯芽孢杆菌Y5的混菌比例对 红曲米色价的影响Fig.5 Effect of the proportion of A.purpureus M9 and B.velezensis Y5 on the pigment value of red fermented rice
2.5 贝莱斯芽孢杆菌Y5提高红曲米发酵过程抗污染能力的验证性实验
在10个批次粗放条件下的红曲米发酵过程中,红曲霉M9与贝莱斯芽孢杆菌Y5的混菌实验组均未出现染菌情况,而红曲霉M9单菌发酵组有2个批次出现染菌,结果如图6所示。

a-粗放条件下红曲霉M9单菌发酵籼米第3天米粒被污染的情况; b-粗放条件下红曲霉M9单菌发酵籼米第6天米粒被污染的情况图6 粗放条件下红曲霉M9单菌发酵籼米第3天和 第6天米粒被污染的情况Fig.6 Contamination situation of indica rice fermented for 3 d and 6 d which was inoculated only with A.purpureus M9 under extensive conditions
被污染的一批红曲霉M9单菌发酵组在发酵第3天米粒上即出现明显的白色菌丝(图6-a),在发酵第7天米粒上出现明显的黄绿色霉菌孢子(图6-b)。实验表明,Y5菌株的加入能够有效抑制粗放条件下红曲米发酵过程中污染黄曲霉LQ。因此,可以推测,应用本工艺在大规模发酵生产中不需要严格的无菌操作,也能保证红曲米发酵的正常进行。
3 结论与讨论
实验表明,在红曲霉M9菌株接种籼米1 d后以8∶1的比例接种稀释20倍的贝莱斯芽孢杆菌Y5菌液,该混菌工艺可在一定量黄曲霉LQ孢子存在情况下,使红曲米的发酵过程不被污染,且红曲米的色价略高于红曲霉M9单菌发酵的红曲米色价。
红曲米现代制法是以稻米为基质接入红曲霉菌种发酵制成,虽然可控性更强,但极大地限制了有益微生物对红曲米发酵过程的协同作用。黄曲霉与红曲霉同为曲霉属真菌,对营养物质和生长条件的需求与红曲霉有相似之处,且生长速度比红曲霉更快,孢子粉量大且易在空气中传播,一旦污染正在发酵的红曲米,则会阻碍红曲米的正常发酵。红曲米传统的制法是自然培菌、开放式发酵,环境中的微生物在稻米基料上竞争性生长繁殖,优胜劣汰,因此,本研究采用“道法自然”的思路来解决红曲米发酵污染的问题。芽孢杆菌作为微生物拮抗剂,应用于植物上防病治病的研究较多[5-8],但是应用于红曲米的发酵过程以抑制霉菌污染却未见报道。贝莱斯芽孢杆菌在抑制微生物病原生长的同时可促进植物生长而被广泛应用于农业生防[9-10],近年来,也有少数研究将贝莱斯芽孢杆菌用于饲料、食品发酵[11-13]。本课题组首次从红曲米中分离出1株贝莱斯芽孢杆菌,在发酵前期微量接种该菌株可在黄曲霉孢子存在条件下使红曲米的发酵过程不被污染,可见,红曲米传统制法是有其独特之处的,红曲米的发酵不能仅依靠红曲霉单菌,其他菌种的存在对发酵的顺利进行是有着重要的辅助作用的。并且红曲霉M9与贝莱斯芽孢杆菌Y5的混菌实验组所制备的红曲米样品的菌落总数也没有出现超标的问题,因此将贝莱斯芽孢杆作为辅助菌株以提高红曲米大规模发酵生产过程的鲁棒性是基本可行的。虽然贝莱斯芽孢杆菌作为拮抗益生菌具有巨大的应用潜力,但是其生物安全评价相关的研究报道并不多[14],因此未来如果要将该菌应用于红曲米的商业化生产,还应对其生物安全性进行评估。
