小鼠胰腺对梯度胆囊收缩素的应答
2022-11-02武平胡立娟徐晓晴李秋菊姚传山王丰
武平,胡立娟,徐晓晴,李秋菊,姚传山,王丰△
肽类激素胆囊收缩素/促胰酶素(cholecystokinin,CCK)可调节消化吸收过程,刺激胰腺生长,也可参与胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)的发生发展[1]。食物经过胃的初步消化后,经胃排空分批进入十二指肠和近端空肠。此时食糜中的蛋白和脂肪分解物会刺激小肠黏膜中的I细胞(I cell),使其向血中释放CCK[2]。CCK刺激胆囊和胃幽门的收缩及十二指肠壶腹括约肌的舒张,使胃排空暂停并使胆胰液进入肠腔。随后胰液中的胰蛋白酶会抑制I细胞的CCK分泌,使CCK的效应逐渐减弱。随着胆胰液和食糜混合物抵达远端肠管,相对低的CCK血浓度会导致胃排空的再次发生,而进入肠道的食糜则引发新一轮的CCK分泌及CCK效应[2]。如此循环往复直至胃内容物被全部排空[2]。大豆胰蛋白酶抑制剂(soybean trypsin inhibitor,STI)可使I细胞的CCK分泌不再受到胰蛋白酶的抑制,从而诱发高CCK血症[3]。胰腺包埋化学致癌物二甲基苯并蒽(dimethylbenzanthracene,DMBA)可诱导胰腺癌前病变-胰腺上皮内瘤变(pancreatic intraepithelial neoplasia,PanIN)[4]。有研究表明,绿茶中的表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)对多种癌症具有潜在的疗效[5]。既往有关CCK的研究多将血CCK升高到某单一水平,而不同程度高CCK血症是否在靶器官引发梯度效应尚未明确,且高CCK血症对胰腺的生理调节及在胰腺癌进展过程中的作用仍存在争议。本研究给予小鼠不同剂量STI,使循环中的CCK水平呈梯度增高,探讨CCK对胰腺生长、消化酶生成的调节作用及胰腺癌发生的影响,并评估EGCG的抗癌潜能。
1 材料与方法
1.1实验材料5~6周龄雄性C57BL/6小鼠58只,体质量18~20 g,购自北京华阜康生物科技有限公司,饲养于南开医院SPF级实验动物中心。小鼠接受12 h/12 h昼夜循环光照,自由摄食和饮水,经1周适应性喂养后进行后续实验。STI(批号210610,抑制胰蛋白酶活性≥3 000 U/mg,上海如吉生物科技有限公司);DNA提取试剂盒(天津博诚科技有限公司);小鼠胰脂肪酶酶联免疫吸附试验(ELISA)试剂盒(EEL-M2448c,武汉伊莱瑞特生物科技公司);胰蛋白酶测定试剂盒(紫外比色法,A080-2,南京建成生物工程研究所);小鼠胆囊收缩素ELISA试剂盒(CSB-E08115m,武汉华美生物工程有限公司);三溴乙醇(T48402)、DMBA(D3254)均购自美国Sigma-Aldrich公司;Pierce BCA蛋白定量试剂盒(23225,Thermo Fisher Scientific,美国);ABC免疫组织化学染色试剂盒(PK-6200,Vector laboratories,美国);DAB辣根过氧化物酶显色试剂盒(DA1015)、EGCG(E8120)、中性树胶(G8590)、EDTA抗原修复液(50×)pH8.0(C1034)均购自北京索莱宝科技有限公司;增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体(AB92552,Abcam,英国);Co60大小鼠维持饲料(SPF-F02-002,斯贝福北京生物技术有限公司),含粗蛋白18%,粗脂肪4%;组织匀浆机(Tissue Master 125,OMNI International,美国);酶标仪(ST360,上海科华实验系统有限公司);Thermo ScientificTMNano Drop 2000分光光度计;紫外分光光度计(Gene Quant 1300,Biochrom,英国);正置显微镜(DM4000B)、组织脱水机(ASP200S)、石蜡切片机(RM2235)、组织包埋机(EG1150H+C)、摊 片机(H1210)、烤片机(H1220)、Leica 819一次性窄刀片(14035838925)均购自德国Leica公司;改良Lillie-Mayer苏木素染色液(DH0001)、伊红染色液(DH0044)均购自北京雷根生物技术有限公司。
1.2动物实验(1)生理研究。采用随机数字表法将小鼠分为0 g/L STI组(n=11)、2 g/L STI组(n=11)、4 g/L STI组(n=10)、8 g/L STI组(n=11),分别给予含0、2、4和8 g/L STI的饮水。经STI干预2周后,小鼠禁食18 h,从内眦采集血液至含EDTA二钾的抗凝管中,离心(1 500×g,15 min,4℃)获取血浆。小鼠采用颈椎脱位法处死,剖开腹腔,切除胰腺,记录胰腺湿质量。将胰腺分为两部分,一部分置于4%多聚甲醛中固定,另一部分于-80℃保存,用于后续检测。(2)癌发生研究。采用随机数字表法将剩余小鼠分为正常对照组、DMBA包埋组、DMBA+2 g/L STI组、DMBA+8 g/L STI组、DMBA+8 g/L STI+EGCG组,每组3只。将0.05 mg DMBA超声后混悬于10 μL生理盐水中,得到DMBA混悬液。小鼠禁食16 h后,腹腔注射2,2,2-三溴乙醇(0.3 mg/g)麻醉。在加热垫上经剃毛和腹部皮肤消毒后,打开腹腔暴露脾,用镊子轻拉出胰腺尾部,用注射器将10 μL DMBA混悬液注射入胰腺,用棉棒轻压注射口防止液体渗出,使用连续缝合逐层关闭壁层腹膜和骨骼肌,间断缝合皮肤创面。小鼠术后禁食24 h,术后4 h皮下注射0.6 mL生理盐水(含10%葡萄糖)。STI处理组于DMBA包埋1周后进行STI处理。DMBA+8 g/L STI+EGCG组每天腹腔注射EGCG(25 mg/kg,生理盐水溶解)。DMBA包埋6周后处死小鼠,将胰腺置于4%多聚甲醛固定后进行组织学分析。
1.3检测方法
1.3.1血浆CCK水平检测将标准品和血浆样品移入ELISA板孔中,37℃孵育2 h,倾去不洗,将生物素偶联抗体添加到孔中,孵育后PBS清洗3次,每次3 min,加入辣根过氧化物酶标记的亲和素孵育,洗涤去除未结合的亲和素酶试剂,添加底物溶液,37℃水浴箱中孵育20 min,加入终止液,使用酶标仪在450 nm波长处测量吸光度(A)值,最后通过标准曲线计算CCK水平。
1.3.2胰腺组织中蛋白质含量测定将胰腺组织用PBS清洗,将含1%PMSF的RIPA裂解液与之混合后在冰上用组织匀浆器匀浆,离心(10 000 r/min,15 min,4℃)后将上清液和牛血清白蛋白标准品加入96孔板中,每孔10 μL,将试剂盒中的A液与B液按照50∶1的比例配成工作液,每孔加100 μL,放入37℃水浴箱中,孵育30 min显色,在波长为570 nm处用酶标仪读取A值,根据标准曲线公式计算胰腺组织中的蛋白质含量。
1.3.3胰腺组织中DNA含量测定冰浴下研碎胰腺组织,精确称量后与试剂盒中的裂解液混合,按照说明书经过离心等操作后最终出现白色沉淀,使用无水乙醇清洗后干燥得到组织中的DNA,将其溶解于一定体积的双蒸水中,用Thermo ScientificTMNanoDrop 2000分光光度计测定DNA浓度,计算胰腺组织中的DNA含量。
1.3.4胰腺组织中胰蛋白酶含量测定精确称量胰腺组织并加入9倍体积的匀浆介质,冰浴条件下机械匀浆,离心(2 500 r/min,10 min,4℃)后取上清液。上清液与底物混合后放入37℃水浴箱中孵育并计时,在30 s时倒入石英比色皿中,于253 nm处使用紫外分光光度计读取吸光度(A)1值后放回水浴中,并在20 min后再次读取A2值,计算两次差值ΔA=A2-A1,根据胰腺组织的质量和ΔA值计算胰蛋白酶量。
1.3.5胰脂肪酶含量测定冻存的胰腺组织称质量后,按照1∶9的比例加入PBS在冰浴中制成匀浆,将样品和标准品中加入板中37℃孵育1.5 h,甩尽孔内液体,不洗。每个孔中加入生物素化抗体工作液100 μL,酶标板加覆膜,37℃温育1h,甩尽孔内液体。每孔加洗涤液350 μL,浸泡1 min倾去,洗涤3次。每孔加酶结合物工作液100 μL后37℃温育30 min,洗涤后,加入显色底物,观察到反应呈现蓝色后,加终止液后变成黄色。用酶标仪在450 nm波长处测量A值,通过绘制标准曲线计算样品的浓度。
1.3.6胰腺免疫组织化学染色采用免疫组织化学染色检测胰腺组织PCNA阳性细胞百分比。小鼠胰腺经过4%多聚甲醛溶液固定和石蜡包埋后切为4 μm厚切片,切片于二甲苯脱蜡后梯度乙醇脱水。使用EDTA缓冲液微波15 min抗原修复,自然冷却后用PBS漂洗3次,每次5 min,随后置于湿盒内滴加3%过氧化氢溶液孵育20 min。洗涤后,使用马血清室温下封闭2 h,倾去不洗,滴加PCNA抗体(1∶200)置于4℃孵育过夜。次日复温30 min后再洗涤,滴加试剂盒中提供的生物素标记的马抗兔抗体,常温孵育30 min。洗涤后加入辣根过氧化物酶标记链霉卵白素工作液孵育15 min。洗涤后滴加DAB显色液显色2~3 min,浸入自来水中止显色。苏木素复染、脱水、透明,中性树胶封片,镜下观察PCNA表达情况。每组随机读取15个视野进行检查,并统计阳性细胞所占总细胞数比例。
1.3.7胰腺组织HE染色癌发生实验的胰腺组织行HE染色后进行病理学诊断。组织制成4 μm切片,37℃恒温烘烤24 h。切片放入二甲苯中脱蜡10 min;经无水乙醇脱水10min,双蒸水洗后入苏木素染核2 min,经盐酸乙醇分色后水洗再入氨水蓝化,入伊红染液2 min;经乙醇脱水;二甲苯透明封片后光学显微镜下观察,参照PanIN分级标准进行病理学诊断。
1.4统计学方法采用SPSS 22.0软件进行数据分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 小鼠循环中CCK水平及胰腺湿质量2 g/L STI组CCK水平高于0 g/L STI组(P<0.05),4 g/L STI组CCK水平与0、2 g/L STI组差异无统计学意义(P>0.05),8 g/L STI组CCK水平均高于0、2和4 g/L STI组(P<0.05)。2、4 g/L STI组胰腺湿质量高于0 g/L STI组(P<0.05);4 g/L STI组胰腺湿质量与2 g/L STI组差异无统计学意义(P>0.05);8 g/L STI组胰腺湿质量高于0、2 g/L STI组(P<0.05),与4 g/L STI组差异无统计学意义。见表1。
Tab.1 Comparison of CCK concentration and pancreatic wet mass of mice between the four groups表1各组小鼠CCK水平及胰腺湿质量比较(±s)
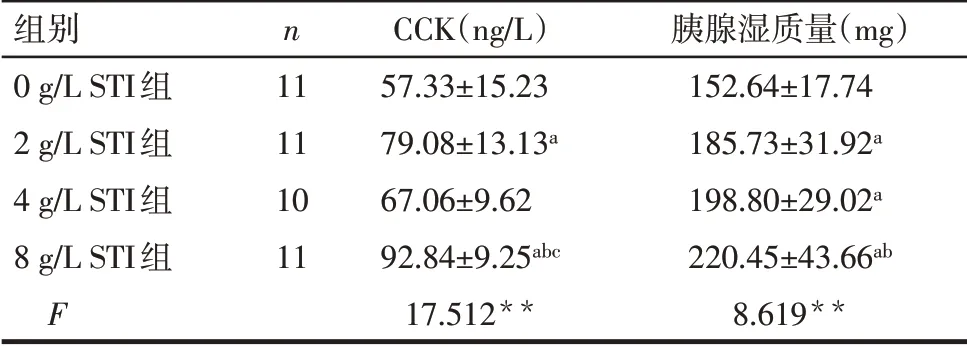
Tab.1 Comparison of CCK concentration and pancreatic wet mass of mice between the four groups表1各组小鼠CCK水平及胰腺湿质量比较(±s)
**P<0.01;a与0 g/L STI组比较,b与2 g/L STI组比较,c与4 g/L STI组比较,P<0.05。
组别0 g/L STI组2 g/L STI组4 g/L STI组8 g/L STI组F n 11 11 10 11 CCK(ng/L)57.33±15.23 79.08±13.13a 67.06±9.62 92.84±9.25abc 17.512**胰腺湿质量(mg)152.64±17.74 185.73±31.92a 198.80±29.02a 220.45±43.66ab 8.619**
2.2 小鼠胰腺蛋白质和DNA含量比较2、4 g/L STI组蛋白质和DNA含量高于0 g/L STI组(P<0.05),4 g/L STI组蛋白质和DNA含量与2 g/L STI组差异无统计学意义(P>0.05),8 g/L STI组蛋白质和DNA含 量 高 于0、2和4 g/L STI组(P<0.05)。见表2。
2.3 小鼠胰腺中消化酶含量0、2、4和8 g/L STI组胰蛋白酶含量依次升高,组间多重比较差异均有统计学意义(P<0.05)。2、4、8 g/L STI组胰脂酶含量高于0 g/L STI组(P<0.05),2、4、8 g/L STI组胰脂酶含量差异均无统计学意义(P>0.05)。见表3。
Tab.2 Comparison of protein and DNA content in pancreas of mice between the four groups表2各组小鼠胰腺蛋白质和DNA含量比较(±s)
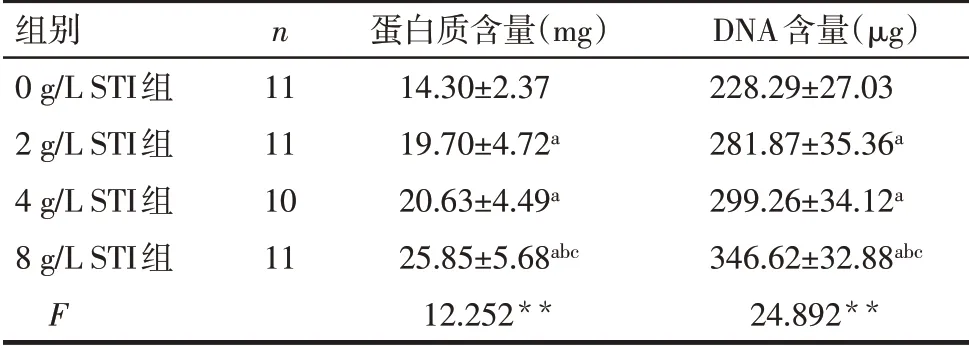
Tab.2 Comparison of protein and DNA content in pancreas of mice between the four groups表2各组小鼠胰腺蛋白质和DNA含量比较(±s)
**P<0.01;a与0 g/L STI组比较,b与2 g/L STI组比较,c与4 g/L STI组比较,P<0.05。
组别0 g/L STI组2 g/L STI组4 g/L STI组8 g/L STI组F n 11 11 10 11蛋白质含量(mg)14.30±2.37 19.70±4.72a 20.63±4.49a 25.85±5.68abc 12.252**DNA含量(μg)228.29±27.03 281.87±35.36a 299.26±34.12a 346.62±32.88abc 24.892**
Tab.3 Comparison of digestive enzymes of pancreatic tissue of mice between the four groups表3各组小鼠胰腺组织中消化酶含量比较(±s)

Tab.3 Comparison of digestive enzymes of pancreatic tissue of mice between the four groups表3各组小鼠胰腺组织中消化酶含量比较(±s)
**P<0.01;a与0 g/L STI组比较,b与2 g/L STI组比较,c与4 g/L STI组比较,P<0.05。
组别0 g/L STI组2 g/L STI组4 g/L STI组8 g/L STI组F n 11 11 10 11胰蛋白酶含量(U/mg)5.53±0.62 6.86±0.57a 7.98±0.57ab 9.74±0.88abc 76.520**胰脂酶含量(ng/g)325.89±63.38 435.03±35.89a 468.73±82.43a 469.35±96.56a 9.391**
2.4 小鼠胰腺组织中PCNA阳性细胞结果0、2、4、8 g/L STI组小鼠胰腺组织PCNA阳性细胞比例依次升高,分别为1.93%±1.75%、3.60%±1.40%、5.00%±2.14%、6.60%±2.06%,差 异 有 统 计 学 意 义(F=17.120,P<0.05),见图1。
2.5 CCK和EGCG对胰腺癌发生的作用与正常对照组相比,DMBA包埋组出现胰腺导管的细胞核拥挤和排列紊乱现象,在DMBA+2 g/L STI组中加重且出现核深染。DMBA+8 g/L STI组还出现了由间变细胞组成的条索状病灶。在DMBA+8 g/L STI+EGCG组中癌前病损的程度有所减轻,见图2。
3 讨论
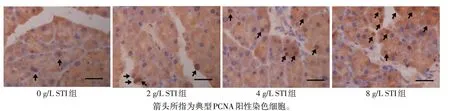
Fig.1 Results of immunohistochemical staining of PCNA in pancreas(scale=25 μm)图1小鼠胰腺组织PCNA免疫组织化学染色结果(比例尺=25 μm)

Fig.2 Effects of CCK and EGCG on neoplastic lesion in mouse pancreas embedded with DMBA(scale=25 μm)图2 CCK和EGCG对胰腺包埋DMBA小鼠癌发生的作用(比例尺=25 μm)
胰腺是人体的重要消化腺,分为内外分泌腺两大部分,其中外分泌腺可以分泌胰液。胰液内含有各种消化酶,胰酶分泌是促进营养物质消化和吸收的重要步骤,胰蛋白酶和胰脂酶是胰酶的重要组成成分[6]。胃肠激素CCK可调节机体的消化和吸收过程,刺激胰腺消化酶的生成和分泌,并刺激胰腺生长,也可参与胰腺癌的发生发展[1]。STI是一种大豆蛋白且具有胰蛋白酶抑制活性,可使I细胞的CCK分泌不再受到抑制,从而提升循环中CCK水平[3]。既往有关CCK的研究多将血CCK升高到某单一水平,而不同程度高CCK血症是否对靶器官有不同的效应尚未明确。
本实验分别给予小鼠含不同质量浓度(0、2、4和8 g/L)的STI,在其体内诱导不同程度CCK水平,结果显示:(1)2、4 g/L STI组胰腺湿质量高于0 g/L STI组,8 g/L STI组胰腺湿质量高于0、2 g/L STI组。(2)2、4 g/L STI组胰腺蛋白质含量和DNA含量高于0 g/L STI组,8 g/L STI组蛋白质含量和DNA含量高于0、2和4 g/L STI组。(3)0、2、4和8 g/L STI组胰蛋白酶含量依次升高;2、4、8 g/L STI组胰脂酶含量高于0 g/L STI组。以上结果提示循环中CCK水平不同可导致胰腺不同程度增生,胰酶生成。此法因制备简单,且CCK水平可控,较通过手术方式将携带胆胰总管的十二指肠转移到远端小肠的高CCK血症模型即胰胆转流术(pancreatobiliary diversion,PBD)更有前景[7]。
PCNA是反映细胞增殖状态的指标,因其只存在于正常增殖细胞及肿瘤细胞内而得名。本研究结果显示,0、2、4、8 g/L STI组小鼠胰腺组织PCNA阳性细胞比例依次升高;此结果与CCK循环水平、胰腺湿质量和胰腺内DNA含量的结果基本一致,进一步证实胰腺在受到CCK刺激后发生了增生。
近年来,中国胰腺癌发病率和死亡率呈明显上升趋势,且在男性和老年人群中尤为明显;胰腺癌早期缺乏特异症状,确诊时多已不能手术治愈,加之对放化疗不敏感,中位生存期多不足半年[8-9]。目前有关CCK刺激胰腺癌发生的机制尚未明确。CCK受体(cholecystokinin receptor,CCKR)属G蛋白偶联受体,胰岛素受体(insulin receptor,IR)属受体酪氨酸激酶家族(receptor tyrosine kinase,RTK),这两种受体在胰腺癌的发生和发展过程中起到了重要作用[10-11]。EGCG是茶叶中的主要儿茶素,约占59%。EGCG作为绿茶中的有效成分,具有抗炎、抗菌和抗氧化等多种作用。因EGCG具有IR拮抗剂的作用[12],其抗癌作用越来越受到关注[5,10]。本研究结果显示,随着CCK水平增高,胰腺组织的癌前病变程度有加重趋势,而EGCG可减轻高CCK血症诱导的胰腺癌前病变的程度,其原因可能与CCKR与IR的信号传导间存在偶联有关,但此种偶联关系尚未明确,阐明此偶联关系可能会对胰腺癌的防治有重要意义。
综上所述,不同剂量STI能诱发不同程度的高CCK血症,CCK可刺激胰腺增生、胰酶生成及胰腺癌的发生,而EGCG具有减轻胰腺癌前病变的作用。
