调理中焦气机法对脓毒症大鼠肠道屏障损伤及炎症因子的影响*
2022-11-02李国臣王为为田正云魏久翔范开亮
李国臣 王为为 田正云 谢 娜 魏久翔 郝 浩 范开亮 孔 立△
(1.山东中医药大学附属医院,山东 济南 250011;2.山东中医药大学,山东 济南 250014)
脓毒症是因感染导致的危及生命的器官功能障碍[1-2],病死率高达29%~38%[3-4]。胃肠道是脓毒症发病早期最易累及的器官之一,是“应激反应的中心”,是“多器官功能障碍(MODS)的发动机”,脓毒症合并急性胃肠损伤可进一步加重全身感染,加速SIRS向MODS的发生发展,并与患者不良预后密切相关[5-6]。最新研究证实,在导致脓毒症胃肠损害的众多机制中,炎症介质的失控性释放是其主要机制[7-8],因此从炎症反应入手探讨减轻脓毒症胃肠损伤具有重要意义。
近年来,中医学在防治脓毒症及器官损害方面进行了深入探索[9-10]。本研究团队提出脓毒症的根本病机为气机逆乱,中焦脾胃是气机逆乱的枢纽,调理中焦气机是脓毒症治疗的关键。临床研究发现,通过调理中焦气机可明显改善患者腹胀腹痛、恶心反流、便秘或下利等临床症状,能降低患者腹内压,恢复肠鸣音,减轻胃肠道损伤[11-12]。但其防治脓毒症胃肠功能障碍方面的分子机制仍不明确。本研究拟从脓毒症胃肠损伤着手,以炎症反应为切入点,观察调理中焦气机法对脓毒症大鼠肠屏障的保护作用,探讨其分子机制,以期为临床应用提供实验依据。
1 材料与方法
1.1 实验动物
雄性SD大鼠,共40只,6~8周龄,SPF级,体质量(200±20)g,均购自山东彭悦实验动物公司,合格证号SCXK(鲁)20140007。饲养于恒温(22±20)℃、恒湿(55±5)%条件实验室。本实验经山东中医药大学附属医院实验动物伦理委员会批准(AWE-2019-047)。
1.2 实验药物
半夏泻心汤组成:清半夏12 g,黄芩9 g,黄连3 g,人参9 g,干姜9 g,甘草9 g,大枣4枚(约16 g)。药材购自山东中医药大学附属医院中药房,制剂和质量控制由山东中医药大学附属医院制剂室负责。药物配置方法:将颗粒煎煮、无菌滤膜过滤后,置60℃水浴箱内分别浓缩至含药1.2、0.6、0.3 g/mL的药液,常温冷却后,4℃冰箱保存备用。
1.3 试剂与仪器
白细胞介素-6(IL-6)试剂盒(Elabscience公司);白细胞介素-1β(IL-1β)试剂盒(Elabscience公司);肿瘤坏死因子-α(TNF-α)试剂盒(Elabscience公司);兔kit(北京中杉金桥生物技术有限公司);柠檬酸抗原修复液(福州迈新生物技术有限公司);DAB显色试剂盒(Solarbio公司);IL-6抗体(武汉三鹰科技有限公司);IL-1β抗体(武汉三鹰科技有限公司);TNF-α抗体(北京博奥森生物技术有限公司);DAO试剂盒(Elabscience公司);D-乳酸试剂盒(南京Sbjbio科技有限公司);内毒素试剂盒(南京Sbjbio科技有限公司)。Muliskan酶标仪(美国Thermo Scientific公司);37℃恒温箱;可调微量移液枪(德国Thermor公司);轮转式切片机(LEICA公司);病理组织漂烘仪(郝思琳仪器设备有限公司)显微镜(OLYMPUS公司);隔水式恒温培养箱(上海跃进医疗器械有限公司);电热恒温鼓风干燥箱(上海锦屏仪器有限公司)。
1.4 模型制备
采用盲肠结扎穿孔法(CLP)建立脓毒症大鼠模型[13]。术前常规禁食8 h,术前腹腔麻醉,待麻醉完全后,中下腹部备皮,消毒后铺无菌洞巾。双人协作,沿腹中线先剪一长约1 cm切口,后逐层开腹,进入腹腔内,用无菌无齿镊子轻轻探查找到盲肠。轻轻将盲肠从切口处牵拉至腹腔外,用4-0尼龙缝线结扎其近回盲瓣端1/3处(避免结扎回肠及盲肠系膜血管),在结扎处与盲肠盲端之间中点处用无菌注射器针头从系膜缘向对系膜缘贯通穿刺,轻轻挤压穿刺点附近盲肠并挤出少许肠内容物,将盲肠连同挤出的内容物一同还纳入腹腔,逐层缝合并关闭腹腔,再次皮肤碘伏酒精消毒。另取8只大鼠进行相同的开腹探查术,不进行盲肠结扎和穿孔,作为假手术组。手术结束后予2 mL/100 g生理盐水进行液体复苏。
1.5 分组及给药
40只SD大鼠随机分为假手术组、模型组和中药高、中、低剂量组,每组8只。按照人-动物体表面积法来计算给药剂量,假手术组、模型组予10 mL/kg生理盐水灌胃;中药低剂量组予半夏泻心汤3.05 g/kg灌胃;中药中剂量组予半夏泻心汤6.1 g/kg灌胃;中药高剂量组予半夏泻心汤12.2 g/kg灌胃。每12小时给药1次。
1.6 标本采集与检测
1.6.1 血清二胺氧化酶(DAO)、D-乳酸、内毒素水平检测 给药24 h后对大鼠进行充分麻醉,腹主动脉取血,分离血清,用ELISA法检测血清DAO、D-乳酸、内毒素水平。
1.6.2 苏木素-伊红(HE)染色观察肠道病理形态学变化 给药24 h后取回肠部肠组织后经甲醛固定,乙醇脱水,石蜡包埋,切片,二甲苯脱蜡,HE染色,中性树胶封片。在光学显微镜下观察肠黏膜组织病理学改变,参照Chiu's肠黏膜损伤评分标准,根据炎症、萎缩和肠上皮化生等组织学变化分为0~5级,分别计1~6分。
1.6.3 血清IL-1β、IL-6和TNF-α检测 给药24 h后对大鼠进行充分麻醉,腹主动脉取血,分离血清,用ELISA法检测血清炎症因子IL-1β、IL-6和TNF-α水平。
1.6.4 免疫组化法检测肠组织中IL-1β、IL-6、TNF-α表达 给药24 h后取回肠部肠组织,制作石蜡切片,将石蜡切片进行脱蜡,3%H2O2去离子水中孵育,滴加试剂A,滴加一抗,滴加试剂B,滴加试剂C。使用苏木素复染,再用盐酸乙醇分化。透明后,树脂胶封片,充分凝固后。在镜下选择染色均匀清晰区域进行图像采集和分析,每肠组织选择3张切片,在显微镜下每张切片分别截取5个视野,截取的这5个视野中每个视野互不重叠。
1.7 统计学处理
应用IBM SPSS20.0统计软件。计量资料以()表示,多组比较选用单因素方差分析,P<0.05为差异有统计学意义。数据图表选用Graphpad prism 6.0进行绘制。
2 结果
2.1 各组大鼠血清DAO、D-乳酸、内毒素水平比较
见表1。与假手术组相比,造模后大鼠血清DAO、D-乳酸和内毒素水平明显升高(P<0.01);与模型组比较,中药治疗组大鼠血清DAO、D-乳酸和内毒素水平均有降低(P<0.01);不同剂量组间比较,高剂量组治疗效果最优(P<0.01或P<0.05)。
表1 各组大鼠血清DAO、D-乳酸和内毒素水平比较(pg/mL,±s)
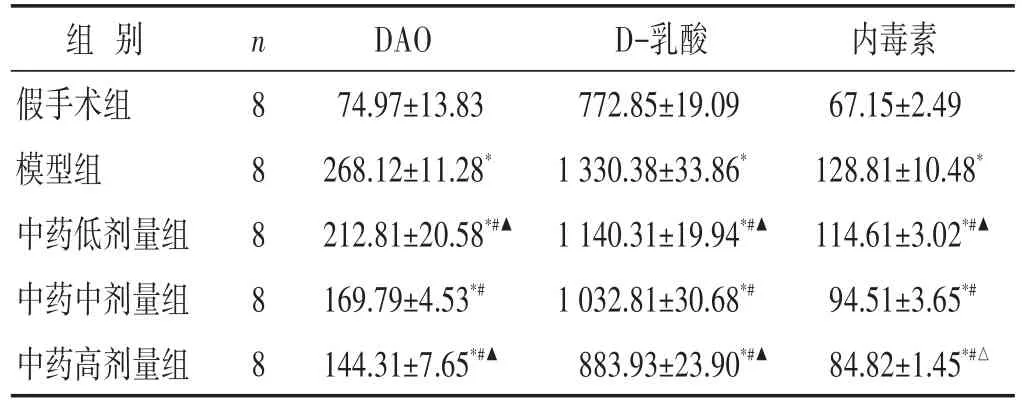
表1 各组大鼠血清DAO、D-乳酸和内毒素水平比较(pg/mL,±s)
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.01;与中药中剂量组比较,△P<0.05,▲P<0.01。下同。
组别假手术组模型组中药低剂量组中药中剂量组中药高剂量组n 8 8 8 8 8 DAO 74.97±13.83 268.12±11.28*212.81±20.58*#▲169.79±4.53*#144.31±7.65*#▲D-乳酸772.85±19.09 1 330.38±33.86*1 140.31±19.94*#▲1 032.81±30.68*#883.93±23.90*#▲内毒素67.15±2.49 128.81±10.48*114.61±3.02*#▲94.51±3.65*#84.82±1.45*#△
2.2 各组大鼠肠道病理形态学变化
假手术组黏膜层肠上皮结构完整,上皮细胞形态结构正常、排列紧密,固有层肠腺丰富,可见较多杯状细胞,未见明显炎症。模型组黏膜层可见大面积上皮细胞脱落,固有层裸露;局部可见溃疡,固有层肠腺数量减少,被增生的结缔组织取代,伴有较多淋巴细胞浸润;局部可见静脉血管淤血扩张。中药治疗组中中药高剂量组肠黏膜损伤最轻,黏膜层局部可见少量上皮细胞脱落;固有层肠腺丰富,可见较多杯状细胞,局部可见少量炎性浸润。见表2,图1。
表2 各组肠组织病理损伤Chiu's评分比较(分,±s)
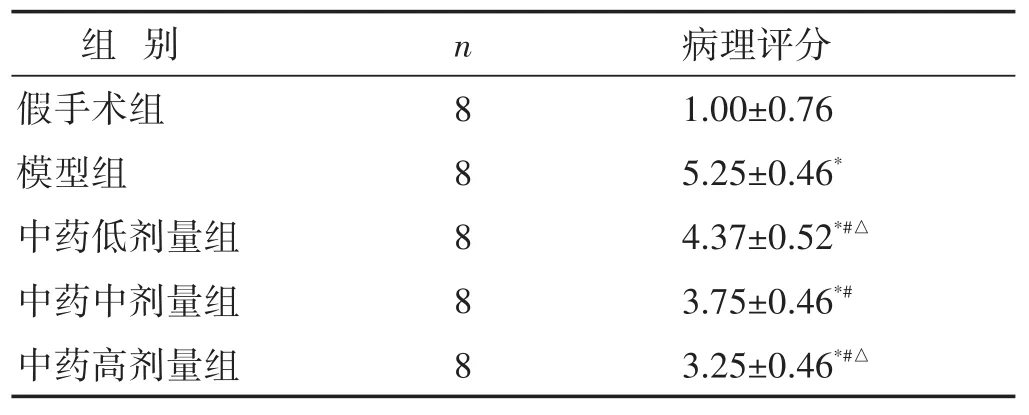
表2 各组肠组织病理损伤Chiu's评分比较(分,±s)
组 别n 病理评分8 8 8 8 8假手术组模型组中药低剂量组中药中剂量组中药高剂量组1.00±0.76 5.25±0.46*4.37±0.52*#△3.75±0.46*#3.25±0.46*#△
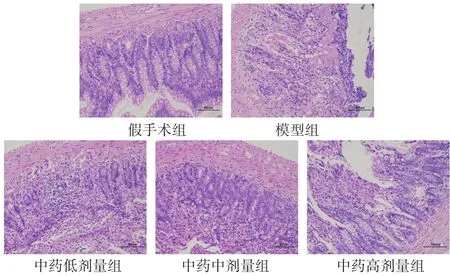
图1 各组大鼠肠道病理形态学变化(HE染色,200倍)
2.3 各组大鼠血清IL-1β、IL-6和TNF-α水平比较
见表3。与假手术组比较,各造模组大鼠血清IL-1β、IL-6和TNF-α水平明显升高(P<0.01);与模型组比较,中药治疗组大鼠血清IL-1β、IL-6和TNF-α水平下降(P<0.01),中药高剂量组水平最低(P<0.05)。
表3 各组大鼠血清IL-1β、IL-6和TNF-α水平比较(pg/mL,±s)
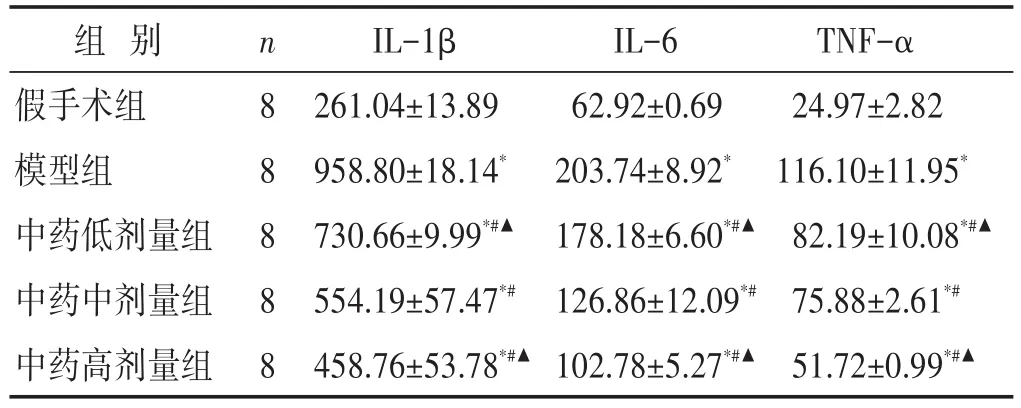
表3 各组大鼠血清IL-1β、IL-6和TNF-α水平比较(pg/mL,±s)
组别假手术组模型组中药低剂量组中药中剂量组中药高剂量组n 8 8 8 8 8 IL-1β 261.04±13.89 958.80±18.14*730.66±9.99*#▲554.19±57.47*#458.76±53.78*#▲IL-6 62.92±0.69 203.74±8.92*178.18±6.60*#▲126.86±12.09*#102.78±5.27*#▲TNF-α 24.97±2.82 116.10±11.95*82.19±10.08*#▲75.88±2.61*#51.72±0.99*#▲
2.4 各组大鼠肠组织IL-1β、IL-6和TNF-α表达比较
见表4,图2。使用ImageJ pro6.0软件对免疫组化照片进行分析,每张切片选取3张200倍照片,计算其平均光密度进行比较分析。结果显示,与假手术组相比,其余各组肠组织IL-1β、IL-6和TNF-α阳性表达显著升高(P<0.01);与模型组相比,中药治疗组大鼠肠组织IL-1β、IL-6和TNF-α阳性表达显著降低(P<0.01);中药高剂量组阳性表达最低(P<0.05)。
表4 各组大鼠肠组织IL-1β、IL-6和TNF-α水平比较(±s)

表4 各组大鼠肠组织IL-1β、IL-6和TNF-α水平比较(±s)
组别假手术组模型组中药低剂量组中药中剂量组中药高剂量组n 8 8 8 8 8 IL-1β 9.08±0.68 58.83±6.30*#45.46±4.37*#▲33.48±4.7*#23.44±3.47*#△IL-6 24.04±2.18 89.83±8.92*#69.39±7.10*#▲52.87±3.84*#39.79±2.79*#△TNF-α 1.47±0.25 12.11±1.87*#9.05±7.34*#▲6.29±0.96*#4.28±0.40*#△
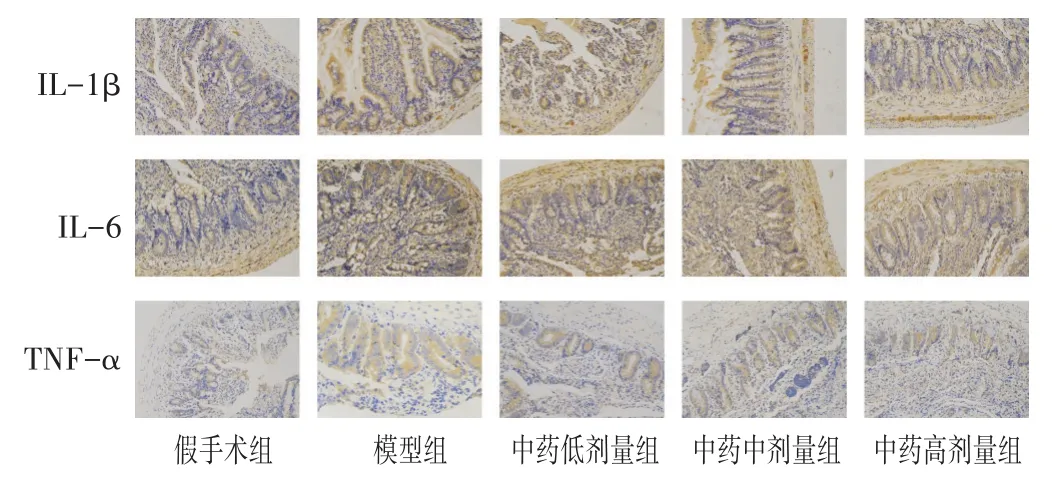
图2 各组大鼠肠组织IL-1β、IL-6和TNF-α阳性表达
3 讨论
脓毒症是因感染导致的危及生命的器官功能障碍,胃肠道是脓毒症时最易受损的器官,易发生胃肠功能障碍。胃肠功能的正常,有赖于肠道屏障功能的完整性。现代研究发现脓毒症时炎症因子过度释放,失控的炎症反应是导致肠道屏障功能损伤的主要病理机制。脓毒症初期细菌内毒素或脂多糖与结合蛋白结合形成免疫复合物,与单核细胞或巨噬细胞表面的Toll样受体相结合,加速炎症因子的分泌与释放,导致全身性炎症表现。炎症因子的大量释放可对肠道上皮细胞造成损伤,引起肠黏膜水肿、充血,上皮细胞膜及细胞间固有连接断裂,细胞坏死,造成肠道通透性增加、肠道屏障功能受损[14-15]。本研究采用国际公认的盲肠结扎穿孔法制备脓毒症大鼠模型,研究发现,造模后脓毒症大鼠血清DAO、D-乳酸、内毒素等反映肠道屏障损伤的指标明显上升,提示脓毒症大鼠肠道屏障受损,同时血清及肠组织中炎症因子IL-1β、IL-6和TNF-α水平明显升高,提示发生了失控的炎症反应,这与相关研究报道一致。
脓毒症是一种复杂疾病,涉及全身多脏器,往往毒邪、痰浊、瘀血等诸邪毕至,相兼为病,单从某一脏某一腑进行论治,往往不能涵盖整个脓毒症病机。孔立教授认为纵观脓毒症整个病变过程,气机逆乱贯穿于脓毒症始终,西医所说的器官功能障碍或衰竭,即是中医的脏腑气机逆乱,提出脓毒症的根本病机为气机逆乱,特点是始于一处、五脏皆乱。脏腑功能的正常要靠脏腑之气的升降出入协调平衡,脏腑气机逆乱,则精气血精液化生和输布异常,痰浊、瘀血、火毒之邪骤生,合而致病,日久由气及血致虚,最终致气血衰败,出现脏腑受损,危及生命。孔立教授通过分析五脏生理特点并结合三焦辨证,进一步指出:五脏气机逆乱始于肺,中焦脾胃是五脏气机逆乱的枢纽,调理中焦气机是脓毒症治疗的关键,应贯穿脓毒症始终。
半夏泻心汤源于汉·张仲景所著《伤寒杂病论》,仲景初用之治疗痞证,后随着中医体系发展,其可用以治疗各种因中焦气机逆乱所致疾病,为调理中焦气机代表方,方中半夏、干姜之辛散合黄芩、黄连之苦降,协调恢复中焦气机升降之职。苦辛合用,寓开于泻,通而有降,使清阳得升,浊阴得降,中焦气机升降复常。同时,半夏泻心汤寒温并投、调和阴阳,甘温调补、扶正祛邪的特点,正符合临床对于脓毒症胃肠功能障碍患者的治疗要求。半夏泻心汤药理研究进展迅速,已证实其具有调控肠道炎症反应、保护胃肠黏膜、改善肠道菌群、调节胃肠动力、免疫应答和调控胃肠激素分泌的作用[16-18]。本研究发现,给予半夏泻心汤治疗后,脓毒症大鼠血清DAO、D-乳酸、内毒素水平明显下降,肠道组织病理学评分降低,提示脓毒症大鼠肠道屏障损伤减轻,同时血清及肠组织中炎症因子IL-1β、IL-6和TNF-α水平也明显下降,提示半夏泻心汤治疗能下调脓毒症时失控的炎症反应。同时,不同剂量组间比较,半夏泻心汤高剂量组治疗作用最优,具有剂量依赖性。
本研究通过盲肠结扎穿孔法制备脓毒症大鼠模型,予调理中焦气机的半夏泻心汤干预,半夏泻心汤治疗能降低脓毒症大鼠血清和肠组织中IL-1β、IL-6和TNF-α等炎症因子水平,对脓毒症大鼠肠屏障损伤具有保护作用,并存在剂量依赖性。本研究说明调理中焦气机法可以减轻脓毒症大鼠肠道屏障损伤,这可能与其抑制炎症因子的释放有关。
