针刀对膝骨关节炎兔软骨细胞氧化应激的影响*
2022-11-02陈烯琳秦露雪郭长青
张 茜 张 典 许 悦 陈烯琳 秦露雪 郭长青
(北京中医药大学,北京 100029)
膝骨关节炎(KOA)作为一种常见的慢性退行性骨关节炎疾病,以疼痛、活动受限为主要临床表现,以软骨退变、滑膜病变等为主要病理表现[1]。研究显示,异常生物力学可参与KOA的发生,并造成关节软骨活性氧(ROS)的异常升高及抗氧化酶的减少,诱发软骨细胞的氧化应激[2]。氧化应激可通过损伤线粒体基因组(mtDNA),及唤醒丝裂原活化蛋白激酶(MAPK)等激酶,或激活c-Jun氨基末端激酶通路(JNK)和磷脂酰肌醇3激酶/蛋白激酶B通路(PI3K/Akt)等通路,而诱导软骨细胞凋亡,介导KOA的发病,并推动KOA的病理进程[3-6]。一系列研究已证实,针刀干预通过松解关节周围软组织,可帮助恢复膝关节力学平衡,且对软骨细胞有一定的保护作用[7-9]。本实验即在此基础上,测定氧化应激相关标志物及软骨细胞内DNA损伤标志物,观察针刀干预对KOA兔软骨细胞氧化应激的影响,进而探索针刀治疗异常生物力学相关的KOA的可能机制。
1 材料与方法
1.1 实验动物 选择28只健康清洁级6月龄雄性新西兰兔,体质量2.0~2.5 kg,购自北京富龙腾飞实验动物研究院有限公司(动物许可证号:SYXK京2018-0041)。动物均单笼饲养,室温(20±2)℃,湿度40%~70%,标准饮食。
1.2 试剂与仪器 一氧化氮合酶(NOS)测试盒、丙二醛(MDA)测试盒、总超氧化物歧化(SOD)酶测试盒、谷胱甘肽过氧化物酶(GSH-Px)测试盒(均购自江苏省南京市建成生物工程研究所);抗磷酸组蛋白H2AX抗体(05-636-1,购自 millipore);HRP酶标记抗小鼠二抗(GB23301,购自Servicebio);胃蛋白酶消化液、PBS缓冲液、组化试剂盒DAB显色剂、高速组织研磨仪、涡旋混合器、脱色摇床(均购自Servicebio);实验室超纯水机(AK-RO-C2型,艾肯水精灵);酶标检测仪(Epoch型,BioTeK);台式高速冷冻离心机、移液器(均购自Dragon);组化笔(购自Gene tech);显微镜(购自CIC);电子天平(ME203E/02型,上海梅特勒-托利多仪器有限公司);立式冷藏陈列柜(LSC-316C型,星星生物科技有限公司);卧式冷冻箱、-80℃冰箱(均购自中国中科美菱公司);4℃冰箱(日本SANYO公司)。
1.3 分组及造模 按照随机数字表法将28只兔随机分为空白组、模型组、电针组及针刀组,每组7只。造模方法选择Videman左后肢伸直位固定制动法,并经实际情况改良。造模前10~16 h停止喂食,使用3%戊巴比妥钠溶液以耳缘静脉注射方式麻醉,剂量按30 mg/kg确定,后固定动物,左后肢腹股沟至踝关节区域备皮,造模过程中使该肢膝关节伸直180°、踝关节背屈60°以保持完全伸直位,用65~85℃热水浸泡高分子绷带使其软化,从腹股沟到足踝缠于兔腿,重点固定膝踝关节,腹股沟处垫棉以防皮肤磨损,后以硬度适中的纸板、布条及防啃咬绷带进一步固定。留出足趾观察血供,每日检查固定情况,及时处理脱落及肿胀等问题,共制动6周。
1.4 干预方法 空白组常规饲养,不予其他处理。模型组造模之后同空白组,不予干预。电针组造模成功后选择左膝部血海、梁丘、犊鼻及外膝眼穴,取穴参照《实验针灸学》[10]结合动物比较法,上述穴位常规消毒后,以规格为0.2 mm×13 mm(环球牌,苏州针灸用品有限公司)的一次性无菌针灸针进行针刺治疗,后连接韩氏穴位神经刺激仪,分别连接血海与犊鼻,梁丘与外膝眼。波形疏密波,频率2/100 Hz,强度3 mA,治疗15 min,隔日1次,共治疗4周。针刀组造模成功后选择0.3 mm×30 mm的HZ系列一次性针刀(北京卓越华友医疗器械有限公司),以左下肢股内侧肌肌腱、股外侧肌肌腱、股直肌肌腱、股二头肌肌腱止点及条索结节点为进针部位,在上述部位以龙胆紫定位,常规备皮、消毒,针刀刃与肌腱或条索结节点所在肌肉肌腱走向平行,针刀体与皮肤垂直,按四部规程进针刀,后分别松解各肌腱与骨连接处,及向条索和结节的纵轴方向进行上下松解2~3次,出针后按压片刻。每周1次,治疗4周。
1.5 标本采集与检测 各组动物于治疗结束后,以过量麻醉方式处死,在无菌条件下以直径为8 mm的环钻垂直于关节软骨面,在左下肢胫骨平台内、外侧中央负重区截取软骨-软骨下骨复合体圆柱形组织块,钻取深度为10 mm,用于免疫组化检测;后快速刮取关节软骨面上的剩余软骨,予生理盐水冲洗后封存,以备试剂盒检测。1)将软骨组织制备成10%的匀浆液,离心后取上清,采用bicincininic acid法(BCA)法测定上清液中的蛋白浓度,采用试剂盒测定匀浆中NOS、MDA、SOD及GSH-Px活性,按照说明书步骤进行操作。2)用比色法测定NOS及GSH-PX活力,用硫代巴比妥酸(TBA)法测定MDA活力,用羟胺法测定SOD活力。测定特定波长下有色产物的吸光度值(OD值),可据相应公式计算出以上物质活力。3)用免疫组化法测定γ-H2AX表达情况。将经多聚甲醛固定及脱钙后的复合体新鲜组织制成切片以石蜡包埋,二甲苯及乙醇梯度脱水,胃蛋白酶消化液孵育修复抗原,磷酸缓冲盐溶液多次冲洗,3%过氧化氢阻断,血清封闭,一抗及二抗孵育,二氨基联苯胺显色,经苏木素复染,再次进行梯度脱水及透明过程,后用中性树胶封片。每张切片随机取4个视野(200倍),用显微成像系统拍片。图片分析借助Image-ProPlus6.0(IPP)图像分析系统,先测量每张图片的累积光密度值(IOD),后以IOD/区域面积方式计算其平均光密度值(AOD),以4个视野的平均AOD值代表该切片的AOD值,以评估实验兔软骨细胞内γ-H2AX的表达水平。
1.6 统计学处理 应用SPSS22.0统计软件进行数据处理。每组样本数据符合正态以()表示,予单因素方差分析进行组间比较,用LSD检验进行方差齐性的两两比较,用Games-Howell检验予方差不齐的两两比较。显著性差异取P<0.05,极显著性差异取P<0.01。
2 结果
2.1 各组兔膝软骨细胞NOS及MDA活力比较 见表1。结果表明,模型组软骨细胞NOS活力高于空白组(P<0.01);针刀组软骨细胞NOS活力低于模型组(P<0.05);电针组与模型组相比,差异无统计学意义(P>0.05);针刀组与电针组相比,差异无统计学意义(P>0.05)。模型组软骨细胞MDA活力高于空白组(P<0.01);针刀组软骨细胞 MDA活力低于模型组(P<0.05);电针组与模型组相比,差异无统计学意义(P>0.05);针刀组与电针组相比,差异无统计学意义(P>0.05)。
表1 各组兔膝软骨细胞NOS及MDA活力比较(±s)

表1 各组兔膝软骨细胞NOS及MDA活力比较(±s)
注:与空白组比较,*P<0.01;与模型组比较,△P<0.05。下同。
组别空白组模型组电针组针刀组n 7 7 7 7 NOS活力(U/mg)0.90±0.19 1.36±0.38*1.09±0.24 0.99±0.13△MDA活力(nmoL/mg)3.73±0.87 6.09±1.43*5.08±1.24 4.69±1.09△
2.2 各组兔膝软骨细胞SOD及GSH-Px活性比较见表2。结果表明,模型组软骨细胞SOD活力低于空白组(P<0.01);针刀组及电针组软骨细胞SOD活力均高于模型组(P<0.05);针刀组与电针组相比,无明显差异(P>0.05)。模型组软骨细胞GSH-Px活力低于空白组(P<0.01);针刀组及电针组软骨细胞GSH-Px活力与模型组相比,均无明显差异(P>0.05);针刀组与电针组相比,无明显差异(P>0.05)。
表2 各组兔膝软骨细胞SOD及GSH-Px活性比较(U/mg,±s)

表2 各组兔膝软骨细胞SOD及GSH-Px活性比较(U/mg,±s)
组别空白组模型组电针组针刀组n 7 7 7 7 SOD活力22.98±6.54 14.29±4.19*21.06±1.80△20.33±4.43△GSH-Px活力37.09±9.66 24.29±8.74*27.26±5.35 28.22±5.75
2.3 各组兔膝软骨细胞γ-H2AX的表达水平比较见图1。光镜下观察结果,空白组软骨表面完整,软骨细胞未见明显γ-H2AX表达;模型组可见表层软骨撕脱,软骨细胞γ-H2AX表达较密;针刀组及电针组较模型组软骨损伤程度轻,可见少量软骨细胞γ-H2AX表达。各组γ-H2AX的AOD值比较见表3。其中,模型组软骨细胞γ-H2AX表达强于空白组(P<0.01);针刀组及电针组软骨细胞γ-H2AX表达均弱于模型组(P<0.05);针刀组与电针组相比,差异无统计学意义(P>0.05)。
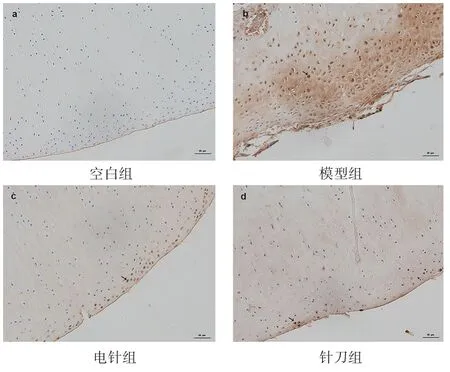
图1 各组兔膝软骨细胞γ-H2AX表达(200倍)
表3 各组兔膝软骨细胞γ-H2AX的表达水平比较(U/mg,±s)

表3 各组兔膝软骨细胞γ-H2AX的表达水平比较(U/mg,±s)
组别空白组模型组电针组针刀组n 7 7 7 7 AOD 2.27±1.85 24.17±4.15*10.06±0.90△12.22±2.15△
3 讨论
KOA在中医属学“痹证”范畴,受异常应力影响的KOA往往存在膝关节内部组织间解剖位置的改变,在中医可以用“筋骨失衡”来概括这一变化,即以关节周围肌肉、韧带等软组织为代表的“筋”和以软骨、骨为代表的“骨”之间产生位置的异常变动及由此引发的一系列失衡状态。《素问·调经论》[11]载“病在筋,调之筋;病在骨,调之骨”,强调了筋骨疾病治疗过程中对病位的看重。膝痹的筋骨失衡中,异常应力多直接作用于膝关节周围软组织,故需选择对软组织病变针对性强的疗法。针刀作为一种软组织松解术,可通过对膝关节周围的“筋”进行切开、牵拉及机械刺激,调整“筋”与“骨”的异常位置关系,故适合治疗异常机械应力诱发的KOA[12]。本课题组前期已从对膝周伸屈肌群生物力学的调整、肌肉萎缩的延缓及韧带功能的恢复等方面证实针刀对膝周软组织异常生物力学的调节作用[7-9]。
异常生物力学与软骨细胞的氧化应激关联紧密。一方面,软骨细胞是软骨的唯一细胞,对机械负荷较敏感。研究表明,异常机械载荷作用于关节软骨,经细胞外基质、细胞周基质及Ⅵ型胶原、跨细胞膜表面受体等的传输和调节,可完成力学信号与电信号间的转化,诱导软骨细胞线粒体扭曲变形,产生并释放ROS[13-14]。过量的ROS可造成mtDNA的脂质过氧化,加速软骨退变[3]。另一方面,机械负荷可提高与超氧化物歧化酶2(SOD2)下调相关的细胞水平,引起SOD2下调,这一现象尤其体现于OA软骨中,而SOD2是线粒体中唯一存在的SOD同种型[2,15]。
氧化应激的本质是氧化水平和抗氧化水平的失衡,故以ROS的异常增多及抗氧化物的持续下调为主要表现,并伴随氧化产物的产生[16]。NO是软骨细胞中ROS的主要类型,主要由NOS调节生成,在NOS催化下易与超氧化物(O2)结合形成过氧亚硝酸盐,该物质通过损害蛋白质及mtDNA而破坏软骨细胞[17]。MDA为脂质过氧化产物,是氧化应激过程中氧自由基攻击生物膜上的不饱和脂肪酸形成的,其升高常被视为细胞损伤的重要标志[18-20]。SOD及GSH-Px为细胞中存在的抗氧化酶,二者均可通过对氧化物及氧化产物加以转化,维护细胞内的氧化还原平衡[15,21]。其中SOD偏重于清除氧自由基,GSH-Px擅长抑制脂质过氧化[18-19]。
本研究表明,造模后各组兔软骨细胞与正常兔相比,NOS及MDA活力均升高,SOD及GSH-Px活力均下降。证明了异常生物力学可造成KOA兔软骨细胞的氧化应激。软骨细胞氧化应激既是KOA发病和进展的关键因素,又可能成为KOA治疗的新靶点[17]。已有多项研究证实,中药、艾灸等疗法可通过其抗氧化作用治疗KOA[22-24]。本实验结果显示,针刀干预可降低KOA兔膝软骨细胞的NOS及MDA活力,升高SOD活力。提示我们:针刀干预可能基于其对膝周软组织异常生物力学的调整作用,进而影响氧化物合成酶及抗氧化防御酶,发挥抗氧化效应。
另外,氧化应激可直接造成软骨细胞内DNA的损伤,主要表现为DNA双链断裂(DSBs),DSBs可使组蛋白H2AX的139位丝氨酸磷酸化为γ-H2AX,故γ-H2AX被视为DNA损伤的直接指标[25-26]。本实验中,模型组兔膝软骨细胞内γ-H2AX表达较空白组明显增多,针刀组较模型组表达下降,提示针刀干预可能通过抗氧化作用减少软骨细胞内DNA的损伤,从而保护软骨细胞,延缓KOA的病理进展。
值得一提的是,机械力学等刺激可激活MAPKs,通过其内部信号转导通路促进软骨细胞中的诱导性一氧化氮合酶(iNOS)和基质金属蛋白酶(MMPs)的表达,且iNOS本身即可促进MMPs增加而加速KOA中的软骨降解[27-28]。有研究显示,针刀干预可抑制MMP-3及MMP-13的基因和蛋白表达[29]。故本实验中针刀对KOA兔软骨细胞NOS活力的下调作用,可能同样是通过抑制MAPKs来实现,有待进一步研究。针刀及电针干预对软骨细胞GSH-Px活力的影响虽无统计学差异,但有上升趋势,考虑可能与治疗时间较短有关。本实验不足之处还在于样本量较少,且缺乏干预过程中更多时间点上的指标检测,将在之后研究中进一步完善。
