Bi2MoO6修饰TiO2复合纳米棒阵列光催化剂的制备及其光催化性能
2022-11-01周小桔胡正龙任一鸣谢兰东
周小桔,胡正龙,任一鸣,谢兰东
(湖北科技学院 电子与信息工程学院,湖北 咸宁 437100)
随着污染问题日益突出,高效利用太阳光降解印染废水中的污染物成为人们研究的热点。二氧化钛(TiO2)电子迁移率高、抗光腐蚀性强、成本和毒性低,是一种广受关注的光催化剂[1-2],但TiO2禁带宽度(3.0~3.2 eV)较宽,导致太阳能利用率低,并且光生载流子复合率高[3]。为此,研究人员采取一系列方法,如染料敏化、离子掺杂以及与其他金属及其氧化物形成异质结,以提高太阳能利用率和实现光生电子空穴的高效分离[4-6]。通过窄带隙材料修饰TiO2,并考虑能带匹配,由此制备的异质结已展现出拓展的光谱响应范围和光生电子空穴的有效分离[7-8]。钼酸铋(Bi2MoO6)带隙窄,毒性低,具有可见光驱动的光催化活性[9-10]。研究表明,Bi2MoO6与TiO2构筑异质结可获得增强的光催化性能[11-13]。
众所周知,由于电化学反应通常在半导体表面发生[14],因此增大比表面积能提升电化学性能。一维纳米结构,如纳米管、纳米线、纳米棒和纳米带,由于其长径比大、化学稳定性好且几何形态独特,有利于电荷传输转移。一方面,一维纳米结构的径向为空穴扩散和传输提供了较短的路径;同时,其轴向是电子转移和物质吸附的首选通道[8]。研究表明,与随机分布的纳米结构和块体不同,规则排列的一维纳米结构阵列具有优越的光催化特性[15-17]。将助催化剂Bi2MoO6纳米片嵌入高比表面积的一维TiO2中是一种比较好的优化光催化性能的解决方法。已有研究表明,Bi2MoO6与TiO2纳米带或纳米管形成异质结获得了增强的光催化活性[18-19]。然而,Bi2MoO6与TiO2纳米棒阵列 type Ⅱ型异质结构筑及其光催化染料降解性能和机制还有待深入研究。
本文采用水热/溶剂热二步法在生长有TiO2纳米棒阵列的掺杂F的SiO2导电玻璃(FTO)衬底上沉积Bi2MoO6纳米片,合成Bi2MoO6/TiO2纳米棒阵列可见光催化剂,分析其结构、形貌、光学性能、光电化学性能、光催化性能和光催化性能提升机制。
1 实验部分
1.1 实验试剂
盐酸(HCl)、钛酸四丁酯(Ti(OC4H9)4)、五水硝酸铋(Bi(NO3)3·5H2O)和钼酸钠(Na2MoO4·2H2O),均为分析纯,天津国药集团化学试剂有限公司。掺杂F的SiO2导电玻璃(FTO),合肥科晶材料科技有限公司。去离子(DI)水,实验室使用净水系统RC-K2(中国北京瑞成科技有限公司)制备。
1.2 材料的制备
1.2.1 TiO2纳米棒阵列的制备
采用水热法在FTO上制备TiO2纳米棒阵列。首先,按体积比1∶1配制盐酸(质量分数为36.0%~38.0%)和去离子水的混合溶液,加入适量 Ti(OC4H9)4(质量分数为98.0%),将上述溶液移入水热反应釜(内置50 mL聚四氟乙烯内胆)。接下来,将FTO衬底切成1 cm×1 cm正方形,并依次用去离子水、丙酮和乙醇进行超声波清洗。然后,将清洗后的FTO衬底放入含有混合溶液的高压釜中,并在 170 ℃ 保温6 h。
采用溶剂热法制备Bi2MoO6/TiO2异质结构[20-21],具体过程如下:首先,将0.004 8 mol/L Bi(NO3)3·5H2O(99.0%)和Na2MoO4·2H2O(99.0%)按量比为2∶1在匀速搅拌下溶解于乙二醇(EG,99.5%)和乙醇的混合溶液(体积比为1∶1)中;然后,将充分溶解的溶液倒入衬以50 mL聚四氟乙烯的不锈钢高压釜,同时将生长有TiO2纳米棒阵列的FTO基底放入反应釜;最后,在160 ℃的烘箱中保温14 h,将制备的样品用去离子水清洗干净并烘干。为便于研究,在同样条件下制备了纯Bi2MoO6。
1.3 测试与表征
采用D8 Advance X射线衍射仪(XRD,德国Bruker公司)分析产物的物相,用Cu Kα作为X射线源。采用JSM-7100F(日本日立公司)场发射扫描电子显微镜(FE-SEM)表征样品形貌。采用透射电子显微镜(TEM,美国FEI公司)和高分辨透射电子显微镜(HRTEM)分析产物的微结构。采用ESCALAB 250 型X射线光电子能谱仪(中国 Thermo Scientific公司)分析元素价态,用 Al Kα作为X射线源。采用岛津 UV 2600 分光光度计(中国Shimaclzu公司)分析紫外-可见(UV-Vis)吸收光谱。在氮气吸附仪ASAP 2020中孔/微孔分析仪(美国Micromeritics Instruments公司)上记录氮气的吸附/脱附等温曲线以表征样品的比表面积和孔体积。采用FluoTime-300分光光度计(德国Pico Quant公司,激发光波长为325 nm)测量室温光致发光(PL)发射光谱。
1.4 光电化学(PEC)性能测试
使用CHI660E电化学工作站(中国上海辰华)测试光电化学性能,测试时采用三电极体系,铂片为对电极,Ag/AgCl为参比电极,0.5 mol/L Na2SO4溶液为电解液。工作电极的有效面积为1 cm2。光电化学测试包括:线性扫描伏安曲线(J-V),扫描范围为-1~1.3 V;光电流响应曲线(I-t);电化学阻抗谱(EIS),扫描频率10 Hz~1 MHz,交流电压振幅 5 mV;莫特-肖特基曲线,测试频率1 000 Hz。测试中所用光源为300 W的氙灯(AM(大气质量)1.5 G,光能量密度为100 mW/cm2)。
光转换效率η由下式[22]计算:
式中:J为光电流密度,mA/cm2;V为外加偏压(vs NHE),V;Plight为入射光能量密度,mW/cm2。
1.5 光催化性能测试
以亚甲基蓝和甲基橙作为目标污染物,通过光催化降解效果来考察Bi2MoO6/TiO2复合材料的光催化活性。量取 50 mL浓度为1.0×10-5mol/L 的亚甲基蓝(或甲基橙)溶液于石英烧杯中,将生长在FTO衬底上的Bi2MoO6/TiO2光催化剂置于降解溶液中。首先在黑暗条件下搅拌 30 min,使光催化剂达到吸附-脱附平衡,然后在模拟太阳光(300 W 的氙灯,AM 1.5 G)照射下进行光催化降解实验,每隔 20 min 取 1 次样,然后用紫外-可见分光光度计在亚甲基蓝最大吸收波长 554 nm(甲基橙为460 nm)处测量其吸光。降解前后吸光度的比值即表示污染物亚甲基蓝的初始与t时的浓度比C/C0,并通过C/C0表示降解效果。
为方便比较,也做了暗反应降解实验及空白样品(不含任何催化剂)、TiO2纳米棒阵列光催化降解实验。
伴随着信息技术的迅猛发展,学生获取信息的途径变得多样化.教师在进行相关课题教学时,科学选择社会热点,激发学生生物探究热情.譬如:在进行基因相关教学时,教师可向学生宣讲基因方面的热点,例如:第二次世界大战末期,由于美国在日本广岛、长崎投放原子弹,致使日本本土出现大量的癌症、白血病患者;转基因食品是否安全等热题.教师通过科学的选择热题,引导学生进行思考,能够有效的激发学生探究热情,从而实现生物教学质量的有效提升.
使用E500电子自旋(顺磁)共振波谱仪(ESR)(德国布鲁克公司)对光催化过程中的活性物质进行分析,选择5,5-二甲基-1-吡咯烷氮氧化物(DMPO)作为自由基捕获剂。
2 结果和讨论
2.1 晶体结构分析
图1示出Bi2MoO6、TiO2/FTO和Bi2MoO6/TiO2的XRD图。从Bi2MoO6/TiO2的XRD图可见,位于36.2°、54.3°和62.8°处的衍射峰分别对应于金红石TiO2的(101)、(211)和(002)晶面(PDF卡 21-1276),推断TiO2为金红石型。Bi2MoO6/TiO2复合光催化剂的XRD图谱包含Bi2MoO6、TiO2和FTO的衍射峰,对比PDF卡71-2086发现,位于28.2°、32.5°、46.7°、55.5°处的衍射峰对应斜方晶系Bi2MoO6的(131)、(200)/(002)、(202)和(133)晶面。

图1 TiO2/FTO、Bi2MoO6和Bi2MoO6/TiO2的XRD图
2.2 形貌与比表面积分析
图2(a)示出TiO2的SEM照片。可清晰观察到TiO2纳米棒尺寸一致,直径约为200 nm,均匀垂直排列在FTO衬底上。图2(b)示出纯Bi2MoO6的SEM照片。可看到Bi2MoO6呈现不规则的片状,交错形成直径约为1 μm的微球,微球堆叠在一起。从图2(c)可知,Bi2MoO6纳米片微球均匀分布在TiO2纳米棒阵列上,微球直径只有纯Bi2MoO6的一半,这是由于Bi2MoO6前驱体浓度比较低的缘故。此外,微球分散良好,应该具有比较大的比表面积,这有利于光生载流子向半导体表面的转移,复合结构有望获得相对优良的光催化性能。

图2 TiO2、Bi2MoO6和Bi2MoO6/TiO2光催化剂的SEM照片
一般来说,由于表面活性位点的存在,光催化活性受到光催化剂比表面积和孔体积的显著影响[21]。图3(a)示出TiO2、Bi2MoO6和Bi2MoO6/TiO2复合材料的N2吸附-脱附等温线及孔容积。根据BDDT(Brunauer-Deming-Deming-Teller)分类,三者的等温线均为 Ⅳ型,相对压力较高时呈现滞后环,表明存在2~50 nm 的中孔。经计算得Bi2MoO6/TiO2的比表面积和孔容积分别为88.2和0.18 cm3/g,大于纯TiO2的64.0和0.17 cm3/g,也大于纯Bi2MoO6的26.0和0.05 cm3/g。对照研究发现,Bi2MoO6/TiO2异质结构中Bi2MoO6纳米片微球分散良好,而纯的Bi2MoO6纳米片微球团聚严重导致比表面积变小,纯TiO2纳米棒分散生长在衬底上。综上, Bi2MoO6纳米片微球分散生长在TiO2纳米棒阵列上形成异质结构,有利于发挥各自孔结构的优势,从而增强对光的捕获,有利于光催化活性的提高。

图3 TiO2、Bi2MoO6和Bi2MoO6/TiO2复合材料的N2吸附-脱附等温线和孔容积
2.3 表面形貌分析
图4(a)示出TiO2纳米棒的TEM照片。可看出纳米棒直径约为200 nm。图4(b)示出Bi2MoO6的TEM照片。可看出Bi2MoO6为片状,尺寸约为250 nm,纳米片聚集成微球,直径约为500 nm,与SEM照片结果一致。图4(c)示出Bi2MoO6/TiO2的TEM照片。图中显示纳米棒与纳米片共存。图4(d)示出Bi2MoO6/TiO2光催化剂的高分辨透射电镜照片。通过高分辨电子显微镜(HRTEM)照片可清晰观察到2组不同晶面间距的条纹,其中 0.29 nm 的晶格条纹对应于金红石型TiO2的(211)面,而0.18 nm的晶格条纹归属于Bi2MoO6的(200)面。从HRTEM照片发现,Bi2MoO6纳米片沉积在TiO2纳米棒上,二者构筑异质结,有益于光生载流子分离。

图4 TiO2、Bi2MoO6和Bi2MoO6/TiO2的TEM和HRTEM照片
2.4 元素分析
图5示出Bi2MoO6/TiO2异质结构的XPS图。由Bi2MoO6/TiO2的XPS全谱图(见图5(a))可知,光催化剂包含Bi、Mo、Ti、O这4种元素,其中 C元素是测试时碳污染所引入。Bi4f谱图显示出158.0和163.3 eV处的2个峰(见图5(b)),分别归属于Bi4f7/2和Bi4f5/2的自旋轨道分裂峰[23],表明Bi离子为正3价。在Mo3d 谱图中观察到232.3和235.5 eV 处的2个强峰分别对应于正6价Mo离子的Mo3d5/2和Mo3d3/2[24](见图5(c))。457.5和 463.2 eV 处的峰值分别与Ti2p3/2和Ti2p1/2态的结合能相匹配(见图5(d)),表明Ti为正4价。O1S谱图中显示3个峰,位于528.9、529.4和531.1 eV处(见图5(e)),分别对应于Bi—O、Mo—O和Ti—O键[12,23]。上述分析表明合成产物包含Bi2MoO6和TiO2这2种物质。

图5 Bi2MoO6/TiO2光催化剂的XPS图谱
2.5 光学性能分析
图6示出TiO2、Bi2MoO6、Bi2MoO6/TiO2光催化剂的紫外-可见吸收光谱。可看出,TiO2纳米棒阵列在400 nm的紫外区有一个大的吸收带,这是TiO2的本征吸收引起[25](见图6(a))。Bi2MoO6的吸收强度相对要低,截止波长为500 nm。相对于TiO2,Bi2MoO6/TiO2复合材料的吸收边出现了一定程度的红移,表明Bi2MoO6修饰TiO2能将光谱响应范围拓展到可见光区,从而增强光电化学性能。根据Kubelka-Munk函数计算TiO2、Bi2MoO6和Bi2MoO6/TiO2异质结的带隙,画出(αhν)2与光子能量的关系曲线,其中:α为吸收系数,h为普朗克常数,ν为光子频率。由图6(b)可知,TiO2、Bi2MoO6、Bi2MoO6/TiO2复合材料的带隙分别为3.1、2.77和2.81 eV。结果表明,Bi2MoO6修饰TiO2纳米棒阵列后,光谱响应范围拓宽至可见光区,这有益于增强光催化性能。

图6 TiO2、Bi2MoO6和Bi2MoO6/TiO2的紫外-可见光吸收光谱及带隙图
光致发光(PL)光谱已被广泛用于揭示复合半导体材料中光生电子-空穴的分离效率[26],光发射峰强度越低则光生载流子分离效率越高,光电化学性能越好。由图7所示TiO2、Bi2MoO6和Bi2MoO6/TiO2的光致发光光谱可知,纯TiO2有位于420和470 nm附近的光发射峰,这归于带隙跃迁的电子空穴辐射复合[19]。Bi2MoO6纳米片也展示了 2个强的光发射峰,这可能是Bi2MoO6的本征光发射[19]。在Bi2MoO6/TiO2复合结构中观察到了远低于纯TiO2和Bi2MoO6发光强度的光发射峰,这是由于Bi2MoO6与TiO2形成异质结构有利于光生电子空穴的分离,降低了载流子的复合效率。

图7 TiO2、Bi2MoO6和Bi2MoO6/TiO2的光致发光光谱
2.6 光电化学性能分析
图8(a)示出Bi2MoO6/TiO2异质结构、TiO2纳米棒阵列和Bi2MoO6纳米片的J-V曲线。在模拟太阳光照射下,样品光电流密度随外加电压的增加而增强,表明外加电场能有效地抑制光生电子和空穴的复合。Bi2MoO6/TiO2异质结构的光电流密度与纯TiO2纳米棒阵列和Bi2MoO6纳米片相比均有较大提高,Bi2MoO6修饰TiO2后,在1.23 V(相对于标准氢电极(vs NHE))电势下,其最大光电流密度是TiO2的18倍,即从0.143 mA/cm2提高到 2.589 mA/cm2,是Bi2MoO6(0.546 mA/cm2)的 4.7倍。从图8(a)的插图可知,当光电流为零时,TiO2、Bi2MoO6、Bi2MoO6/TiO2的开路电压分别为-0.48、-0.54、-0.67 V,依次发生负移,表明异质结构具有更好地分离光生电子和空穴的能力[27];当电压为零时,Bi2MoO6/TiO2异质结比TiO2和Bi2MoO6的光电流密度要大,为0.032 2 mA/cm2。该实验表明,Bi2MoO6修饰TiO2形成异质结构有助于增加光生电子空穴浓度,有益于光生载流子的分离和转移,从而提高光催化性能。

图8 TiO2、Bi2MoO6和Bi2MoO6/TiO2的J-V曲线及光电转换效率
图8(b)为不同偏压下Bi2MoO6/TiO2异质结构、TiO2纳米棒阵列和Bi2MoO6纳米片的光电转换效率图。纯TiO2纳米棒阵列在0.93 V时的最大转换效率仅为0.019 3%,而Bi2MoO6/TiO2异质结构在0.98V时的最大转换效率达到了0.287%,是TiO2的14.7倍。光电转换效率的大幅提高,一方面是TiO2纳米棒阵列上修饰Bi2MoO6,拓宽了光谱响应范围,增强了对太阳光的吸收;另一方面Bi2MoO6/TiO2异质结的形成促进了光生电子空穴的分离和转移,减少了载流子的复合,最终促进光电化学性能的提高。
图9(a)示出光电流响应(I-t)曲线。以40 s为1个周期,20 s光照和20 s黑暗环境测试,所有样品展现了良好的光电流响应。由图可知,Bi2MoO6/TiO2异质结构的光电流大于TiO2和Bi2MoO6,约是TiO2的5倍,是Bi2MoO6的3倍。TiO2、Bi2MoO6、Bi2MoO6/TiO2异质结构的光电流响应依次增大,这与J-V曲线和光电转换效率的结果相一致,表明构筑异质结能提升光电化学性能。接下来,利用电化学阻抗谱(EIS)进一步研究界面电荷的分离和收集效率。已经证实,高频区半圆半径越大电荷转移效率越低[28-29]。图9(b)示出电化学阻抗谱。图中横坐标Z′表示阻抗的实部,纵坐标Z″表示阻抗的虚部。可看出,TiO2、Bi2MoO6、Bi2MoO6/TiO2的半圆半径依次减小,这些数据证实了复合材料Bi2MoO6/TiO2异质结较低的界面电荷转移电阻和快速的电荷转移过程,这是由于Bi2MoO6与TiO2的界面相互作用提高了Bi2MoO6/TiO2异质结中光生电子-空穴对的分离和转移效率。
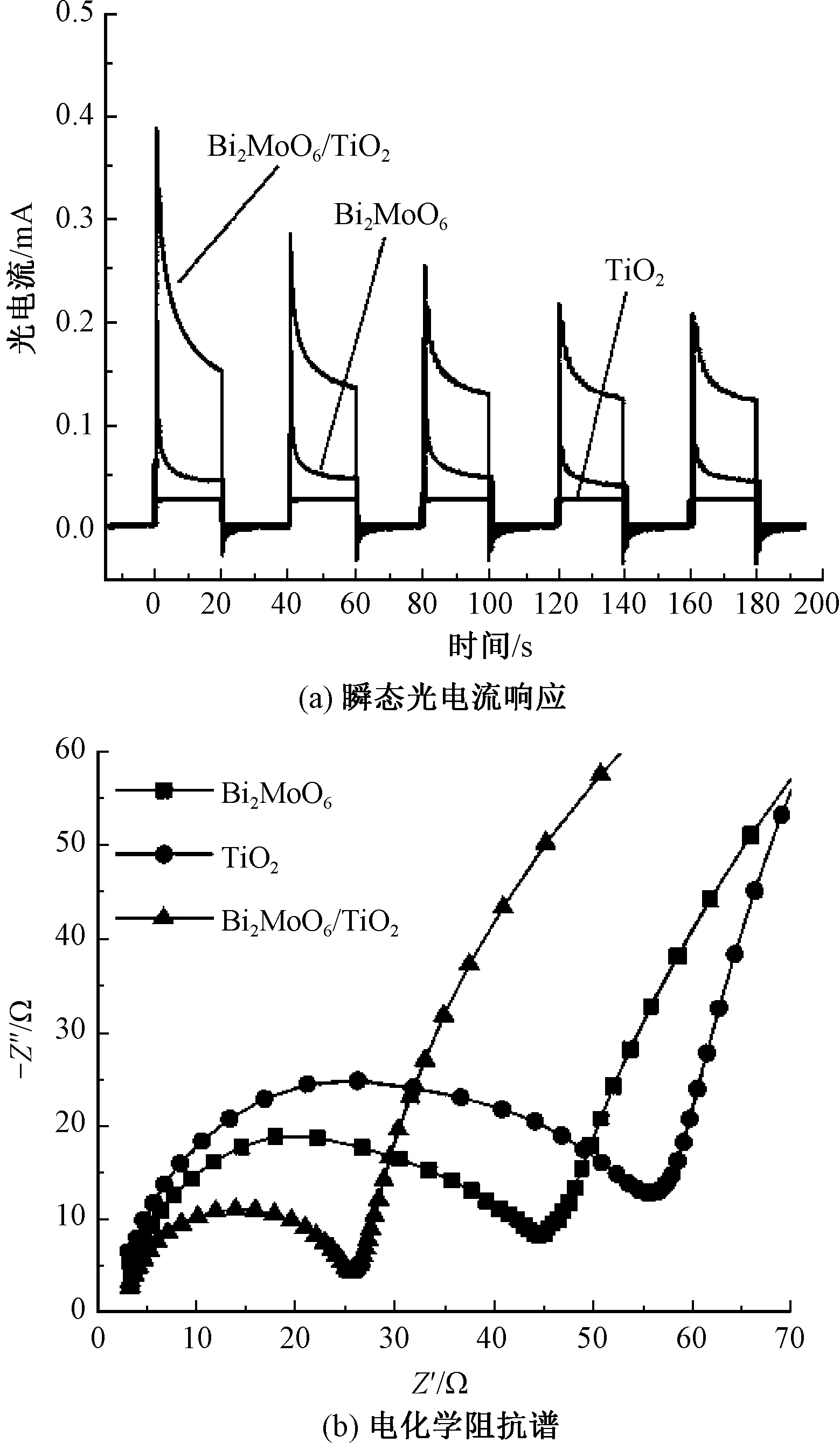
图9 TiO2、Bi2MoO6和Bi2MoO6/TiO2异质结的瞬态光电流响应和电化学阻抗谱
图10示出TiO2和Bi2MoO6的莫特-肖特基曲线。对最长直线部分做切线,斜率都为正,表明TiO2和Bi2MoO6都是n型半导体。平带电位可通过莫特-肖特基方程[25]计算:

图10 TiO2和Bi2MoO6莫特-肖特基曲线
式中:C为与电解液界面处的电容,F;Nd为载流子浓度;e为电子电荷;ε为介电常数;ε0为真空介电常数;V和Vfb分别为外加电压和平带电位,V;k为玻尔兹曼常数;T为温度[30],K。以1/C2为纵坐标,V为横坐标,截距为Vfb+KT/e,算出TiO2和Bi2MoO6的平带电位分别为-0.35 V和-0.58 V(vs NHE)。
2.7 光催化性能分析
以时间t为横坐标,亚甲基蓝降解后和降解前的浓度比C/C0为纵坐标作图,光催化降解效果如图11所示。
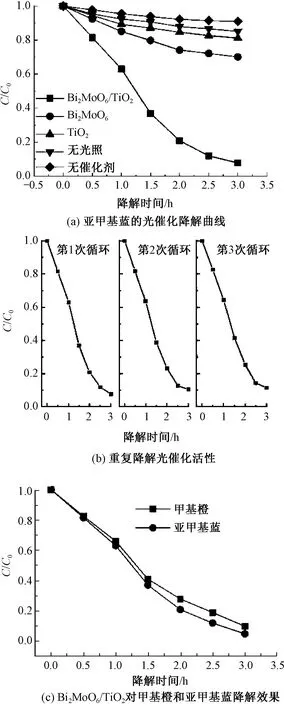
图11 Bi2MoO6/TiO2异质结构的光催化降解曲线
由图11(a)可看出,在没有光催化剂或者无光照时,亚甲基蓝溶液几乎没有降解。Bi2MoO6/TiO2复合材料比TiO2降解污染物效果要好得多,光照 3 h 后 Bi2MoO6/TiO2的降解率达到95%。Bi2MoO6修饰TiO2纳米棒后光催化性能提高,这是因为Bi2MoO6能吸收可见光导致光生电子空穴浓度增大,同时TiO2产生空穴向Bi2MoO6转移,而光激发Bi2MoO6产生的电子向TiO2转移,提高了光生载流子的分离效率。从实际应用角度来看,评价所制备催化剂的稳定性是非常重要的。如图11(b)所示,通过Bi2MoO6/TiO2异质结构重复3次光催化降解过程发现,3种降解曲线在每个运行周期内呈现出相似的趋势,这表明Bi2MoO6/TiO2光催化剂具有较高且稳定的降解活性。图11(c)显示,Bi2MoO6/TiO2光催化剂对甲基橙同样具有较好的降解效果,光照3 h候降解率达到90.2%,这表明Bi2MoO6/TiO2光催化剂对印染废水中的有机污染物具有较好的光催化降解能力。
为了研究光氧化能力的机制,电子自旋共振谱(ESR)技术被用于检测活性自由基。将光催化剂Bi2MoO6/TiO2分散在DMPO溶液中,测得ESR信号,如图12所示。

图12 Bi2MoO6/TiO2光催化剂的ESR谱
无光照时没有发现明显的ESR信号,然而,可见光照后观察到1组4个特征峰,其强度比为1∶2∶2∶1(见图12(a)),表明催化过程中产生了羟基自由基(·OH)。同样,超氧自由基(·O2-)探测中,无光照时没有明显信号,可见光照时在ESR光谱出现6个峰(见图12(b)),表明材料表面·O2-的形成。这些结果表明·O2-和·OH都是活性物种,其协同效应显著促进了亚甲基蓝的光催化降解。
2.8 光催化机制分析
上述分析证实了Bi2MoO6修饰TiO2后的有效界面电荷转移,为了解Bi2MoO6/TiO2异质结构光催化机制,研究了其能带排列。结合平带电位(见图10)和带隙值(见图6(b)),计算得TiO2和Bi2MoO6的导带电位(ECB)和价带电位(EVB)分别为-0.35、2.75、-0.58和2.19 V(vs NHE)[31-32]。基于这些结果,建立了Bi2MoO6/TiO2的能带结构图,如图13所示。

注:CB和VB分别表示导带和价带;Eg为禁带宽度。

3 结 论
1)通过在TiO2纳米棒阵列上修饰Bi2MoO6纳米片,采用简单的水热/溶剂热二步法合成了方便回收利用的Bi2MoO6/TiO2纳米棒阵列复合光催化剂。
2)与纯Bi2MoO6相比,Bi2MoO6/TiO2复合光催化剂的比表面积和孔容积都有显著增加。Bi2MoO6/TiO2复合光催化剂拓宽了光谱响应范围,抑制了光生电子空穴的复合,提高了载流子转移效率,对亚甲基蓝和甲基橙降解具有更高的光催化活性,3 h降解率分别达到95%和90.2%。
3)TiO2和Bi2MoO6之间形成type Ⅱ型异质结,有利于光生载流子的分离和转移。Bi2MoO6/TiO2的type Ⅱ型能带结构与可见光的扩展吸收之间的协同作用是光催化性能提升的内在机制。h+,·O2-, 和·OH自由基被证实是降解亚甲基蓝染料分子的活性物种。
