不同种质茶叶籽皂素含量及组成分析
2022-10-31陈宇宏高颖韩震尹军峰
陈宇宏,高颖,韩震,尹军峰
不同种质茶叶籽皂素含量及组成分析
陈宇宏1,2,高颖1*,韩震3,尹军峰1*
1. 中国农业科学院茶叶研究所,浙江 杭州 310008;2. 中国农业科学院研究生院,北京 100081;3. 宁波市农业技术推广总站,浙江 宁波 315012
茶皂素是一类在山茶科植物种子中含量丰富且具有特异生物活性的化合物,但不同种质茶叶籽中皂素含量及组成尚不清晰。以浙江省同一地区采集的21个茶树品种(系)的茶叶籽为试验材料,对茶叶籽的基本特征、皂素含量及组成进行测定和分析。结果表明,不同品种(系)的茶叶籽的百粒质量、壳仁比、皂素含量均有显著性差异(<0.05)。紫外分光光度法和高效液相色谱法(HPLC)测得21个茶树品种(系)的茶叶籽的皂素含量范围分别为30.82%~48.16%和16.93%~31.82%,其中黄观音的茶叶籽皂素含量最高。利用高效液相色谱-四极杆-静电轨道阱质谱(UHPLC-Q-Exactive/MS)同时检测出68种茶叶籽皂素单体,其中Theasaponin E1的峰相对强度最大。正交偏最小二乘法判别分析(OPLS-DA)显示,21个品种(系)的茶叶籽以树型为依据被明显地划分为2组,组间差异单体物质有21种。结合相关性分析,高积累的Theasaponin E12、Camelliasaponin B1/B2、Theasaponin A5/A6、Camelliasaponin C1/C2和Assamsaponin G可能是灌木型种质资源有别于小乔木型、乔木型种质资源的重要特征物质。研究结果为生产茶叶籽皂素原料的选择和高值化利用奠定了基础。
茶叶籽;皂素;单体;超高效液相色谱-高分辨质谱
我国茶园面积2021年达326.5万hm2,茶叶籽资源非常丰富。长期以来,由于对不同遗传背景下茶叶籽中皂素的种类及组成认识不足等原因,导致茶叶籽这一茶叶生产副产品未得到合理的综合利用,造成了资源浪费和利益损失。茶皂素是茶叶籽中含量较高的化合物,占山茶科种子干重的10%~16%[1]。茶皂素具有优良的表面活性,可广泛应用于日化、洗护和建材等行业;还具有抗渗消炎、抑菌抗病毒、降血压血脂、保护肠胃等生理功能[2-7],在医药和化妆品行业应用潜力巨大[8]。
茶皂素的基本结构由皂苷元、糖体和有机酸3部分组成。皂苷元以齐墩果烷为骨架,有7种类型,均属于-香树素(-amyrin)衍生物;糖体主要有葡萄糖、木糖、阿拉伯糖和半乳糖,常与皂苷元C3位上的羟基以糖苷键形式相连;有机酸主要有当归酸、醋酸、惕格酸和肉桂酸,常与皂苷元C16、C21、C22、C28位上的羟基以酯键形式相连。依据糖体和有机酸不同以及皂苷元的结合位点不同,现已在山茶属植物种子中分离鉴定出77种茶皂素[9]。
近年来,随着检测技术的不断发展,Wu等[10]通过超高效液相色谱串联四极杆飞行时间质谱(UPLC-Q-TOF/MS/MS)对福鼎大白茶茶叶籽中的51种皂素进行了定性定量分析;Chen等[11]研究发现,新鲜成熟种子中的皂素含量最高达到19%,并随着种子成熟度上升而下降;且不同结构的皂素具有不同的生物活性。然而,不同茶树种质间的茶叶籽皂素含量及单体组成的差异尚不清楚。
为了解不同种质茶叶籽间皂素的含量及组成差异情况,提高茶叶籽的利用率和附加值,本研究利用超高效液相色谱-四极杆-静电轨道阱质谱(Ultra-high performance liquid chromatography-quadrupole orbitrap mass spectrometry,UHPLC-Q-Exactive/MS)等分析检测手段,对21份茶树种质资源的茶叶籽中的皂素组分及含量进行检测和分析,旨在为茶叶籽皂素的进一步开发利用提供理论依据和技术支撑。
1 材料与方法
1.1 试验材料
供试材料来源于中国农业科学院茶叶研究所种质资源圃(120°5′26″E,30°10′52″N),于2021年11月采摘,经烘干、人工剥壳、籽仁粉碎过20目筛等步骤,保存于–20℃冰箱备用,样品信息见表1。

表1 供试样品相关信息
1.2 仪器与试剂
主要试剂:茶皂素(纯度>98%)购自上海源叶生物科技有限公司;香草醛购自上海阿拉丁生化科技股份有限公司;正己烷、浓硫酸、无水乙醇均为分析纯,购自国药集团化学试剂有限公司;甲醇、乙腈、乙酸均为色谱纯,购自上海麦克林生化科技有限公司;纯净水购自杭州娃哈哈集团有限公司。
主要仪器:DK-S26型电热恒温水浴锅,上海精宏实验设备有限公司;UV3600紫外-可见分光光度计、LC-20A高效液相色谱仪,日本岛津公司;UHPLC-Q-Exactive/MS,美国Thermo Fisher公司;810R型离心机,美国Eppendorf公司;XQ100型粉碎机,上海广沙工贸有限公司;MA35M-000230V1型水分测定仪,德国赛多利斯公司。
1.3 试验方法
1.3.1 茶叶籽基本特征数据测定
百粒质量测定:茶叶籽经人工剥果壳后,在50℃下烘干至恒重。筛除烂籽和杂质,每个品种(系)随机抽取100粒茶叶籽进行称重。
壳仁比测定:将测定百粒质量后的茶叶籽进行剥壳,对籽仁和籽壳称重,计算壳仁比。
籽仁含水量测定:使用水分测定仪测定过20目筛的茶叶籽仁含水量。
1.3.2 茶叶籽皂素总量测定
样品前处理:称取0.200 0 g茶叶籽仁粉末,按照1∶15的质量体积比加入正己烷,超声15 min,以6 000 r·min-1离心10 min除去上清液,重复此步骤;除去正己烷后,按照1∶15质量体积比加入70%甲醇,静置30 min,超声30 min,以6 000 r·min-1离心10 min,取上清液过0.45 μm滤膜,即得供试液,每个样品3个重复,每个样品取50 μL混合制备质量控制(QC)样品。
茶叶籽皂素总量分别参考香草醛-浓硫酸比色法[12]和高效液相色谱法(HPLC)[13]进行检测。
香草醛-浓硫酸法主要步骤:吸取稀释20倍的样品0.5 mL,加入0.5 mL 8%香草醛溶液,于冰水浴中加入4 mL 77%硫酸溶液,60℃加热10 min,冰水浴中冷却15 min后,以试剂为空白对照,用1 cm比色皿在550 nm波长处测定吸光度。配制1 mg·mL-1的茶皂素标准品母液,分别吸取标准品母液0.1、0.2、0.3、0.4、0.5 mL,置于带塞试管中,加70%甲醇定容至溶液体积为0.5 mL,按上述方法显色并测定吸光值,计算样品中茶叶籽皂素含量。
HPLC法主要步骤:色谱柱为Symmetry C18柱(4.6 mm×250 mm,5 μm),流动相A相为水,B相为甲醇,柱温为25℃,流速为1.0 mL·min-1,检测波长为210 nm,进样量为10 μL。洗脱程序:0~10 min,90% B。分别配制浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg·mL-1等6个标准系列溶液,经0.45 μm膜过滤后进行HPLC检测,分别得出不同浓度下的峰面积,绘制标准曲线。
1.3.3 茶叶籽皂素组成测定
采用UHPLC-Q-Exactive/MS测定茶叶籽皂素单体[10]。色谱柱为ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm),流动相A相为0.1%甲酸水溶液,B相为乙腈,柱温为25℃,流速为0.2 mL·min-1,进样量为3 μL。洗脱程序:0 min,35% B;4 min,37% B;26 min,37% B;48 min,45% B;51 min,90% B;52 min,35% B;55 min,35% B。质谱条件:采用电喷雾电离(ESI)Q-Orbitrap质谱仪进行质谱分析,并在负电离全扫描模式下工作。辅助气体和护套气体的流量分别为10 L·min-1和45 L·min-1。辅助气体加热器的温度为300℃,毛细管温度为320℃。全扫描和ddMS2的分辨率分别为70 000和35 000,完整的质谱扫描范围设置为150~2 000/。数据采集和处理使用Thermo Xcalibur 3.0软件。单体初步鉴定是利用化合物的保留时间、一级质谱的分子离子峰质荷比和二级质谱的碎片离子峰组成与多个代谢组学数据库以及相关文献[10-11,14]进行比对,所有单体均通过比较样品间母离子的相对强度来计算相对含量。
1.4 统计与分析
数据以平均值±标准差(SD)表示。所有试验重复3次,3组独立试验。结果采用SPSS 26.0软件进行数据处理,采用单因素方差分析,<0.05视为差异有统计学意义。用GraphPad Prism 5.0软件进行热图和柱状图绘制;采用SIMCA 14.1对数据进行正交偏最小二乘判别分析(OPLS-DA)。
2 结果与分析
2.1 不同种质茶叶籽的百粒质量和壳仁比
百粒质量是体现种子大小和充实程度的一项指标,在一定程度上能反映茶叶籽产量。壳仁比反映茶叶籽仁的占比,籽仁中的油脂、淀粉和皂素含量较多,壳仁比越小越有利于茶叶籽中成分的提取。21个不同品种(系)茶叶籽的百粒质量、壳仁比和含水量如表2所示。21份茶叶籽的百粒质量和壳仁比具有显著性差异(<0.05),百粒质量范围在61.95~179.74 g,其中,属于乔木型茶树的勐库大叶种百粒质量最大,而属于灌木型黄化品系的安吉奶黄优系百粒质量最小,百粒质量总体呈现乔木型茶树>小乔木型茶树>灌木型茶树。壳仁比大于100%表示籽壳比籽仁重,黔湄601茶叶籽的籽壳比籽仁重,金观音茶叶籽的籽壳与籽仁重量大致相等,其余19个品种(系)茶叶籽的籽壳均比籽仁轻,其中安吉优系和安吉奶黄优系籽仁占比较大。21个品种(系)的茶叶籽含水量为5.63%~7.55%。
2.2 不同种质茶叶籽皂素总量比较
前期试验发现,籽壳中皂素含量远低于籽仁,因此选用籽仁进行茶叶籽皂素含量提取和测定。21个品种(系)的茶叶籽经前置处理后,分别用紫外分光光度法、HPLC法进行茶叶籽皂素含量测定,结果如表3所示。紫外分光光度法测得的茶叶籽皂素范围为30.82%~48.16%,平均值为(39.50±4.95)%;HPLC法测得的茶叶籽皂素范围为16.93%~31.82%,平均值为(24.07±4.84)%。两种检测方法均显示,不同品种(系)间的茶叶籽皂素总含量具有显著性差异(<0.05)。黄观音茶叶籽皂素含量最高,紫娟最低,这两个品种均为小乔木型,表明茶叶籽皂素总含量与茶树树型相关性较小,与郭华[15]得出的灌木>小乔木=乔木的结论不一致。对比不同检测方法发现,紫外分光光度法测得的茶叶籽皂素含量显著高于HPLC法,图1表明个别品种(系)的含量排序存在差异,但总体品种(系)间含量高低趋势较为一致。造成这种结果的原因可能是不同茶叶籽仁中含有数量不同的黄酮类等酚类物质,会与香草醛反应,导致吸光值上升,干扰检测的准确性。

表2 不同种质茶叶籽的基本特征指标
注:同列不同小写字母表示差异显著(<0.05),下同
Note: Different lowercase letters in the same column indicate significant difference (<0.05). The same below
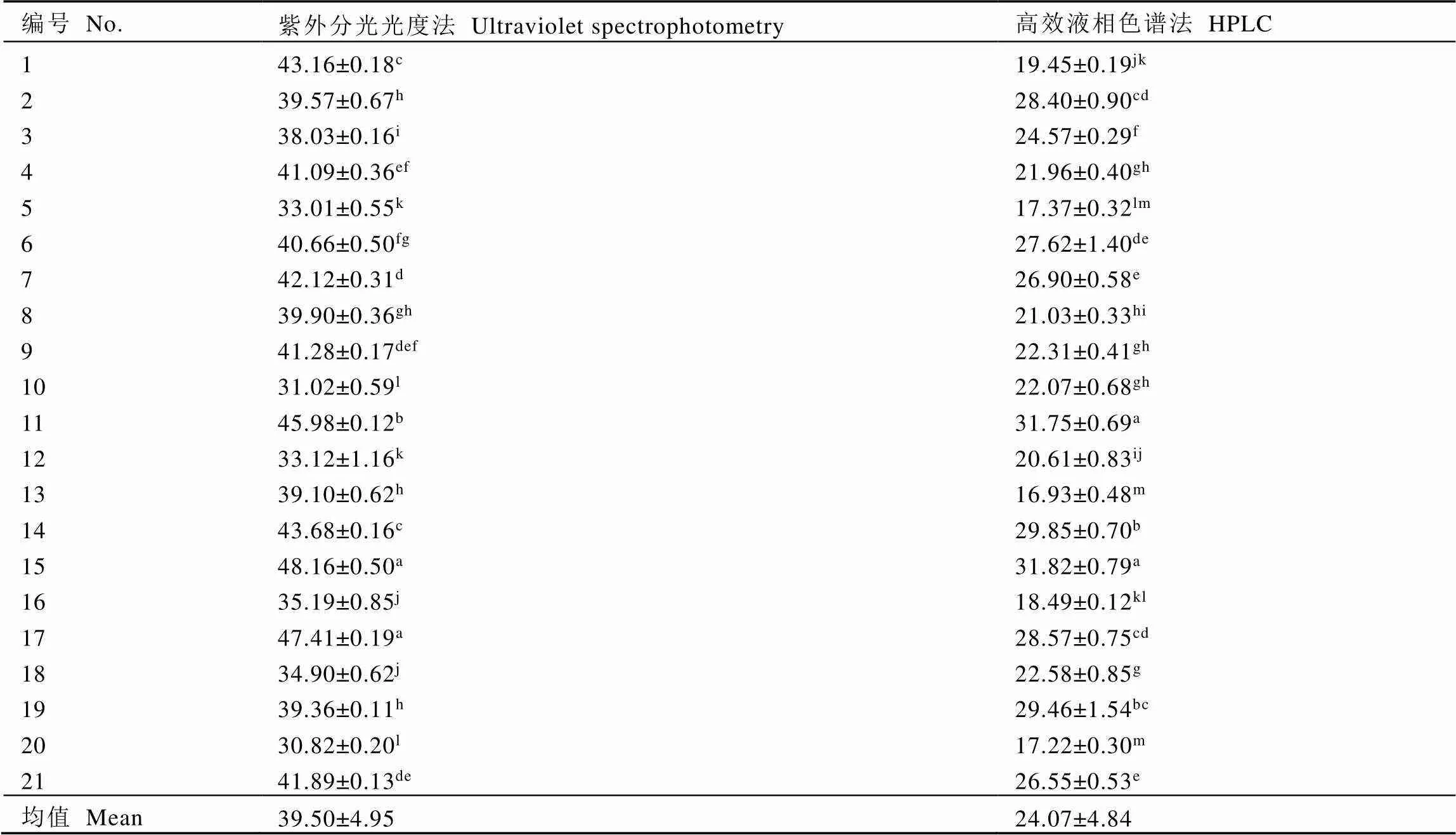
表3 不同种质茶叶籽皂素总量
2.3 不同种质茶叶籽皂素单体差异
为了解不同品种(系)茶叶籽中皂素组成及相对含量的差异性,采用UHPLC-Q- Exactive/MS对茶叶籽提取物中皂素单体进行检测分析。通过已报道的茶叶籽皂素单体的质荷比和二级质谱进行物质提取与比对[10],共获得了68个茶叶籽皂素单体特征离子峰(图2和表4),QC样品中的这些物质相对标准偏差(Relative standard deviation,RSD)小于2%,表示这些数据均可进一步分析。
21份茶叶籽的皂素提取物的总离子流图相似(图2),除金萱外均检出68种皂素单体(表4)。68个茶叶籽皂素单体中有62个单体结构确定,与前人文献报道一致[9-10,16],另有6个未知物质。虽然不同茶叶籽中皂素种类相似,但其含量具有显著性差异(<0.05)(图3)。所有品种(系)中皂素单体相对强度前5的物质一致,分别是Theasaponin E1、Theasaponin E12、Theasaponin A9、Assamsaponin A、Assamsaponin B。Theasaponin E1是所有种质资源中茶叶籽峰的相对强度最高的茶叶籽皂素单体(图3-A),在黄观音中含量最高,而在紫娟中含量最低。
文献报道,山茶属植物中已发现的三萜皂苷存在7种皂苷元、26种糖体和9种有机酸的排列组合[16]。本研究中结构确定的62个茶叶籽皂素单体均拥有相同的皂苷元,但连接的糖体和有机酸不相同。其中糖体主要有两种结构,第一种为-D-Galactopyranosyl(1→2)[-D-xylopyranosyl(1→2)--L-arabinopyranosyl(1→3)]--D-glucuronic acid,包含39个单体;第二种为-D-Galactopyranosyl(1→2)[-D-glucuronopyranosyl(1→2)--L-arabinopyranosyl(1→3)]--D-glucuronic acid,包含20个单体。说明茶叶籽皂素中以含有第一种糖体结构的皂素单体为主。另外,结果显示金萱中未检测到Assamsaponin C,后续可以选择不同地区的金萱进行进一步检测分析。

图1 不同种质茶叶籽皂素总量
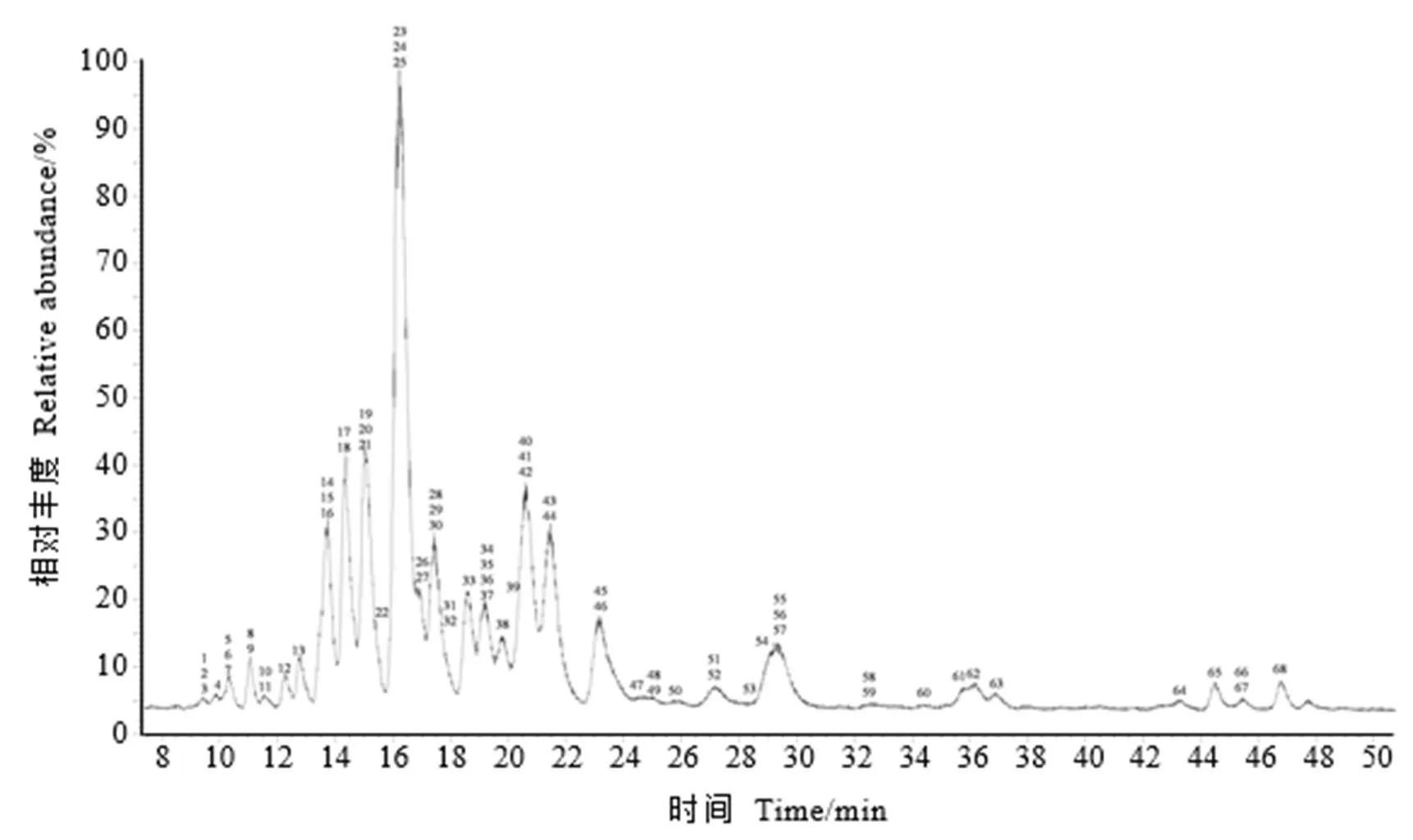
图2 基于UHPLC-Q-Exactive/MS茶叶籽皂素总离子流色谱图(以QC为例)
为研究不同茶叶籽资源的皂素组分差异性,将21个品种(系)的68个茶叶籽皂素单体数据进行OPLS-DA分析。结果显示,21份茶叶籽资源被明显分成2组(图4-A),以编号为1~12的灌木型品种(系)为类别1,聚集在OPLS-DA得分图左侧;以编号为13~21的小乔木和乔木型品种(系)为类别2,聚集在得分图右侧。这些结果表明,灌木型种质资源和小乔木型、乔木型种质资源中的茶叶籽皂素单体存在显著差异。置换检验结果显示(图4-B),2和2分别为0.27和–0.616,说明OPLS-DA模型没有过拟合,以变量投影重要性(Variable importance in the projection,VIP>1)为标准,共筛选出差异组分21种(图4-C)。
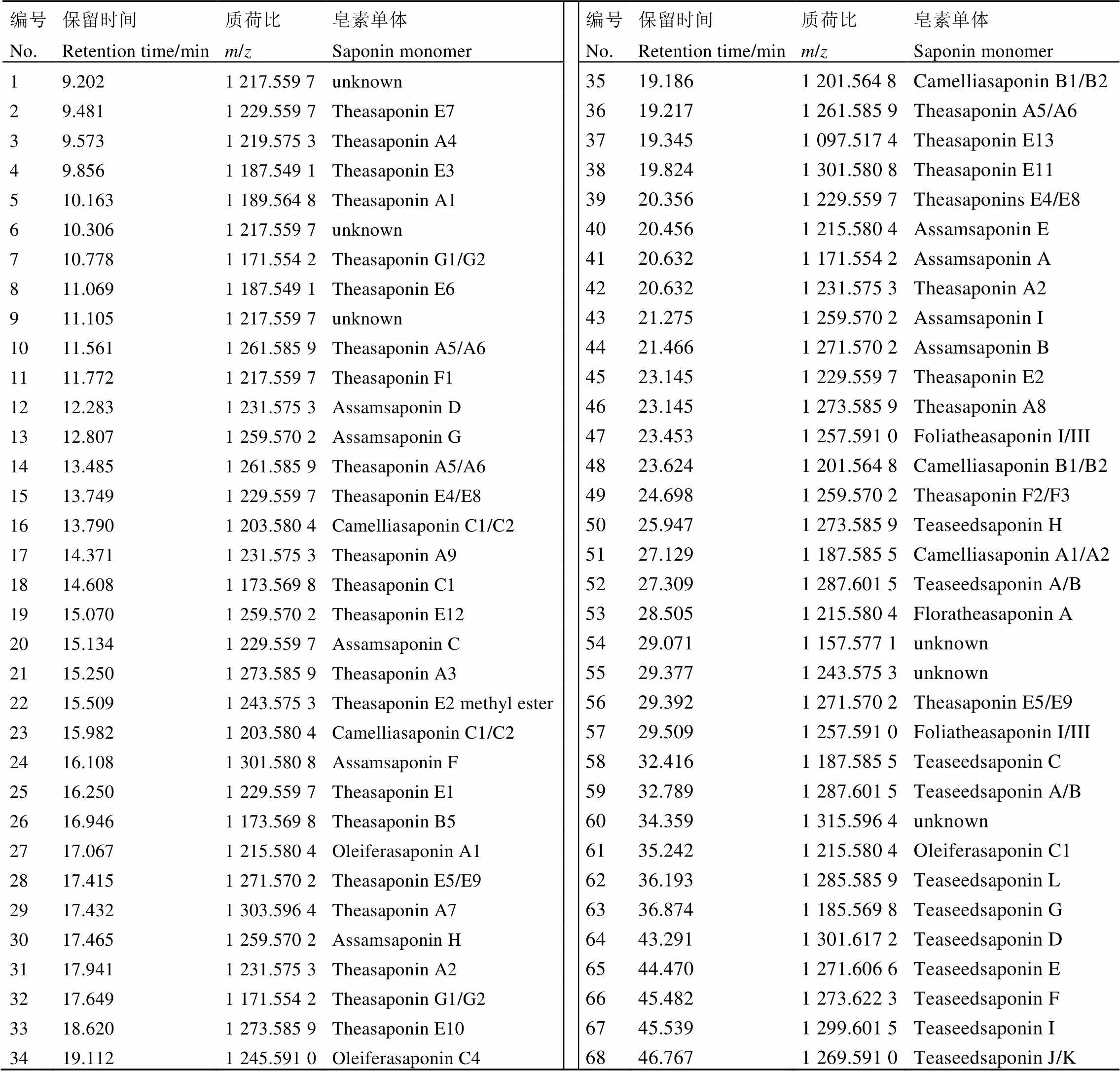
表4 茶叶籽皂素单体质谱信息
图5所示为21种差异组分在两个种质资源类别中的相对强度分布,其中Theasaponin E2、Theasaponin E1、Assamsaponin B、Theasaponin E4/E8、Assamsaponin H、Theasaponins E4/E8等6种单体在灌木型种质资源中相对强度较高(<0.05),而Theasaponin E12、Camelliasaponin B1/B2、Theasaponin A5/A6、Assamsaponin A、unknown(1157.5771)、Theasaponin B5、Camelliasaponin C1/C2、Theasaponin A9、Theasaponin E10、Theasaponin E6、Theasaponin A7、Camelliasaponin A1/A2、Theasaponin E11、Assamsaponin E、Assamsaponin G等15种单体在小乔木型、乔木型种质资源中较高(<0.05)。单体结构分析发现,灌木型种质资源中以第一种糖体结构的皂素单体为主,而在小乔木型、乔木型种质资源中,含有第二种糖体的皂素单体积累得更多。
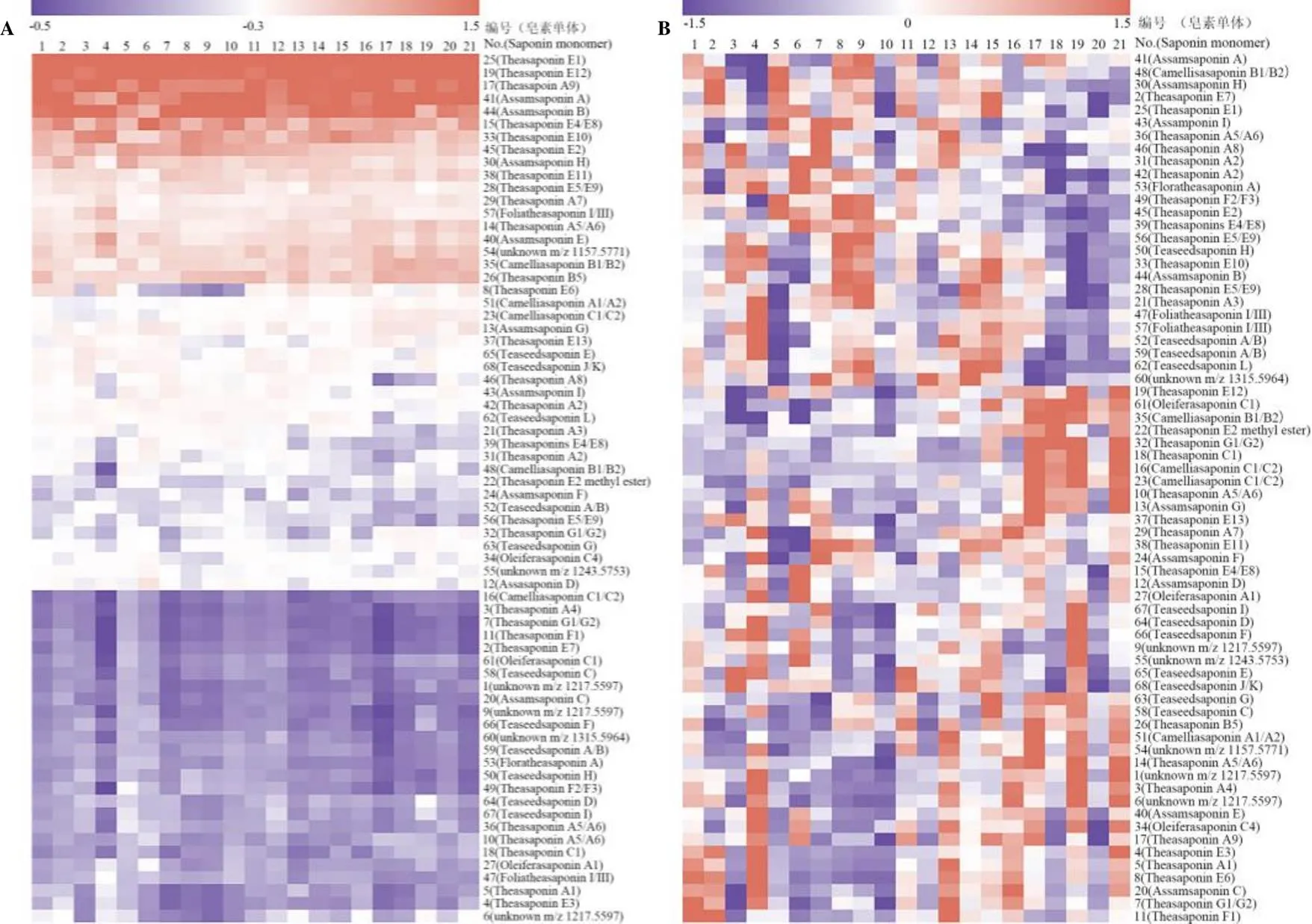
注:A图为同一种质中各个皂素单体峰的相对强度;B图为不同种质间各皂素单体峰的相对强度
2.4 不同种质间标志性差异单体
种质资源的类型可能是导致茶叶籽皂素差异的潜在原因,所以使用Pearson法对种质资源的基本特征数据与茶叶籽皂素总量和差异性单体组分的相对强度进行相关性分析(表5)。结果发现,百粒质量与皂素总含量无显著相关性,但与Theasaponin E12、Camelliasaponin B1/B2、Theasaponin A5/A6、Camelliasaponin C1/C2、Assamsaponin G存在极显著正相关关系(<0.01,0.5<≤0.8);另外,壳仁比与皂素含量无显著相关性。由2.1章节可知,小乔木型、乔木型种质资源的百粒质量大于灌木型,结合图5可知,高响应强度的Theasaponin E12、Camelliasaponin B1/B2、Theasaponin A5/A6、Camelliasaponin C1/C2和Assamsaponin G,可能是灌木型种质资源有别于小乔木型、乔木型种质资源重要的标志性差异单体。
3 讨论
3.1 茶叶籽皂素总量的检测方法
茶皂素是一类结构相似的五环三萜类物质,其紫外吸光较弱,定量检测较为困难。以往文献中报道的检测手段有重量法、比色法、HPLC法等[17]。陈莹等[18]采用重量法、香草醛-浓硫酸比色法和HPLC法对不同纯度茶皂素进行检测,发现3种检测方法的结果无显著性差异,均适合于茶皂素含量的检测。张团结等[19]以水解后的皂素甙元为标准,采用分光光度法和HPLC法对油茶籽饼中茶皂素定量检测,认为分光光度法更为简单便捷。也有研究表明,HPLC法较香草醛-浓硫酸比色法测定油茶皂素含量准确度更高[20]。由于每种方法都有其局限性,不同专家也持有不同的见解,目前暂无公认稳定、高效、可靠的茶皂素检测手段。本研究采用了2种方法对不同的茶叶籽皂素含量进行检测,发现香草醛-浓硫酸比色法测定结果高于HPLC法,是HPLC法的1.64倍。导致此结果的原因可能是茶叶籽中含有较多的黄酮类等酚类物质,在前处理阶段未完全去除,使得这些物质与香草醛在酸性条件下发生反应,引起吸光值异常升高。前人文献中多以油茶籽皂素作为检测目标,其干扰物质含量和种类可能较少,但具体差异尚不清楚,需进一步研究。以上说明香草醛-浓硫酸比色法可能使得茶叶籽中皂素的检测结果存在误差。另外,HPLC法与香草醛-浓硫酸比色法检测结果也存在差异,可能是因为某些皂素单体的紫外吸光过弱,不能被高效液相色谱仪的紫外检测器捕捉到信号。这也侧面说明不同茶叶籽资源中皂素单体的种类和含量有区别。

注:A,OPLS-DA图,R2X=96.5%,R2Y=97.7%,Q2=96.1%;绿色和蓝色分别代表灌木型种质资源、小乔木型和乔木型种质资源;B,重复200次的置换检验结果图;C,VIP>1的差异组分

图5 不同类别种质资源中差异茶叶籽皂素单体热图
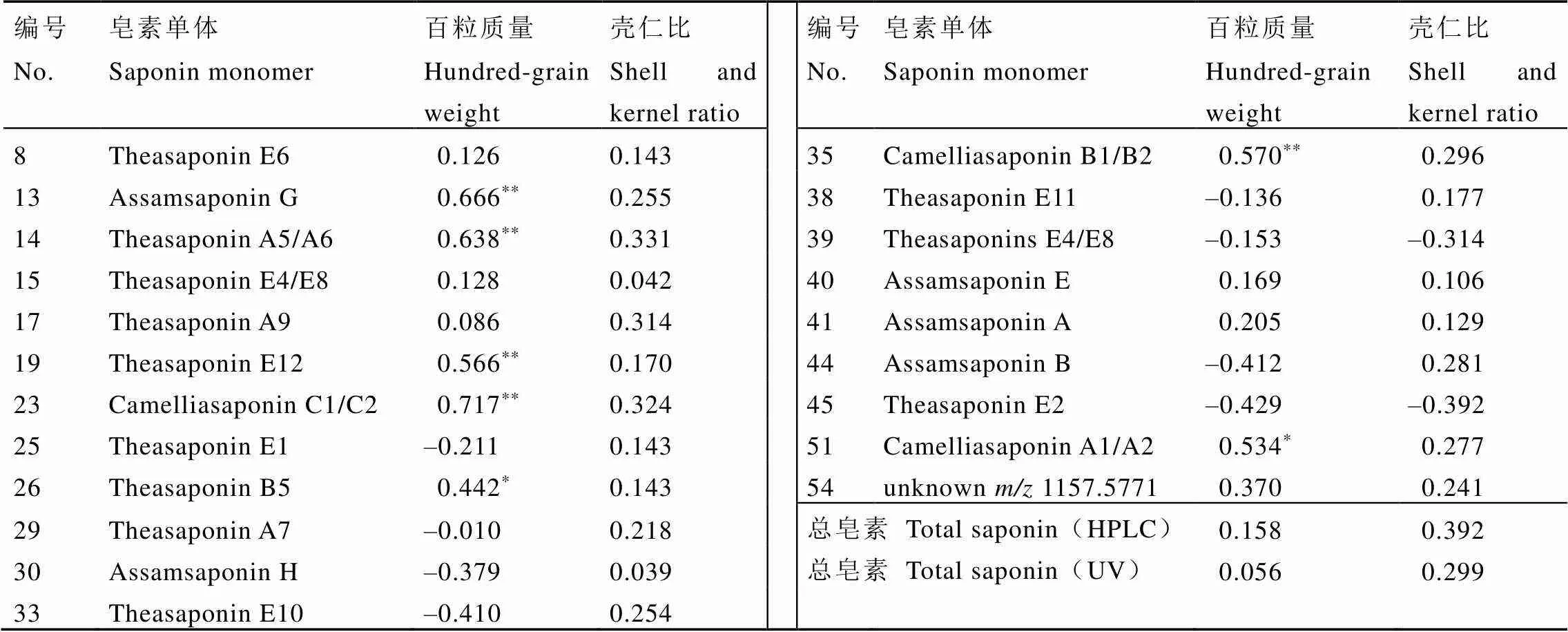
表5 不同种质资源与茶叶籽皂素的相关性
注:*表示在0.05水平(双尾),相关性显著。**表示在0.01水平(双尾),相关性极显著
Note: *, the correlation was significant at level 0.05 (two-tailed). **, the correlation was extremely significant at level 0.01 (two-tailed)
3.2 茶叶籽皂素与种质的关系
依据糖体和有机酸不同以及皂苷元的结合位点不同,现已在茶()、油茶()、山茶()和茶梅()4个山茶属的种子、花、叶和根中共分离鉴定出188种茶皂素单体结构[16]。Morikawa等[21]研究表明,茶花皂苷在不同品种和地区间存在差异,中国台湾中北部山区的茶花样品中Chakasaponins I-III较高,而中部和南部地区的样品中Floratheasaponins A-F含量较高;Fan等[22]通过对42个茶树品种茶叶皂苷含量的筛选,发现茶叶皂苷含量受到茶树基因型和生长条件(如发育和环境因素)的影响。但是不同茶树品种间的茶叶籽皂素单体种类和含量变化仍不清楚。本研究通过对同一地区的21个茶树品种(系)茶叶籽皂素进行检测,发现不同品种(系)间茶叶籽皂素总量、单体种类及含量均有显著性差异(<0.05),黄观音是本研究茶树种质中皂素总量最高的品种,Theasaponin E1是所有品种(系)中离子峰相对强度最高的单体。OPLS-DA分析结果表明,灌木型种质资源与小乔木型、乔木型种质资源的皂素单体构成(种类及相对含量)有明显差异。结合种质基础数据的相关性分析获得标志性差异单体物质,Theasaponin E12、Camelliasaponin B1/B2、Theasaponin A5/A6、Camelliasaponin C1/C2和Assamsaponin G可能是区别灌木型与小乔木型、乔木型种质资源的标志性差异单体。
次生代谢组学分析揭示,甲羟戊酸(MVA)途径是山茶属植物合成茶皂素的主要途径[11,23]。首先2,3-氧化角鲨烯环化生成-amyrin型三萜骨架,随后通过细胞色素P450单加氧酶(P450s)对此骨架进行氧化修饰和UDP糖基转移酶(UGTs)介导的糖侧链修饰而形成皂素[24]。山茶植物组织中已鉴定出100多种三萜皂苷,其结构和功能的多样性主要是由P450s和UGTs贡献的,然而由于茶树基因组的复杂性,各类皂素单体的合成路径仍难以评估。从5组标志性差异单体的结构来看,它们所连接的糖基相同,表明可能由相同或相似的UGTs合成,区别于灌木型茶叶籽皂素单体的合成途径。
不同结构的茶皂素生物活性各异。有文献显示,Thesaponin E1和Thesaponin E2对乙醇诱导的大鼠胃黏膜病变的抑制活性要强于Theasaponin A2、Assamsaponin A和Assamsaponin D[7]。一些修饰基团对茶皂素的活性至关重要,如C3位上糖基类型也能够影响皂素的细胞毒性及其溶血能力的强弱[25],C21位和C22位上的乙酰基能增加茶皂素的抗高血脂症活性[26],C22位还是茶皂素抑制过敏反应的关键结构[27]。Thesaponin E1和Thesaponin E2为同分异构体,Thesaponin E1具有抑制小鼠胃排空和加速胃肠运输的功能,而Thesaponin E2没有此类活性[28];Thesaponin E2可以降低人们对蔗糖甜味的感知能力,而Thesaponin E1不能[29]。灌木型茶树茶叶籽的皂素单体构成与小乔木型、乔木型茶树茶叶籽的皂素单体有明显区别,表明这两类茶树茶叶籽的生理活性可能也存在差异,在后续研究中值得关注。
此外,茶叶籽在成熟过程中,茶叶籽皂素含量先逐渐增加,在9月份达到最高值后随成熟度增加而减少[11]。茶叶籽皂素含量的增加与减少与哪些生物合成途径及基因有关?茶叶籽中其他物质如茶叶籽油、淀粉和蛋白的合成与积累是否会影响皂素的含量?这些都有待进一步研究。
[1] 马跃青, 张正竹. 茶叶籽综合利用研究进展[J]. 中国油脂,2010, 35(9): 66-69.
Ma Y Q, Zhang Z Z. Research advance in comprehensive utilization of tea seeds [J]. China Oils and Fats, 2010, 35(9): 66-69.
[2] Yang W S, Ko J, Kim E, et al. 21-O-angeloyltheasapogenol E3, a novel triterpenoid saponin from the seeds of tea plants, inhibits macrophage-mediated inflammatory responses in a NF-B-dependent manner [J]. Mediators of Inflammation, 2014, 2014: 658351. doi: 10.1155/2014/658351.
[3] Yang H, Cai R, Kong Z Y, et al. Teasaponin ameliorates murine colitis by regulating gut microbiota and suppressing the immune system response [J]. Frontiers in Medicine, 2020, 7: 584369. doi: 10.3389/fmed.2020.584369.
[4] Yang H, Shao X, Yu G H. Effect of tea saponin on blood pressure in spontaneously hypertensive rats [J]. Chinese Journal of Clinical Healthcare, 2007, 116(5): 388-395.
[5] Yong Y, Chen X, Xing H. Hypolipidemic and antioxidant activities of hydrolyzed saponins from defatted seeds ofAbel [J]. Lation American Journal of Pharmacy, 2013, 32(3): 409-417.
[6] Khan M I, Ahhmed A, Shin J H, et al. Green tea seed isolated saponins exerts antibacterial effects against various strains of gram positive and gram negative bacteria, a comprehensive studyand[J]. Evidence-based Complementary and Alternative Medicine : eCAM, 2019, 2018: 3486106. doi: 10.1155/2018/3486106.
[7] Morikawa T, Li N, Nagatomo A, et al. Triterpene saponins with gastroprotective effects from tea seed (the seeds of) [J]. Journal of Natural Products, 2006, 69(2): 185-190.
[8] 赵世明. 茶皂素的化学结构及药理活性研究[J]. 国外医药(植物药分册), 1998, 13(1): 3-6.
Zhao S M. Study on the chemical structure and pharmacological activity of tea saponin [J]. World Phytomedicines, 1998, 13(1): 3-6.
[9] Guo N, Tong T T, Ren N, et al. Saponins from seeds of[J]. Phytochemistry and Bioactivity, 2018, 149: 42-55.
[10] Wu X J, Jia L Y, Wu J F, et al. Simultaneous determination and quantification of triterpene saponins fromseeds using UPLC-PDA-QTOF-MS/MS [J]. Molecules, 2019, 24(20): 3794. doi: 10.3390/molecules24203794.
[11] Chen C, Zhu H Q, Kang J X, et al. Comparative transcriptome and phytochemical analysis provides insight into triterpene saponin biosynthesis in seeds and flowers of the tea plant () [J]. Metabolites, 2022, 12(3): 204. doi: 10.3390/metabo12030204.
[12] Chen Y F, Yang C H, Chang M S, et al. Foam properties and detergent abilities of the saponins from[J]. International Journal of Molecular Sciences, 2010, 11: 4417-4425.
[13] 谭搏, 曹福祥, 赵莹. 油茶饼中茶皂素的定量分析[J]. 精细化工中间体, 2009, 39(2): 67-69.
Tan B, Cao F X, Zhao Y. Quantitative analysis of tea saponin incake [J]. Fine Chemical Intermediates, 2009, 39(2): 67-69.
[14] 吴学进. 茶籽皂素的分离鉴定与定量检测[D]. 杭州: 浙江大学, 2018.
Wu X J. Separation, identification and quantification of triterpene saponins in seeds of[D]. Hangzhou: Zhejiang University, 2018.
[15] 郭华. 高档茶籽油的提取及茶籽综合利用技术研究[D]. 长沙: 湖南农业大学, 2007.
Guo H. Study of technologies on refining high quality tea seed oil and comprehensively utilizing tea seed [D]. Changsha: Hunan Agricultural University, 2007.
[16] Cui C J, Zong J F, Sun Y, et al. Triterpenoid saponins from the genus: structures, biological activities, and molecular simulation for structure-activity relationship [J]. Food & Function, 2018, 9(6): 3069-3091.
[17] 王羚, 方学智. 油茶皂素定量分析方法研究进展[J]. 食品工业, 2020, 41(11): 278-282.
Wang L, Fang X Z. Research progress in quantitative analysis of tea saponin [J]. The Food Industry, 2020, 41(11): 278-282.
[18] 陈莹, 刘松柏, 何良兴, 等. 油茶籽粕和茶皂素中皂苷的定量检测方法研究[J]. 中国粮油学报, 2012, 27(2): 105-111.
Chen Y, Liu S B, He L X, et al. Quantitative analysis of saponin inseed cake and tea saponins [J]. Journal of the Chinese Cereals and Oils, 2012, 27(2): 105-111.
[19] 张团结, 熊道陵, 许光辉, 等. 油茶籽饼中茶皂素定量检测方法研究[J]. 食品工业科技, 2016, 37(4): 53-56.
Zhang T J, Xiong D L, Xu G H, et al. Quantitative analysis of tea saponin from seed cake [J]. Science and Technology of Food Industry, 2016, 37(4): 53-56.
[20] 赵敬娟, 杜先锋. 油茶皂苷对照品制备及高效液相色谱定量法的研究[J]. 中国油脂, 2009, 34(4): 68-72.
Zhao J J, Du X F. Sasanquasaponin reference substance preparation and quantitative [J]. China Oils and Fats, 2009, 34(4): 68-72.
[21] Morikawa T, Lee I J, Okugawa S, et al. Quantitative analysis of catechin, flavonoid, and saponin constituents in “tea flower”, the flower buds of, from different regions in Taiwan [J]. Natural Product Communications, 2013, 11(8): 1553-1557.
[22] Fan L M, He Y F, Xu Y J, et al. Triterpenoid saponins in tea () plants: biosynthetic gene expression, content variations, chemical identification and cytotoxicity [J]. International Journal of Food Sciences and Nutrition, 2021, 72(3): 308-323.
[23] 罗祖良, 张凯伦, 马小军, 等. 三萜皂苷的合成生物学研究进展[J]. 中草药, 2016, 47(10): 1806-1814.
Luo Z L, Zhang K L, Ma X J, et al. Research progress in synthetic biology of triterpen saponins [J]. Chinese Traditional and Herbal Drugs, 2016, 47(10): 1806-1814.
[24] Zhao J, Li P H, Xia T, et al. Exploring plant metabolic genomics: chemical diversity, metabolic complexity in the biosynthesis and transport of specialized metabolites with the tea plant as a model [J]. Critical Reviews in Biotechnology, 2020, 40(5): 667-688.
[25] Oda K, Matsuda T, Murakami S, et al. Adjuvant and haemolytic activities of 47 saponins derived from medicinal and food plants [J]. Biological Chemistry, 2000, 381(1): 67-74.
[26] Yoshikawa M, Morikawa K, Yamamoto Y, et al. Floratheasaponins A-C, acylated oleanane-type triterpene oligoglycosides with anti-hyperlipidemic activities from flowers of the tea plant () [J]. Journal of Natural Products, 2005, 68(9): 1360-1365.
[27] Matsuda S, Nakamura K, Fujimoto R, et al. Medicinal flowers. XXXI. acylated oleanane-type triterpene saponins, Sasanquasaponins I-V, with antiallergic activity from the flower buds of[J]. Chemical & Pharmaceutical Bulletin, 2010, 58(12): 1617-1621.
[28] Murakami T, Nakamura J, Kageura T, et al. Bioactive saponins and glycosides. XVII. Inhibitory effect on gastric emptying and accelerating effect on gastrointestinal transit of tea saponins: structures of assamsaponins F, G, H, I, and J from the seeds and leaves of the tea plant [J]. Chemical & Pharmaceutical Bulletin, 2000, 48: 1720-1725.
[29] Kitagawa I, Hori T, Motozawa T, et al. Structures of new acylated oleanene-type triterpene oligoglycosides, Theasaponins E1 and E2, from the seeds of tea plant,(L.) O. Kuntze [J]. Chemical & Pharmaceutical Bulletin, 1998, 46(12): 1901-1906.
Analysis of the Saponin Contents and Composition in Tea Seeds of Different Germplasms
CHEN Yuhong1,2, GAO Ying1*, HAN Zhen3, YIN Junfeng1*
1. Tea Research Institute, Chinese Academy of Agricultural Sciences, Hangzhou 310008, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China; 3. General Agricultural Extension Station of Ningbo City, Ningbo 315012, China
Tea saponins are abundant in the seeds ofwith specific biological activities. Their contents and composition in tea seeds of different germplasms remain unclear. In this study, seeds from 21 tea germplasms were collected from the same region of Zhejiang and used as experimental materials to determine the basic characteristics, saponin contents and composition. Correlation analysis between germplasm and saponin composition was also performed. The results show that the seed weight, shell kernel ratio and saponin content of different tea seeds were significantly different (<0.05). The saponin content detected by UV spectral method and HPLC ranged from 30.82% to 48.16% and 16.93% to 31.82%, respectively. ‘Huangguanyin’ had the highest saponin content in tea seeds. Totally 68 tea seed saponin monomers were detected simultaneously using ultrahigh performance liquid chromatography-quadrupole orbitrap mass spectrometer(UHPLC-Q-Exactive/MS). Theasaponin E1 had the highest relative intensity. Orthogonal partial least squares discriminant analysis (OPLS-DA) shows that the 21 tea seed germplasmscan be distinguished into 2 groups according to tree type with 21 differentCamelliasaponin B1/B2, Theasaponin A5/A6, Camelliasaponin C1/C2 and Assamsaponin G were the most significant characteristic substances of semi-tree form and arbor form resources. The results of the study laid the foundation for the selection and value-added utilization of tea seed saponins.
tea seed, saponin, monomer, UHPLC-Q-Exactive/MS
S571.1;Q946.8
A
1000-369X(2022)05-705-12
2022-04-25
2022-05-13
中国农业科学院创新工程(CAAS-ASTIP-2016-TRI)、浙江省“万人计划”科技创新人才项目(2018R52024)、财政部和农业农村部:国家现代农业产业技术体系(CARS-19-02A)、宁波市科技计划(202002N3020)
陈宇宏,女,博士研究生,主要从事茶深加工与多元化利用研究。*通信作者:yinggao@tricaas.com,yinjf@tricaas.com
