几种改良措施对酸化茶园土壤理化性质和微生物群落结构的影响
2022-10-31李艳春汪航李兆伟叶菁王义祥
李艳春,汪航,李兆伟,叶菁,王义祥,2*
几种改良措施对酸化茶园土壤理化性质和微生物群落结构的影响
李艳春1,汪航3,李兆伟3,叶菁1,王义祥1,2*
1. 福建省农业科学院农业生态研究所 福建省红壤山地农业生态过程重点实验室,福建 福州 350013;2. 福建省农业科学院土壤肥料研究所,福建 福州 350013;3. 福建农林大学生命科学学院,福建 福州 350002
茶园土壤酸化是制约茶树可持续生产的重要因素,通过田间小区试验分析比较几种措施对茶园土壤的改良效果,以期为茶园酸化土壤改良提供科学依据。试验设置7个处理:全量化肥(常规施肥,NPK)、全量化肥+10 t×hm-2生物质炭(NPK+BC10)、有机肥替代50%化肥(OM50)、有机肥替代50%化肥+2 t×hm-2生石灰(OM50+Lime)、有机肥替代50%化肥+10 t×hm-2生物质炭(OM50+BC10)、有机肥替代50%化肥+20 t×hm-2生物质炭(OM50+BC20)、有机肥替代50%化肥+40 t×hm-2生物质炭(OM50+BC40)。连续施用2年后,对茶园土壤酸度、养分和微生物群落进行测定。与NPK相比,OM50+Lime、OM50+BC20和OM50+BC40处理土壤pH分别显著提高1.10、0.49和0.68,盐基饱和度分别显著提高114.01%、55.92%和58.62%。OM50+BC10、OM50+BC20和OM50+BC40处理的土壤有机碳含量分别比NPK处理显著增加了29.68%、41.04%和59.37%。不同处理对土壤硝态氮含量无显著影响,OM50、OM50+BC20和OM50+BC40处理的铵态氮含量比NPK处理分别显著提高了40.27%、44.77%和41.77%。NPK+BC10、OM50+BC10、OM50+BC20和OM50+BC40处理能显著提高土壤微生物活性、微生物群落物种丰富度、多样性和均一性。OM50+BC10、OM50+BC20和OM50+BC40处理显著降低了真菌/细菌比例,表明这3个处理短期内增加了红壤茶园土壤生态系统稳定性,但OM50+Lime处理的革兰氏阴性菌/革兰氏阳性菌比例显著低于对照处理,表明施用生石灰处理的土壤微生物受到的环境胁迫程度高于其他处理。总之,OM50+Lime、OM50+BC20和OM50+BC40处理对酸化茶园土壤有较好的改良效果,OM50+BC20和OM50+BC40处理对土壤微生物群落性质方面的改良效果更佳。综合考虑改良效应及成本,OM50+BC20为最佳改良方案。
茶园土壤;酸化;土壤微生物群落;生物质炭;石灰;有机肥
茶树(L.)是我国传统的经济作物。2020年中国茶园面积321.7万hm2,干毛茶总产量293.2万t,面积和产量均居世界第一,毛茶总产值达2 626.6亿元[1]。茶产业在我国农业生产和国民经济中都占有极为重要的地位。然而,茶树多年宿根连作会使茶园土壤酸化严重、养分失衡、微生物多样性降低以及种群结构恶化,导致茶叶大幅减产和品质下降,严重制约了我国茶叶的可持续生产[2-4]。因此,加强茶园土壤管理,及时采取有效措施,防止茶园土壤进一步退化是当前生产中亟需解决的实际问题。
石灰是传统的酸性土壤改良材料[5-6]。施用石灰可以较快地缓解土壤酸化,促进作物养分吸收,提高产量和品质,然而,长期施用石灰也会产生土壤板结、阳离子不平衡、有机质含量下降等不良影响[7]。有机肥也常作为提升土壤肥力和阻控酸化的改良材料,有机肥投入可弥补因为农产品收获(移除)引起的土壤盐基矿物损失[8]。施用碱度较高的有机肥(厩肥或高温堆肥)能够有效控制农田土壤酸化,节约化肥成本,提高有机肥的资源利用率[9]。为克服单施石灰易造成土壤板结等问题,可将石灰与有机肥配合施用。罗玲等[10]研究表明,石灰和有机肥混施比单施石灰或有机肥的效果更佳,可有效改良芒果园酸性土壤。此外,生物质炭是作物秸秆等农业废弃物在缺氧或厌氧条件下,经热裂解炭化产生的高含碳固态物质。生物质炭绝大多数为碱性,pH为7.2~10.2,施用生物质炭可降低土壤容重,增加土壤盐基饱和度,促进作物对氮素的利用率,因此常作为酸化土壤的改良物质[11-12]。目前关于生物质炭改良茶园酸化土壤的报道较多,吴志丹等[13]研究了生物质炭不同施用量对酸化茶园土壤养分、交换性能和茶树生长的影响;王义祥等[14-15]研究表明,施用生物质炭比石灰更能增强茶园土壤对酸的缓冲性能,并且长期施用能提高茶园土壤pH,增加可溶性有机碳含量以及改变真菌群落结构;李艳春等[16]研究表明,生物质炭不仅可以缓解茶园土壤的酸化状况,而且还能增加土壤微生物量和微生物的代谢活性。
单施石灰、有机肥、生物质炭在改良茶园土壤方面各有利弊。目前,石灰与有机肥混合施用、生物质炭与化肥或有机肥配合施用等方式对酸化茶园土壤改良效果的研究还鲜见报道。针对福建省铁观音茶园土壤酸化严重的问题,本研究以常规施肥为对照,分析石灰、有机肥、生物质炭3种改良材料配合施用对酸化茶园土壤酸度、养分和微生物群落的影响,评价不同措施的改良效果,以期提出合理的施用技术。
1 材料与方法
1.1 试验地概况
试验点位于福建省安溪县感德镇槐植村(116°20′24″E,28°15′30″N),属亚热带季风气候,年均降雨量1 700~1 900 mm,年均气温15~18℃。土壤类型为红壤,试验区茶园为等高梯台常规种植方式。试验前耕层土壤的基本理化性质如下:pH为4.05,有机质24.20 g×kg-1,全氮1.48 g×kg-1,有效磷26.50 mg×kg-1,速效钾67.50 mg×kg-1。
1.2 试验材料
有机肥购自福建弥高生物有机肥有限公司,主要原料为畜禽粪便,有机质329.6 g×kg-1,全氮33.6 g×kg-1,全钾(K2O)21.5 g×kg-1,全磷(P2O5)32.5 g×kg-1。生物质炭为花生壳于高温炉中500℃条件下制备而成,pH为9.31,有机碳含量566.1 g×kg-1,全氮含量10.2 g×kg-1,全磷含量2.5 g×kg-1,碳氮比为55.5。
1.3 试验设计
试验始于2018年8月,研究对象为15年树龄的铁观音茶园,设置7个处理,所有处理都按全年施氮量150 kg×hm-2进行施肥(等氮量)。7个处理分别为:(1)全量化肥(常规施肥,NPK);(2)全量化肥+10 t×hm-2生物质炭(NPK+BC10);(3)有机肥替代50%化肥(OM50);(4)有机肥替代50%化肥+2 t×hm-2生石灰(OM50+Lime);(5)有机肥替代50%化肥+10 t×hm-2生物质炭(OM50+BC10);(6)有机肥替代50%化肥+20 t×hm-2生物质炭(OM50+BC20);(7)有机肥替代50%化肥+40 t×hm-2生物质炭(OM50+BC40)。每个处理设置3个重复小区(面积均为16 m2,1 m´16 m),共计21个小区,采用完全随机排列。
1.4 土壤样品采集及化学指标测定
连续施用2年后,于2020年5月3日(春茶采收季)在试验小区内采用五点取样法采集土壤样品,去除碎石和残根,过筛后用保温箱带回实验室,一部分保存于4℃冰箱,1周内进行土壤微生物磷脂脂肪酸(PLFA)和Biolog微平板分析;一部分鲜土风干后磨碎测定土壤化学性质。
土壤理化性质测定参考《土壤农业化学分析方法》[17],pH采用电极法按水土比2.5∶1测定。土壤阳离子交换量(CEC)用醋酸铵法测定。土壤交换性酸(H+、Al3+)用1 mol·L-1KCl提取-NaOH滴定法测定。总有机碳、全氮、全磷、全钾分别采用重铬酸钾-硫酸亚铁滴定法、凯氏定氮法、钼锑抗比色法、火焰光度法进行测定。土壤可溶性有机碳采用1 mol×L-1KCL浸提岛津TOC仪测定。
1.5 土壤微生物磷脂脂肪酸分析
土壤微生物磷脂脂肪酸的提取和衍生化参考Wu等[18]的方法。用KOH甲醇溶液进行磷脂脂肪酸的释放与甲酯化,形成脂肪酸甲酯(Fatty acidmethyl esters,FAMEs)。FAMEs经450GC/240MS(美国Varian公司)质谱分析,程序如下:70℃起始维持1 min,以20℃×min-1升温至170℃维持2 min,以5℃×min-1升温至280℃维持5 min,以40℃×min-1升温至300℃维持1.5 min。以十九烷酸甲酯(Nonadecanoic acid-methyl ester,C19:0)作为内标进行定量。采用不同的PLFA标定特定的微生物[18-19]:分支饱和磷脂脂肪酸如i15:0、i16:0、a17:0、i18:0等代表革兰氏阳性菌(G+);单不饱和磷脂脂肪酸如16:1ω14t、17:1ω8c、17:1ω7c代表革兰氏阴性菌(G-);采用16:1ω5c、20:1ω9c标记丛枝菌根真菌;20:2ω6t,9t标记原生动物。同时计算真菌/细菌、革兰氏阴性菌/革兰氏阳性菌、总饱和脂肪酸/总单不饱和脂肪酸(Sat/mono)等比例。
1.6 土壤微生物Biolog分析
Biolog分析参考杨宇虹等[20]的方法,将土壤溶液稀释至10-2,用移液器取150mL,接种至Biolog生态板,28℃恒温培养7 d,每24 h读取波长590 nm处的吸光值。微生物生理代谢活性通过单孔平均颜色变化率(Average well color development,AWCD)表示。AWCD=[Σ(C-)]/31。其中,C表示除对照孔外的31种碳源孔的吸光值,=1、2、3、···,31;表示对照孔吸光值。对培养96 h的吸光值进行微生物功能多样性分析。群落丰富度指数用被利用碳源的总数表示,为(-)>0.25的孔数。
Shannon多样性指数计算方法:=‒Σ(P×lnP),P表示第孔和对照孔的光密度差与所有孔和对照孔光密度差总和的比值,即P=(C‒)/Σ(C‒)。
Simpson指数计算方法为=1‒SP2,该指数是对多样性方面的集中性度量,又称优势度指数。
Pielou均匀度指数是群落实测多样性与最大多样性的比率,其计算方法为=ln,表示被利用碳源总数。
1.7 数据处理与分析
采用MATLAB 7.0和Microsoft Excel 2007软件对数据进行统计分析。多重比较选择Duncan极值法,显著性水平为5%。冗余分析(RDA)采用CANOCO 4.5软件进行。
2 结果与分析
2.1 不同处理对茶园土壤酸度的影响
与NPK相比,OM50+Lime、OM50+BC20和OM50+BC40处理的土壤pH分别显著提高了1.10、0.49和0.68,其他处理与NPK之间的差异不显著(表1)。此外,各处理对降低土壤潜在酸度也有显著效果。与NPK相比,OM50+Lime和OM50+BC20处理的茶园土壤交换性H+含量分别显著降低了37.50%和25.00%;OM50+Lime和OM50+BC40处理的土壤交换性Al3+含量分别显著降低了67.66%和50.08%。CEC是反映土壤保水保肥和缓冲能力的重要指标。与NPK相比,OM50+BC20和OM50+BC40处理的CEC分别显著提高了17.26%和27.68%;OM50+Lime、OM50+BC20和OM50+BC40处理的盐基饱和度分别显著提高了114.01%、55.92%和58.62%。表明OM50+Lime、OM50+BC20和OM50+BC40处理能有效缓解长期宿根连作导致的酸化效应。
2.2 不同处理对茶园土壤理化性质的影响
与NPK相比,OM50+BC20和OM50+BC40处理的土壤容重分别显著降低了13.97%和13.24%;OM50+BC40处理的土壤总孔隙度显著增加了12.17%;OM50+BC10、OM50+BC20和OM50+BC40处理的土壤有机碳含量分别显著增加了29.68%、41.04%和59.37%;OM50、OM50+BC10和OM50+BC20处理的土壤可溶性有机碳分别显著增加了30.23%、31.01%和41.86%;OM50、OM50+BC20和OM50+BC40处理的铵态氮含量分别显著增加了40.27%、44.77%和41.77%;OM50+BC20和OM50+BC40处理的速效钾含量分别显著提高了1.20倍和1.56倍(表2)。结果表明,OM50+BC20和OM50+BC40处理能有效改善土壤的透气性和保水性,OM50、OM50+BC10、OM50+BC20和OM50+BC40处理对茶园土壤地力的提升效果显著。
2.3 不同处理对茶园土壤微生物功能多样性的影响
2.3.1 土壤微生物的碳源利用率
单孔平均颜色变化率(AWCD)能够反映土壤中微生物群落对碳源利用的总体能力,是表征微生物活性的重要指标。AWCD值越大,土壤微生物的代谢活性越强。随着培养时间延长,各处理的AWCD值都呈现不断升高的趋势(图1)。培养24~144 h期间,AWCD迅速增加,144 h后增幅减缓并趋于平稳。培养过程中,不同处理土壤微生物活性表现为OM50+BC40>NPK+BC10>OM50+BC20>OM50+BC10>OM50+Lime>OM50>NPK。施入生物质炭处理(NPK+BC10、OM50+BC10、OM50+BC20和OM50+BC40)的土壤微生物活性明显高于其他处理(图1)。
2.3.2 土壤微生物多样性指数分析
根据碳源利用变化趋势,培养96 h的微生物生长代谢处于旺盛阶段,因此对96 h的AWCD值进行土壤微生物功能多样性分析。结果发现,施入生物质炭处理(NPK+BC10、OM50+BC10、OM50+BC20和OM50+BC40)的土壤微生物群落丰富度指数、Shannon指数和均匀度指数均显著高于NPK处理,而OM50和OM50+Lime处理与NPK处理之间差异不显著(表3)。各处理的优势度指数与对照之间没有明显差异。说明施入生物质炭处理的茶园土壤微生物群落的物种丰富度、多样性以及均一性均显著提高。
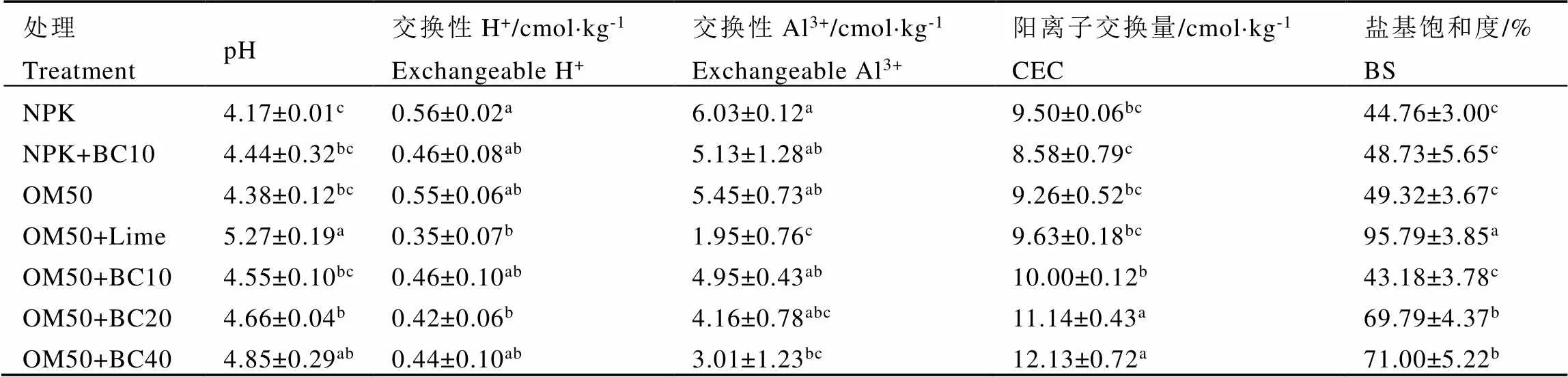
表1 不同处理茶园土壤酸度
注:同列数据后不同小写字母表示处理间差异显著(<0.05)
Note: Different lowercase letters in same column mean significant difference at 0.05 level

表2 不同处理茶园土壤理化性质
注:同行数据后不同小写字母表示处理间差异显著(<0.05)
Note: Different lowercase letters in same row mean significant difference at 0.05 level
2.4 不同处理对茶园土壤微生物群落结构的影响
运用PLFA方法共鉴定到13种碳链长度在15~20的脂肪酸(表4)。其中,细菌PLFA有10种,真菌PLFA有2种。与NPK相比,OM50+BC40处理的总PLFA含量显著增加了19.16%,OM50+BC20和OM50+BC40处理的细菌PLFA含量分别显著增加了16.96%和25.30%,OM50+BC10处理的真菌PLFA显著降低了18.26%(表5)。与NPK相比,OM50+BC20和OM50+BC40处理的革兰氏阴性菌PLFA含量分别显著增加了20.39%和35.37%,但革兰氏阳性菌PLFA在各处理间没有显著差异。真菌/细菌及G-/G+是表征微生物群落结构的重要指标。与NPK相比,OM50+BC10、OM50+BC20和OM50+BC40处理的真菌/细菌分别显著降低了23.10%、12.33%和19.49%;OM50+BC20和OM50+BC40处理的G-/G+分别显著增加了5.43%和12.63%,而OM50+Lime处理的G-/G+显著降低了32.96%。
2.5 微生物群落特征与土壤理化性质之间的相关性分析
利用Spearman秩相关分析微生物群落特征与土壤理化性质的相关性(表6)。结果表明,AWCD与土壤有机碳含量呈显著正相关;总磷脂脂肪酸、细菌、G+和G-都与土壤有机碳、全氮呈显著正相关,与土壤容重呈显著负相关;此外,G+还与土壤pH、交换性Al3+有显著的相关性。
对微生物群落和经过变异膨胀因子筛选后的6个土壤环境因子进行RDA分析发现(图2),微生物群落特征与土壤有机碳(SOC)、pH、总孔隙度(GP)、阳离子交换量(CEC)、电导率(EC)、速效钾含量(AK)之间存在极显著的相关性(=0.002,蒙特卡洛检验)。微生物群落特征在第1排序轴(RDA1)和第2排序轴(RDA2)的解释量分别为57.7%和7.5%。RDA1与SOC相关系数最大,达到–0.713,说明RDA1反映了以SOC为主的影响;而RDA2与pH的相关系数最大,为0.571,说明RDA2反映以pH为主的影响。对6个土壤环境因子进行蒙特卡洛检验发现,SOC能解释微生物群落特征变异的35.2%(=0.002),其次是pH(解释变异的13.0%,=0.012)和总孔隙度(解释变异的13.1%,=0.002);土壤环境因子CEC、EC和AK分别解释变异的3.4%、3.2%和2.5%(>0.05)。RDA分析表明,OM50+BC20和OM50+BC40处理的土壤微生物群落与土壤中较高的有机碳和孔隙度相关,OM50+Lime处理的土壤微生物群落与土壤中较低的有机碳和孔隙度以及较高的土壤pH相关。

图1 不同处理茶园土壤碳源平均颜色变化率

表3 不同处理茶园土壤微生物群落功能多样性指数
注:同列数据后不同小写字母表示处理间差异显著(<0.05)
Note: Different lowercase letters in same column mean significant difference at 0.05 level

表4 不同处理茶园土壤磷脂脂肪酸含量
注:同行数据后不同小写字母表示处理间差异显著(<0.05)
Note: Different lowercase letters in same row mean significant difference at 0.05 level
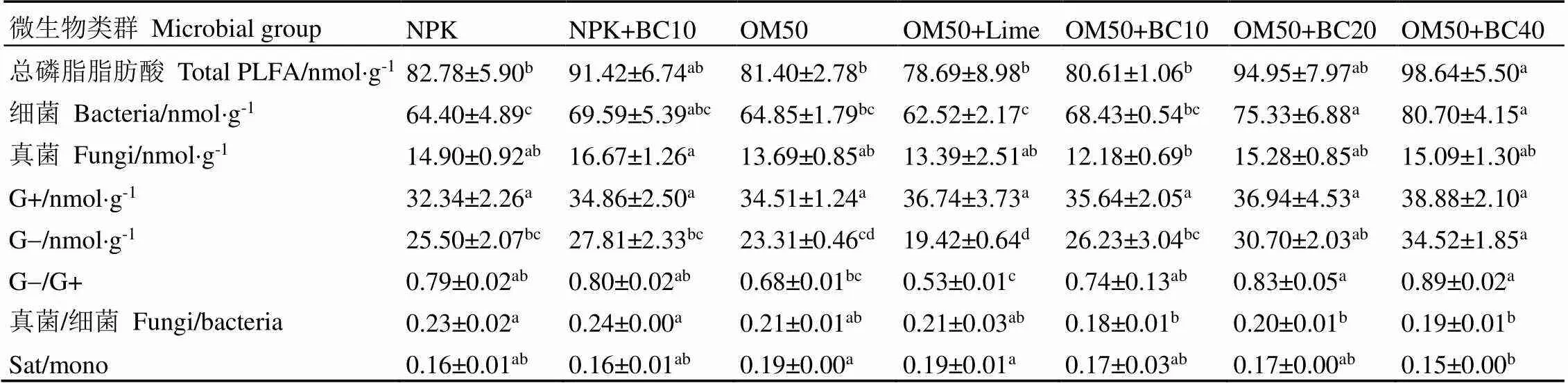
表5 不同处理茶园土壤主要微生物类群的PLFA含量及比值
注:同行数据后不同小写字母表示处理间差异显著(<0.05)。Sat/mono为饱和脂肪酸/单不饱和脂肪酸,下同
Note: Different lowercase letters in same row mean significant difference at 0.05 level. Sat/mono means saturated fatty acid/total monounsaturated fatty acids, The same below

表6 微生物群落特征与土壤理化性质的相关性分析
注:*和**分别表示在0.05和0.01水平差异显著
Note: * and ** denote significant differences at<0.05 and <0.01 levels, respectively

图2 微生物群落特征与土壤理化性质的冗余分析
3 讨论
3.1 不同处理对土壤酸度和养分含量的影响
施用有机肥能够提高土壤中有机质和速效养分的含量,提高土壤阳离子交换量,增强土壤保水保肥能力[21]。此外,长期施用有机肥能降低土壤中交换性H+和交换性Al3+含量,缓解土壤酸化进程[22]。本研究中,OM50处理能够显著提升土壤可溶性有机碳和铵态氮含量,但在提高土壤pH、增强土壤酸碱缓冲性能方面的效果不明显。这可能与有机肥种类、施用量、施用时间及土壤本底值有关。石灰作为传统酸性改良剂,有提高土壤pH、缓解酸性土壤铝毒的作用[23]。但长期单施石灰会使土壤孔隙度降低、容重增加,造成土壤板结,进而使土壤肥力下降[24],因而不宜作为一种长期的酸性土壤改良方法。本研究采用有机肥替代50%化肥+生石灰(OM50+Lime)的施用方式,可弥补单施有机肥或石灰的不足,施用后土壤pH比对照显著提高1.10,土壤盐基饱和度显著提高114.01%。罗玲等[10]研究表明,有机肥和石灰混施可提高土壤pH 0.38,土壤有机质、有效磷和碱解氮含量提高62.01%~78.38%,盐基饱和度提高13.37%,与本研究结果相似。Yuan等[12]研究表明,生物质炭中含有的碳酸盐,以及生物质炭表面丰富的-COO-(-COOH)和-O-(-OH)等含氧官能团,能与土壤中的致酸离子结合,从而提高土壤pH。另外,生物质炭改酸效果随着施用量的增加而增强[25]。本研究中,OM50+BC10改酸效果不明显,但随着施用量的增加,OM50+BC20和OM50+BC40处理的土壤pH分别显著增加了0.49和0.68,表明随着生物质炭施用量的增加,改酸效果也呈现出增强的趋势,这与前人研究结果一致。此外,随着生物质炭用量的增加,土壤有机碳含量也增加。其原因可能是生物质炭具有高度芳香性的碳组分,碳氮比较高,在土壤中不易被微生物降解,有利于土壤有机碳的积累[26]。
3.2 不同处理对酸化茶园土壤微生物的影响
邓玉峰等[27]研究发现,石灰能增强土壤微生物对碳源和氮源的利用能力,进而增加土壤微生物量碳和微生物量氮含量。本研究发现,OM50+Lime处理虽然对碳源利用的总体能力高于对照,但低于生物质炭处理(NPK+BC10、OM50+BC10、OM50+BC20、OM50+BC40),表明生物质炭处理在提高土壤微生物代谢能力和竞争能力方面比石灰处理的效果更好。这可能与生物质炭本身的结构和特性相关,生物质炭具有空隙结构和高有机碳固持,能够为土壤微生物提供生长栖息的场所和充足的能源物质,因此能够丰富微生物种群结构,促进微生物数量的增长[28]。真菌/细菌的比例可表征农田土壤生态系统的稳定性,比值越小,表示土壤生态系统越持续稳定[29]。本研究中,OM50+BC10、OM50+BC20、OM50+BC40处理显著降低了真菌/细菌的比例,说明不同用量的生物质炭处理在短期内可以增加红壤茶园土壤生态系统稳定性。G-/G+的比值可以指示土壤微生物受生理胁迫的程度,G-/G+越小,表示土壤微生物受到环境胁迫越强[30]。本研究中,OM50+Lime处理的G-/G+显著低于对照处理,说明施用生石灰处理的土壤微生物受到的环境胁迫程度比其他处理的要高。
3.3 微生物特征与土壤化学性质之间的相关性
土壤微生物作为土壤生态系统的分解者,对土壤养分循环具有重要作用。土壤微生物参与土壤碳氮循环和土壤矿化过程,与土壤有机碳关系密切[31]。本研究表明,SOC是影响微生物群落结构的最重要因子,AWCD、总磷脂脂肪酸、细菌、G+和G-都与土壤有机碳含量呈显著正相关,这与前人研究结果一致[32-33]。另外,土壤酸度也是影响土壤微生物群落的重要因子[34]。本研究表明,G+与土壤pH、交换性Al3+有显著的相关性。Wong等[35]发现,酸化土壤改良后随着土壤pH的升高土壤微生物活性也有所提高,土壤微生物量和多样性增加,与本研究结果一致。
几种改良方式中,OM50+Lime能显著提高土壤pH和盐基饱和度,但会对土壤微生物群落环境产生不利影响。OM50+BC20和OM50+BC40处理不仅能够显著提高土壤pH、盐基饱和度和土壤孔隙度,还能显著提高土壤微生物活性、微生物群落物种丰富度、多样性和均一性,能够在短期内增加红壤茶园土壤生态系统稳定性。综上所述,OM50+Lime、OM50+BC20和OM50+BC40处理对酸化茶园土壤有较好的改良效果,且OM50+BC20和OM50+BC40处理对土壤微生物群落性质方面的改良效果更佳。生物质炭施用量越大,成本越高。因此,综合考虑改良效应及成本,OM50+BC20为最佳改良方案。
[1] 中华人民共和国统计局. 中国统计年鉴2020[M]. 北京: 中国统计出版社, 2021.
National Bureau of Statistics of China. China Statistical Yearbook 2020 [M]. Beijing: China Statistical Publishing House, 2021.
[2] Han W, Kemmitt S J, Brookes P C. Soil microbial biomass and activity in Chinese tea gardens of varying stand age and productivity [J]. Soil Biology & Biochemistry, 2007, 39: 1468-1478.
[3] Li Y C, Li Z, Li Z W, et al. Variations of rhizosphere bacterial communities in tea (L.) continuous cropping soil by high-throughoput pyrose-quencing approch [J]. Journal of Applied Microbiology, 2016, 121: 787-799.
[4] Li Y C, Li Z W, Arafat Y, et al. Studies on fungal communities and functional guilds shift in tea continuous cropping soils by high-throughput sequencing [J]. Annals of Microbilogy, 2020, 70: 7. doi: 10.1186/s13213-020-01555-y.
[5] 于宁, 关连珠, 娄翼来, 等. 施石灰对北方连作烟田土壤酸度调节及酶活性恢复研究[J]. 土壤通报, 2008, 39(4): 849-851.
Yu N, Guan L Z, Lou Y L, et al. Lime application regulates soil acidity and restores enzyme activities in the fields cultivated continuously with tobacco, Northern China [J]. Chinese Journal of Soil Science, 2008, 39(4): 849-851.
[6] 唐莉娜, 熊德忠, 张永成, 等. 酸性土壤施石灰对烟稻轮作后效的影响[J]. 福建农林大学学报(自然科学版), 2002, 31(4): 517-520.
Tang L N, Xiong D Z, Zhang Y C, et al. Residual effect of lime application on farming system of tobacco-rice in acid soil [J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2002, 31(4): 517-520.
[7] 龙光强, 蒋瑀霁, 孙波. 长期施用猪粪对红壤酸度的改良效应[J]. 土壤, 2012, 44(5): 727-734.
Long G Q, Jiang Y J, Sun B. Effects of long-term application of pig manure on ameliorating acidity of red soil [J]. Soils, 2012, 44(5): 727-734.
[8] 徐仁扣. 土壤酸化及其调控研究进展[J]. 土壤, 2015, 47(2): 238-244.
Xu R K. Research progresses in soil acidification and its control [J]. Soils, 2015, 47(2): 238-244.
[9] 孟红旗, 吕家珑, 徐明岗, 等. 有机肥的碱度及其减缓土壤酸化的机制[J]. 植物营养与肥料学报, 2012, 18(5): 123-130.
Meng H Q, Lü J L, Xu M G, et al. Alkalinity of organic manure and its mechanism for mitigating soil acidification [J]. Plant Nutrition and Fertilizer Science, 2012, 18(5): 123-130.
[10] 罗玲, 潘宏兵, 钟奇, 等. 石灰和有机肥对芒果园酸性土壤的改良效果及对芒果品质的影响[J]. 中国土壤与肥料, 2021(3): 169-177.
Luo L, Pan H B, Zhong Q, et al. Effects of lime and organic fertilizer on acid soil of mango plantation and mango quality [J]. Soil and Fertilizer Sciences in China, 2021(3): 169-177.
[11] 张阿凤, 潘根兴, 李恋卿. 生物黑炭及其增汇减排与改良土壤意义[J]. 农业环境科学学报, 2009, 28(12): 2459-2463.
Zhang A F, Pan G X, Li L Q. Biochar and the effect on C stock enhancement, emission reduction of greenhouse gases and soil reclaimation [J]. Journal of Agro-Environment Science, 2009, 28(12): 2459-2463.
[12] Yuan J H, Xu R K. The amelioration effects of low temperature biochar generated from nine crop residues on an acidic Ultisol [J]. Soil Use and Management, 2011, 27: 110-115.
[13] 吴志丹, 尤志明, 江福英, 等. 生物黑炭对酸化茶园土壤的改良效果[J]. 福建农业学报, 2012, 27(2): 167-172.
Wu Z D, You Z M, Jiang F Y, et al. Ameliorating effect of biochar on acidity of tea garden soil [J]. Fujian Journal of Agricultural Sciences, 2012, 27(2): 167-172.
[14] 王义祥, 辛思洁, 叶菁, 等. 生物炭对强酸性茶园土壤酸度的改良效果研究[J]. 中国农学通报, 2018, 34(12): 108-111.
Wang Y X, Xin S J, Ye J, et al. Improvement effect of biochar on soil acidity in strong acidity tea garden [J]. Chinese Agricultural Science Bulletin, 2018, 34(12): 108-111.
[15] 王义祥, 黄家庆, 叶菁, 等. 生物炭对酸化茶园土壤性状和真菌群落结构的影响[J]. 茶叶科学, 2021, 41(3): 419-429.
Wang Y X, Huang J Q, Ye J, et al. Effects of biochar application on soil properties and fungi community structure in acidified tea gardens [J]. Journal of Tea Science, 2021, 41(3): 419-429.
[16] 李艳春, 李兆伟, 林伟伟, 等. 施用生物质炭和羊粪对宿根连作茶园根际土壤微生物的影响[J]. 应用生态学报, 2018, 29(4): 1273-1282.
Li Y C, Li Z W, Lin W W, et al. Effects of biochar and sheep manure on rhizospheric soil microbial community in continuous ratooning tea orchards [J]. Chinese Journal of Applied Ecology, 2018, 29(4): 1273-1282.
[17] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
Lu R K. Soil and agricultural chemistry analysis [M]. Beijing: China Agricultural Science and Technology Press, 2000.
[18] Wu L K, Li Z F, Li J, et al. Assessment of shifts in microbial community structure and catabolic diversity in response tomonoculture [J]. Applied Soil Ecology, 2013, 67(5): 1-9.
[19] 刘波, 胡桂萍, 郑雪芳, 等. 利用磷脂脂肪酸(PLFAs)生物标记法分析水稻根际土壤微生物多样性[J]. 中国水稻科学, 2010, 24(3): 278-288.
Liu B, Hu G P, Zheng X F, et al. Analysis on microbial diversity in the rhizosphere of rice by phospholipid fatty acids biomarkers [J]. Chinese Journal of Rice Science, 2010, 24(3): 278-288.
[20] 杨宇虹, 陈冬梅, 晋艳, 等. 不同肥料种类对连作烟草根际土壤微生物功能多样性的影响[J]. 作物学报, 2011, 37(1): 105-111.
Yang Y H, Chen D M, Jin Y, et al. Effects of different fertilizers on functional diversities of microbial flora in rhizospheric soil of monoculture tobacco [J]. Acta Agronomica Sinica, 2011, 37(1): 105-111.
[21] 宁川川, 王建武, 蔡昆争. 有机肥对土壤肥力和土壤环境质量的影响研究进展[J]. 生态环境学报, 2016, 25(1): 175-181.
Ning C C, Wang J W, Cai K Z. The effects of organic fertilizers on soil fertility and soil environmental quality: a review [J]. Ecology and Environmental Sciences, 2016, 25(1): 175-181.
[22] 张永春, 汪吉东, 沈明星, 等. 长期不同施肥对太湖地区典型土壤酸化的影响[J]. 土壤学报, 2010, 47(3): 465-472.
Zhang Y C, Wang J D, Shen M X, et al. Effects of long-term fertilization on soil acidification in Taihu lake region, China [J]. Acta Pedologica Sinica, 2010, 47(3): 465-472.
[23] 解开治, 徐培智, 严超, 等. 不同土壤改良剂对南方酸性土壤的改良效果研究[J]. 中国农学通报, 2009, 25(20): 160-165.
Xie K Z, Xu P Z, Yan C, et al. Study the effects of soil improvement on acid soil in the South of China [J]. Chinese Agricultural Science Bulletin, 2009, 25(20): 160-165.
[24] 胡敏, 向永生, 鲁剑巍. 石灰用量对酸性土壤酸度及大麦幼苗生长的影响[J]. 中国农业科学, 2016, 49(20): 3896-3903.
Hu M, Xiang Y S, Lu J W. Effects of lime application rates on soil acidity and barley seeding growth in acidic soils [J]. Scientia Agricultura Sinica, 2016, 49(20): 3896-3903.
[25] 李九玉, 赵安珍, 袁金华, 等. 农业废弃物制备的生物质炭对红壤酸度和油菜产量的影响[J]. 土壤, 2015, 47(2): 334-339.
Li J Y, Zhao A Z, Yuan J H, et al. Amelioration effects of crop residue-derived biochars on soil acidity and canola yield in red soil [J]. Soils, 2015, 47(2): 334-339.
[26] 周桂玉, 窦森, 刘世杰. 生物质炭结构性质及其对土壤有效养分和腐殖质组成的影响[J]. 农业环境科学学报, 2011, 30(10): 2075-2080.
Zhou G Y, Dou S, Liu S J. The structural characteristics of biochar and its effects on soil available nutrients and humus composition [J]. Journal of Agro-Environment Science, 2011, 30(10): 2075-2080.
[27] 邓玉峰, 田善义, 成艳红, 等. 模拟氮沉降下施石灰对休耕红壤优势植物根际土壤微生物群落的影响[J]. 土壤学报, 2019, 14(21): 1-11.
Deng Y F, Tian S Y, Cheng Y H, et al. Effects of liming on rhizosphere soil communities of dominant plants in fallowed red soil under simulated nitrogen deposition [J]. Acta Pedologica Sinica, 2019, 14(21): 1-11.
[28] 何玉亭, 王昌全, 沈杰, 等. 两种生物质炭对红壤团聚体结构稳定性和微生物群落的影响[J]. 中国农业科学, 2016, 49(12): 2333-2342.
He Y T, Wang C Q, Shegn J, et al. Effects of two biochars on red soil aggregate stability and microbial community [J]. Scientia Agricultura Sinica, 2016, 49(12): 2333-2342.
[29] 孙凤霞, 张伟华, 徐明岗, 等. 长期施肥对红壤微生物生物量碳氮和微生物碳源利用的影响[J]. 应用生态学报, 2010, 21(11): 2792-2798.
Sun F X, Zhang W H, Xu M G, et al. Effects of long-term fertilization on microbial biomass carbon and nitrogen and on carbon source utilization of microbes in a red soil [J]. Chinese Journal of Applied Ecology, 2010, 21(11): 2792-2798.
[30] 陈法霖, 张凯, 王芸, 等. 引进种桉树人工林取代天然次生林对土壤微生物群落结构和功能的影响[J]. 生态学报, 2018, 38(22): 8070-8079.
Chen F L, Zhang K, Wang Y, et al. Impacts of converting natural secondary forests to exoticplantations on structure and function of soil microbial communities [J]. Acta Ecologica Sinica, 2018, 38(22): 8070-8079.
[31] Cavagnaro T R, Cunningham S C, Fitzpatrick S. Pastures to woodlands: changes in soil microbial communities and carbon following reforestation [J]. Applied Soil Ecology, 2016, 107: 24-32.
[32] 谷晓楠, 贺红士, 陶岩, 等. 长白山土壤微生物群落结构及酶活性随海拔的分布特征与影响因子[J]. 生态学报, 2017, 37(24): 8374-8384.
Gu X N, He H S, Tao Y, et al. Soil microbial community structure, enzyme activities, and their influencing factors along different altitudes of Changbai Mountain [J]. Acta Ecologica Sinica, 2017, 37(24): 8374-8384.
[33] 李明, 赵建宁, 秦洁, 等. 氮素添加对贝加尔针茅草原土壤团聚体微生物群落的影响[J]. 生态学报, 2021, 41(3): 1127-1137.
Li M, Zhao J N, Qin J, et al. Effects of nitrogen addition on microbial community in soil aggregates ofSteppe in Inner Mongolia, China [J]. Acta Ecologica Sinica, 2021, 41(3): 1127-1137.
[34] Shen C, Xiong J, Zhang H, et al. Soil pH drives the spatial distribution of bacterial communities along elevation on Changbai Mountain [J]. Soil Biology and Biochemistry, 2012, 57: 204-211.
[35] Wong M T F, Nortcliff S, Swift R S. Method for determining the acid ameliorating capacity of plant residue compost, urban waste compost, farmyard manure and peat applied to tropical soils [J]. Communications in Soil Science and Plant Analysis, 1998, 29: 2927-2937.
Ameliorative Effect of Several Measures on Soil Physicochemical Properties and Microbial Community Structures in Acidified Tea Gardens
LI Yanchun1, WANG Hang3, LI Zhaowei3, YE Jing1, WANG Yixiang1,2*
1. Agricultural Ecology Institute, Fujian Academy of Agricultural Sciences, Fujian Key Laboratory of Agricultural Ecological Process of Red Soil Mountain, Fuzhou 350013, China; 2. Soil and Fertilizer Institute, Fujian Academy of Agricultural Sciences, Fuzhou 350013, China; 3. College of life Science, Fujian Agricultural and Forestry University, Fuzhou 350002, China
Acidification of tea garden soil is an important factor that restricts sustainable production of tea plants. Field plot experiments were conducted to study the effects of several improvement measures on acidified tea soils, which would provide scientific basis to improve the soil quality. The experiment involved several treatments: (1) pure chemical fertilizer (routine fertilization, NPK), (2) chemical fertilizer plus 10 t×hm-2biochar (NPK+BC10), (3) organic manure substituted 50% of chemical fertilizer (OM50), (4) organic manure substituted 50% of chemical fertilizer plus lime (OM50+Lime), (5) organic manure substituted 50% of chemical fertilizer plus 10 t×hm-2biochar (OM50+BC10), (6) organic manure substituted 50% of chemical fertilizer plus 20 t×hm-2biochar (OM50+BC20), and (7) organic manure substituted 50% of chemical fertilizer plus 40 t×hm-2biochar (OM50+BC40). After two years of continuous application, soil samples were taken to determine the soil acidity, the nutrient contents, and the microbial community. The microbial community structure was measured using phospholipid fatty acid (PLFA) and Biolog technology.Compared with NPK, soil pH were significantly increased by 1.10, 0.49 and 0.68 units, and base saturation were significantly increased by 114.01%, 55.92% and 58.62% in OM50+Lime, OM50+BC20, and OM50+BC40 treatments, respectively. Compared with NPK, soil organic carbon contents under OM50+BC10, OM50+BC20 and OM50+BC40 treatments were significantly increased by 29.68%, 41.04% and 59.37%, respectively. All treatments had no significant effect on soil nitrate nitrogen content, while the ammonium nitrogen contents under OM50, OM50+BC20 and OM50+BC40 treatments were significantly increased by 40.27%, 44.77% and 41.77% compared with NPK. NPK+BC10, OM50+BC10, OM50+BC20 and OM50+BC40 significantly increased soil microbial activity, species richness, diversity and homogeneity of microbial community. OM50+BC10, OM50+BC20 and OM50+BC40 treatments significantly reduced the ratios of fungi to bacteria, indicating that they increased the stability of soil ecosystem in the short term. The ratio of gram-negative bacteria to gram-positive bacteria under OM50+Limetreatment was significantly lower than that under NPK, which indicates that soil microorganism under OM50+Lime suffered the greater environmental stress than that under other treatments.In summary, OM50+Lime, OM50+BC20 and OM50+BC40 had obvious improvement effect on acidified tea garden soil, while OM50+BC20 and OM50+BC40 had better improvement effect on soil microbial community properties than OM50+Lime. Simultaneousconsidering ameliorative effect and costof economy, OM50+BC20 was the best improvement scheme.
tea gardensoils, acidification, soil microbial community, biochar, lime, organic manure
S571.1
A
1000-369X(2022)05-661-11
2022-02-17
2022-03-30
中央引导地方科技发展专项(2021L3021)、福建省科技厅公益项目(2022R1021003)、福建省农业科学院项目(GJPY2019006、ZYTS2021007、XTCXGC2021010)
李艳春,女,助理研究员,主要从事生态农业方面的研究,lyc7758@163.com。*通信作者:sd_wolong@163.com
