柑橘属植物分泌囊形态建成的研究进展
2022-10-31白玫,吴鸿
白 玫,吴 鸿
(华南农业大学 生命科学学院/华南农业大学 药用植物研究中心, 广东 广州 510642)
分泌囊是柑橘属Citrus植物普遍具有的结构特征,除根之外,它广泛分布于植物体的茎、叶、花和果实中[1-2]。它是柑橘属植物黄酮类和挥发油类等重要药用成分的合成和储存的主要场所[3-4]。同时其起源和发育方式也是研究植物分类和演化的重要形态学特征。百年以来,研究者对柑橘属近20种(品种)植物的分泌囊进行了大量的研究,积累了丰富的资料,但在分泌囊起源和发生方式一直存在较大的争议,甚至存在彼此矛盾的研究报道,矛盾焦点主要集中在分泌囊发生方式是溶生型[5-16]、裂生型[1,17-24]还是裂溶生型[3,6,16,25-29]。近20年来,细胞学和细胞化学证据更加倾向于柑橘属分泌囊的发生方式属于裂溶生型[3,28],并且支持分泌囊上皮细胞的破毁是典型的细胞程序化死亡(Programed cell death,PCD)过程[29-30]。近年来,有关分泌囊细胞PCD分子调控机制的研究工作更清楚地揭示了柑橘属分泌囊发生方式的本质[31-33]。
1 柑橘属植物分泌囊的起源
最早Martinet[5]认为柑橘属分泌囊起源于表皮细胞的不断分裂。Fohn[7]对柑橘属植物分泌囊的起源和发生的研究认为分泌囊是由表皮下的原始细胞团发育而来。而Bosabalidis等[15-16]对红橘Citrus deliciosa果实分泌囊起源的研究却发现分泌囊起源于1个子房外表皮细胞和与其相对的1个表皮下细胞,这2个细胞相继进行不同方向的分裂,发育形成具有帽区和球区的分泌囊。同样,Bennici等[28]、Liu等[30]发现甜橙Citrus sinensis、柠檬Citrus limon、广佛手Citrus medicaL. var. sarcodactylis Noot. Swingle和化橘红Citrus grandis‘Tomentosa’果实分泌囊起源方式也相同于上述红橘的特征。Liang等[3]认为广佛手果实分泌囊起源于子房壁的1个果皮细胞和1个表皮下细胞。但Knight等[22]认为甜橙果实分泌囊起源于子房外表皮下的1组细胞,Chen等[29]则认为这一组细胞是4~5个细胞。这些原始细胞随后也会进行各个方向的分裂分化形成分泌囊的球区和帽区,帽区细胞小,呈狭长形,位于球区上方,球区的中央细胞体积大,是形成囊腔的主要区域[3,29,31,33-34]。最新研究表明,化橘红分泌囊原始细胞团由果实外果皮表皮及表皮下的7~10个细胞组成,细胞分裂频繁,最终形成球区和帽区[33]。从研究报道来看,柑橘属植物分泌囊的起源方式可能具有多样性,且随植物的种类不同而有所差异。但分泌囊的起源本身是表皮细胞或者薄壁细胞反分化的过程,似乎起源细胞数目越少越接近分泌囊发育的本质[35]。
2 柑橘属植物分泌囊发生方式
分泌囊的发生方式主要有3种,溶生、裂生和裂溶生[13,16,36]。溶生型主要指分泌囊的腔隙是由细胞自溶产生的;裂生型指分泌囊中央细胞壁分离形成细胞间隙,且间隙不断扩大形成的囊腔;而裂溶生型是裂生和溶生相互结合的过程[21]。长期以来,关于柑橘属植物分泌囊腔隙的发生方式存在争议[37]。
早在1872年,Martinet[5]对柑橘属分泌囊研究发现分泌囊腔是其中心细胞的自溶产生的,之后1875年Chatin[38]也支持这一结论。但是随后10年中,柑橘属分泌囊发生方式的研究结论多以裂生型为主[17]。而Haberlandt[16],Tschirch等[17],Sieck[25],Buvat[26],Sprecher[27]和Peterson等[39]则认为分泌囊是由最初的细胞之间的壁溶解分离和随后的细胞溶解而产生腔隙的,也就是裂溶生型分泌囊。关于对柑橘属分泌囊发生方式的不同认识,研究者们也从不同角度对其可能性进行了探讨。Carr等[40]认为分泌囊上皮细胞在切片过程中尤其是石蜡切片过程中容易被人为破坏,不能呈现出更为真实的状态。Fohn[7]用石蜡切片研究柑橘属的分泌囊发生方式为溶生型分泌囊。随着电子显微技术的应用,人们对分泌囊有了更为深入地研究,Heinrich[10]首次利用电子显微镜研究柑橘属分泌囊的发育,他认为分泌囊以溶生型发生是一种自然模式。并且认为当分泌囊腔形成之后围绕囊腔的上皮细胞即无功能后发生自溶,即使是裂生形成的分泌囊的上皮细胞在分泌囊成熟之后也会死亡并且自然溶解[8,41]。然而,随后Thomson等[18]用电子显微镜描述了柑橘Citrus sinensis叶片分泌腔的裂生形成过程,认为柑橘属分泌囊上皮细胞的破毁形成的腔隙的溶生式的发生方式不排除是在制片过程中造成的细胞破毁。这与Heinrich[10-12]对于柑橘的分泌囊溶生型形成的报道相矛盾。然而,Thomson等[18]发现在较老的分泌囊中,围绕囊腔的上皮细胞会发生明显的自然降解,这被认为是上皮细胞在分泌囊发育的后期发生的自溶。Bosabalidis等[15-16]对红橘的研究结果支持柑橘属分泌囊以溶生型方式发生,并且发现是分泌囊中央细胞开始发生自溶。胡正海等[42]通过比较石蜡包埋和树脂包埋的分泌囊,他们得出与Carr等[40]一样的结论,石蜡法导致了对分泌囊溶生型发生方式的误判,而柑橘属分泌囊是以裂生方式发生的。此外,Turner等[20-21]在比较了几种试验方法后认为溶生型发生方式的判断可能是一个错误的结论,这或许是人为制样导致的。这一观点也得到了Knight等[22-23]的支持。Bennici等[28]通过研究甜橙和柠檬的分泌囊发育,表明2种柑橘属植物分泌囊囊腔的发生和扩大都是通过裂生和溶生共同发生的,并且这2个过程是相互重叠的,分泌囊细胞壁分离的时候伴随着细胞的自溶即细胞质结构的紊乱、细胞核的缺失、质壁分离等。随后,Liang等[3]通过对广佛手的分泌囊研究揭示出广佛手果实分泌囊是裂溶生型发生方式,且裂生和溶生是依次发生的,首先在分泌囊发育早期分泌囊中央的几个细胞先出现细胞壁之间的开裂形成裂隙,随后围绕着裂隙的上皮细胞开始发生溶解,随着上皮细胞的切向延长囊腔逐渐扩大,最终形成成熟的分泌囊。在此基础上 Liang等[43]进一步运用纤维素酶和果胶酶细胞化学定位方法研究表明,果胶酶反应产物首先出现在分泌囊原始细胞的中间层,在分泌囊间隙形成期达到高峰,后期逐渐减少;纤维素酶反应产物在分泌囊空腔扩大早期在上皮细胞的细胞壁初生壁中积累,在上皮细胞开始破毁的时候达到高峰。该研究首次从酶细胞化学层面提供了柑橘属果实分泌囊的裂生与溶生重叠的裂溶生发生方式的证据。
3 细胞程序化死亡参与柑橘属植物分泌囊的发育过程
经过一个多世纪对柑橘属分泌囊发生发育的研究,逐渐确定柑橘属分泌囊以裂溶生的方式发生。其中细胞的溶解过程是否属于程序化死亡?这个问题吸引了广泛的关注。在植物中,植物发育过程中的细胞死亡通常涉及PCD[44-46],而植物细胞分化中发生的细胞死亡是发育性PCD[46-52]。
3.1 柑橘属植物分泌囊分泌细胞发育呈现典型的程序化死亡特征
Chen等[29]对甜橙果实分泌囊发育过程中的显微结构和超微结构研究发现,分泌囊形成过程中细胞的破毁表现出典型的程序化死亡特征如细胞核中染色质的凝集、边缘化,细胞核仁和核膜的降解等,脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(Terminal deoxynucleotidyl transferasemediated biotinylated dUTP nick end-labeling,TUNEL)检测的信号出现于分泌囊原始细胞阶段,在上皮细胞核降解的空腔扩大阶段最为明显。
Caspase-3是哺乳动物细胞凋亡的关键执行者,对染色质凝集和DNA断裂至关重要[53-54]。随后,在以柑橘属植物化橘红为材料的研究显示Caspase-3-like参与了分泌囊分泌细胞的PCD过程,Caspase-3-like可能只在一定程度上影响核膜结构的完整性,从而间接促进凋亡细胞中染色质的凝集和核膜的降解[27]。虽然植物没有Caspase-3同源物,但PBA1在植物PCD过程中扮演植物Caspase-3样酶的角色[32,54-58]。最新的研究显示,在化橘红果实分泌囊发育过程中,CgPBA1参与了分泌囊PCD过程中细胞的核降解[32]。
植物PCD发生过程中,细胞核的降解是一个由多种核酸酶协同参与的过程,Sugiyama等[59]基于生化研究推测,在植物细胞PCD中,Ca2+或Mg2+依赖的中性核酸酶先靶向到核中,随后Zn2+依赖的酸性核酸酶在液泡膜裂解后被激活发挥作用。的确,Zheng等[60]通过细胞化学定位技术证实了Ca2+参与了甜橙果实分泌囊细胞凋亡过程,Ca2+的时空定位与细胞核在PCD过程中的形态变化密切相关,在分泌囊细胞凋亡过程中参与了细胞核染色质和核仁降解的调控。随后,Bai等[31]在免疫细胞化学技术基础上进一步证实Ca2+依赖的核酸酶CgCaN直接参与了化橘红果实分泌细胞凋亡过程中细胞核DNA的降解。最新的研究也证实化橘红果实分泌囊发育过程中Zn2+及Zn2+依赖的核酸酶CgENDO1在分泌囊细胞内的动态变化与细胞核的降解具有密切的时空相关性,Zn2+与CgENDO1协同参与了分泌细胞PCD中的细胞核降解的后期过程,其参与的方式是在细胞核降解后期到基本完全降解的阶段,通过在核区域Zn2+的异常募集来激活CgENDO1发挥作用[33]。上述工作为Sugiyama等[59]的前瞻性推测提供了重要的细胞学支撑资料,也为研究植物细胞PCD过程中核酸酶的作用提供了模板。
植物细胞存在细胞壁,发生PCD的细胞分为2类:一类是仅需要降解原生质体形成特殊功能的结构,如导管;另一类是细胞壁和原生质体同时降解消失,如助细胞。而分泌囊分泌细胞的降解就属于后者,需要发生细胞壁的降解。Liang等[43]证实纤维素酶和果胶酶参与了柑橘属果实分泌腔细胞壁的降解。近来,Tong等[34]在以甜橙为研究对象的最新研究中发现果胶酶基因CisPG21和纤维素酶基因CisCEL16参与调控柑橘属果实分泌腔PCD过程中细胞壁的降解。
3.2 柑橘属植物分泌囊发育过程的细胞学特征
目前,柑橘属分泌囊发生发育过程分为原始细胞早期、原始细胞中期、原始细胞晚期、腔隙形成期、空腔扩大期和成熟期。柑橘属分泌囊起源于子房壁表皮及表皮下几个细胞[3,29,33],细胞大小不等,排列紧密,进行各个方向的分裂形成分泌囊原始细胞团,此时为原始细胞早期,分泌细胞细胞核位于细胞中央,核膜、核仁清晰,核质浓厚,仅具有小液泡,个别细胞的细胞壁发生膨胀,开始积累果胶酶,该时期有少量的Ca2+依赖的核酸酶和极少量的Zn2+依赖的核酸酶聚集在细胞内[31,33-34]。随着原始细胞团的进一步分化,形成由帽区和球区组成的分泌囊的典型结构,即为分泌囊原始细胞中期[31,33-34]。帽区近外表皮,细胞狭长且较小,球区是形成囊腔的区域,中央几个细胞体积较大且为多角形,细胞排列紧密,细胞壁膨胀加剧,细胞质浓厚,细胞核清晰,但出现染色质凝集,该时期有大量的Ca2+依赖的核酸酶和少量的Zn2+依赖的核酸酶聚集在细胞内,尤其是凝集的染色质和核仁上[31,33-34]。随着分泌囊的继续发育,帽区和球区结构分化更为明显,但组成细胞的结构并没有可见的变化,此时分泌囊进入原始细胞后期。分泌囊球区中央细胞的细胞核边界模糊不清,核仁模糊、形状不规则,核膜出现部分区域模糊不清甚至降解状,染色质凝集边缘化加剧,细胞核中Ca2+依赖的核酸酶急剧减少,但是却聚集了大量的Zn2+依赖的核酸酶[31,33-34]。到腔隙形成期,此时最大的特征是分泌囊球区中央的几个细胞相邻的角隅处出现小腔隙,围绕囊腔的最内层上皮细胞的核已基本呈降解状态,染色体、核仁、核膜消失,残留的细胞核区域内无Ca2+依赖的核酸酶,而积累大量的Zn2+依赖的核酸酶[31,33-34]。该时细胞壁中层沉积大量的果胶酶,纤维素酶物质也开始出现在上皮细胞的细胞壁中[41]。随着分泌囊腔不断变大,分泌囊发育进入到空腔扩大期。该时腔隙周围上皮细胞形成明显的大液泡,其细胞形态也变得不规则,在围绕囊腔的最内层上皮细胞中,细胞核已完全降解,胞内有大量小泡,细胞壁膨大形成泡状结构,细胞内外及细胞壁处均无Ca2+依赖的核酸酶和Zn2+依赖的核酸酶[31,33-34]。果胶酶继续积累于细胞壁中层以降解中层,同时纤维素酶开始大量地聚集于细胞壁中降解细胞壁[41],最终细胞发生破毁,腔隙进一步扩大形成20~30个细胞围绕的腔,进而发育为成熟的分泌囊(图1)。
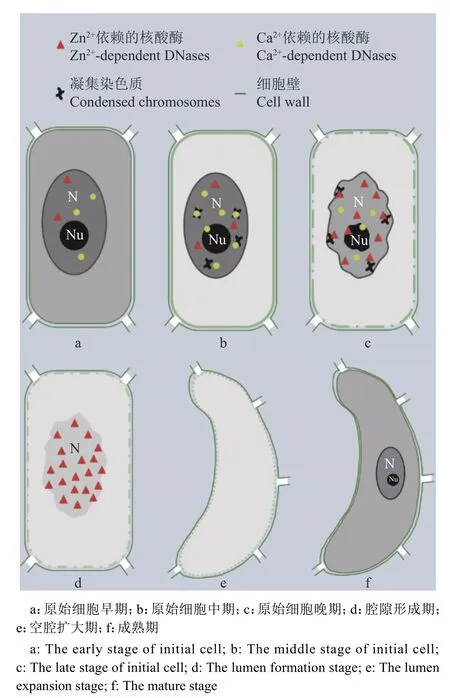
图1 柑橘属分泌囊发育过程模式图Fig. 1 Secretory cavity development model in Citrus
上述研究清楚表明,在分泌囊细胞凋亡的过程中,DNA断裂与细胞壁降解都是PCD过程中的重要事件。两者精细协调的生物学机制值得深入研究。
4 结论与展望
目前的研究表明,柑橘属分泌囊以裂溶生方式发生,其中球区中央细胞以及形成囊腔后的上皮细胞的降解属于典型的PCD过程。目前研究显示许多植物蛋白酶参与了细胞凋亡过程,但是由于体内的具体作用位点并不清楚,真正的作用机制难于掌握[44],植物发育性PCD研究的机制还不完全清楚。由此看来分泌囊发育过程中的PCD研究或许可以作为研究植物发育性PCD的模板,如多种核酸酶如何在时空上相互协同参与植物发育PCD,有何调控转录因子参与其中;PCD过程中类Caspase蛋白酶如何发挥作用参与细胞核的降解和核膜的破毁;分别参与细胞质降解和细胞壁降解的水解酶在分泌囊PCD过程中如何协调发挥作用的等等。相信随着技术和方法的发展,人们将逐渐完善植物分泌囊发育的PCD过程的分子调控网络,也将为全面解析植物发育性PCD机制提供更丰富的科学试验数据。
