植物生物钟抵御生物胁迫研究进展
2022-10-31陈丁豪
黄 巍,李 静,庄 艺,陈丁豪
(亚热带农业生物资源保护与利用国家重点实验室/岭南现代农业科学与技术广东省实验室/华南农业大学 生命科学学院, 广东 广州 510642)
光、温度等环境信号由于地球的自转和公转而呈现出昼夜、季节的周期性变化。生物体进化出了生物钟(Circadian clock)这一内源性计时分子机制以适应外界环境的这种周期性变化[1]。生物钟不仅调控植物的生长发育[2],还参与了植物细胞、分子等层次上新陈代谢的调节,协调植物的抗逆响应等,使植物更好地适应环境[3]。
有研究表明,生物钟可调控植物的免疫反应,这对植物抵御病虫害起到重要作用[4]。植物和动物一样,每天不同时间都会受到各种病原体和昆虫的攻击。虽然植物不能像动物一样在体内产生相关抗体,但植物可以通过多种机制抵御病原体和害虫的入侵。研究表明,生物钟协调免疫系统响应病原体和害虫入侵,从而使生物钟节律紊乱。植物免疫与相关抗病基因的大量转录和翻译离不开关系,尤其是诱导抗性,可能会使得植物突然需要消耗巨大的能量,甚至可能会影响植物正常的生长与发育[5-6]。生物钟帮助植物“预测”侵害发生的时间,使植物提前做好准备,从时间上调控免疫从而实现能量的优化分配[7],这种生物钟和植物先天免疫的相互调节可能对有限资源的重新分配至关重要,能够确保植物的正常生长和发育,以及它们对生物胁迫的及时应答。另一方面,病原体的攻击可以使植物体内的激素、活性氧水平发生变化,这些信号可重置植物生物钟。因此,入侵者与植物之间生物钟调控存在互作,生物钟调控是植物抵御病原体和害虫机制的必要组成部分。
1 植物生物钟与植物免疫
1.1 植物生物钟
植物在生长发育的进程中受到了诸多环境信号的影响与调控,地球自转导致的昼夜变化、地球公转导致的季节性变化等会使得外部环境信号呈现节律性和周期性的变化[8]。植物进化出了生物钟这一复杂的多级调控系统,帮助其预测外界环境周期性的变化,并增强植物的环境适应能力。植物生物钟几乎调控植物所有的生命活动,在双子叶植物中,下胚轴伸长、植株生长、花瓣开闭、叶片震动、气孔开闭都有近24 h的节律。植物的昼夜节律和外界环境变化的周期达时空上的同步,从而增强植物的适应性[9]。
植物生物钟有3个典型的特征,分别为内源性、可驯化性和温度补偿性[10]。内源性是指生物独立于外界环境。即使在恒定环境条件下,植物的生命活动仍保持近24 h周期节律性变化,生物钟系统是由生物遗传得来的,可以使得生物体能够预测外界环境的周期性变化并提前作出应答。可驯化性是指生物钟的振荡周期可受光照、温度等周围环境信号的变化所调控。这些引导植物重置生物钟的外界环境信号(例如光照、温度等)被称为“授时因子”(Zeitgeber,ZT)[11]。温度补偿性是指植物的近日节律的周期长度具有温度补偿现象,即在适当的温度范围内,植物的近似昼夜节律保持稳定[12]。研究人员通常使用余弦曲线来描述一个生物节律事件,以便定量化分析生物钟,主要有周期(Period)、相位(Phase)和振幅(Amplitude) 3个参数[12]。
生物钟是一个十分复杂的网络,一般认为至少由3个部分组成:输入途径(Input pathways)、核心振荡器(Core oscillator)以及输出途径 (Output pathways)[13]。核心振荡器能接收并处理外部环境信号,如环境中的光[14]、温度[15]、湿度[16]等授时因子信号,以及相关信号转导组分,可以通过输入途径重设生物钟;核心振荡器是生物钟的内源“计时器”,核心振荡器将其产生的近24 h的振荡节律传导到输出途径;输出途径是指核心振荡器参与调控的多种生命活动,例如气孔的开合、叶片的运动、生长和衰老、下胚轴伸长、植物激素的合成和代谢、胞质中的离子水平、基因的节律性表达以及植物的抗逆性等,通过维持生物进程近24 h的节律振荡,从而增强植物对环境的适应能力[17],保证自身的生长发育和繁殖。故生物钟的基本运作逻辑如下:授时因子信号通过输入途径被生物钟核心振荡器的组分感知后,进而调控植株在生长、发育、代谢水平产生节律性变化,实现与环境变化的同步。植物可以借助生物钟的调节,对即将到来的环境变化提前做出准备,将对生长发育的负面影响降到最低,同时最大限度地获取和利用资源[1]。
1.2 生物钟调控网络
研究表明,植物生物钟的核心振荡器是一个复杂的分子调控网络,它由多个连锁的转录-翻译反馈环(Transcription-translation feedback loops,TTFLs)组成[18-20]。TTFLs主要由转录抑制子CIRCADIAN CLOCK-ASSOCIATED 1(CCA1)、LHY LATE ELONGATED HYPOCOTYL(LHY)、PSEUDORESPONSE REGULATOR 3(PRR3)、PRR5、PRR7、PRR9、TIMING OF CABEXPRESSION 1(TOC1/PRR1) 、LUX ARRYHTHMO(LUX)、EARLY FLOWERING 3(ELF3)、ELF4等生物钟基因组成[21-23]。其中CCA1、LHY在黎明时刻达到表达高峰,二者形成异源二聚体调控下游基因转录,被称为早晨基因(Morning gene)[23],TOC1在黄昏时刻表达并在夜间发挥功能,LUX与ELF3和ELF4组成的EC复合体 (Evening complex)[24]在午夜时分发挥功能,这些基因被称为傍晚基因(Evening gene)。TTFLs中也有少数转录激活子,例如REVEILLEs(RVEs)、LIGHT-REGULATED WDs(LWDs)、NIGHT LIGHT-INDUCIBL EAND CLOC KREGULATEDs(LNKs)、TEOSINTE BRANCHED1-CYCLOIDEA-PCF20 (TCP20)和TCP22等[25],这些转录激活子集中于黎明前后3 h表达。
植物中第1个被发现的生物钟转录-翻译反馈环由CCA1、LHY和TOC1组成,如图1所示,CCA1和LHY有部分功能冗余,能抑制TOC1的转录[26],而TOC1也可以抑制CCA1/LHY的转录。早晨反馈环基因包括CCA1、LHY、PRR9和PRR7。CCA1/LHY与PRR9/PRR7相互抑制对方的表达,CCA1和LHY抑制自身转录的同时还抑制对方的转录。夜晚反馈环由T O C 1和L U X、E L F 3、ELF4(EC)复合体组成。TOC1抑制LUX和ELF4的转录,而EC复合体则抑制TOC1的表达,EC复合体间接地促进了CCA1/LHY的转录,而CCA1/LHY抑制ELF4和LUX的转录,此外ELF3也受CCA1的负调控。EC复合体抑制PRR7和PRR9,间接缓解后者对CCA1和LHY表达的抑制,RVE8与RVE4能通过招募LNK1和LNK2,形成转录复合体激活PRR5、TOC1等靶基因的转录。随着新的生物钟基因不断被鉴定,新核心生物钟基因的相关研究不断地加入生物钟网络,与已知生物钟基因形成更为复杂的TTFLs调控回路。除转录调控的分子机制以外,生物钟基因还受染色质的重塑、DNA甲基化、组蛋白乙酰化[27]、mRNA前体的可变剪接[28-29]、蛋白质的修饰、蛋白亚细胞定位、蛋白质长距离运输等多个水平的调控。
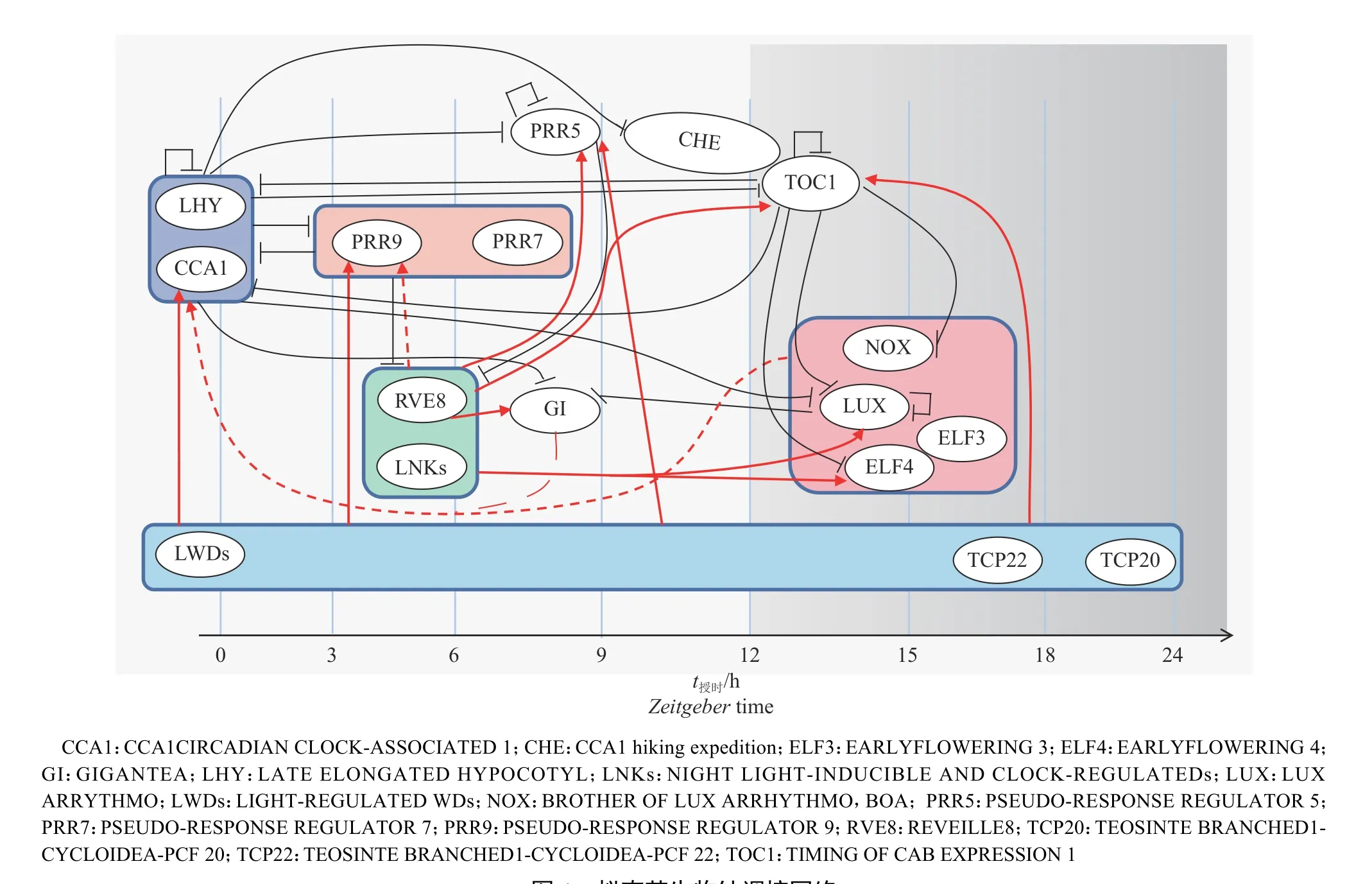
图1 拟南芥生物钟调控网络Fig. 1 The circadian clock regulatory network in Arabidopsis thaliana
综上所述,拟南芥Arabidopsis thaliana的生物钟是由众多转录因子构成的复杂网络,从多个层次发挥功能,调控下游基因的表达,以确保核心振荡器产生近24 h的生物节律。此外,生物钟蛋白的功能缺失或者过表达通常会改变生物钟的周期或者振幅,甚至导致节律的紊乱[3]。生物钟调控拟南芥全基因组中约30%基因的转录,是当之无愧的植物基因表达计时开关[30],从而整合环境和自生代谢信号以响应生物胁迫和非生物胁迫,从而更好地调控植物的生长、发育。
1.3 先天免疫
植物除了通过产生化合物和次生代谢物以抵抗外源病原菌的侵害,也可以在植物叶片表面等部位形成角质或蜡质层作为物理屏障。植物拥有强大的多层先天免疫系统应对其环境中病原体或食草动物的攻击[31]。首先,植物的表面结构为限制病原体进入植物组织内部提供了第1道防线。病原体相关分子模式(Pathogen-associated molecular patterns,PAMP)[32]触发免疫(PAMP -triggered immunity,PTI)在质膜上的模式识别受体,检测到诸如鞭毛蛋白或几丁质等PAMP后被激活[33]。与此同时,病原体反过来又进化出效应物,既可以抑制PTI,导致植物触发效应易感性(Effector-triggered susceptibility,ETS),又可以从植物宿主中获取养分。植物抗性(Resistance,R)蛋白直接或间接检测这些效应物会激活植物中的第2层先天免疫层,称为效应物触发免疫(Effector-triggered immunity,ETI)[4,34-35],ETI紧系超敏反应(Hypersensitivity reaction,HR),使植物细胞发生程序性死亡[36],当植物某些部位被病原物侵染后,在其他部位也产生抗性,简称系统获得性抗性(Systemic acquired resistance,SAR),使植物的整个抗性水平得到增强[37]。先天免疫依赖于宿主植物中的大规模转录重编程,它被复杂的信号网络所激活,该网络受到植物激素茉莉酸(Jasmonic acid,JA)和水杨酸(Salicylic acid,SA)及活性氧(Reactive oxygen species ,ROS)等小分子强烈影响[38]。
2 生物钟调控植物防御
生物钟可以防御多种病害的发生, 生物钟主要通过调控相关抗性基因的表达、激素的合成与转导、活性氧分子和离子稳态以及气孔的开闭等多种生理生化过程的节律性,使得植物对病原体侵害的抵抗能力出现昼夜差异[39]。这种基因表达的昼夜差异被称为生物钟的门控(Gating)效应[37]。生物钟的门控效应可以通过帮助植物“预测”病原侵害的发生,使植物提前做出反应,从时间上调控免疫,从而实现植物对有限资源更好的分配[4,10]。相关示例如图2所示,不同的生物钟基因可以参与抵御不同病原菌和害虫。LHY/CCA1作用于气孔依赖和非气孔依赖的防御,并调控抗性基因的表达。LUX和TIME FOR COFFEE(TIC)会影响ROS产生,从而抵抗病原菌。LUX和CCA1 hiking expedition(CHE)介导SA的合成并激活SAR,而TIC负调控JA合成,二者通过不同的激素参与抵御病虫害。tocl1突变株相比于Col-0表现出了对于丁香假单胞菌Pseudomonas syringae更高的SA诱导的抵抗力。TOC1作用于气孔开闭、ROS响应、以及防御基因的表达。除以上途径外,在烟草Nicotiana tabacum中NaTOC1可影响尼古丁的合成[40],NaLHY/NaCCA1影响叶片挥发物 (Green leaf volatiles,GLV)的合成,从而抵御烟草天蛾Manduca sexta的入侵[41]。研究表明RVE8在拟南芥中可以调控类黄酮和花青素的合成[42],RVE8可能也参与植物防御病虫害。
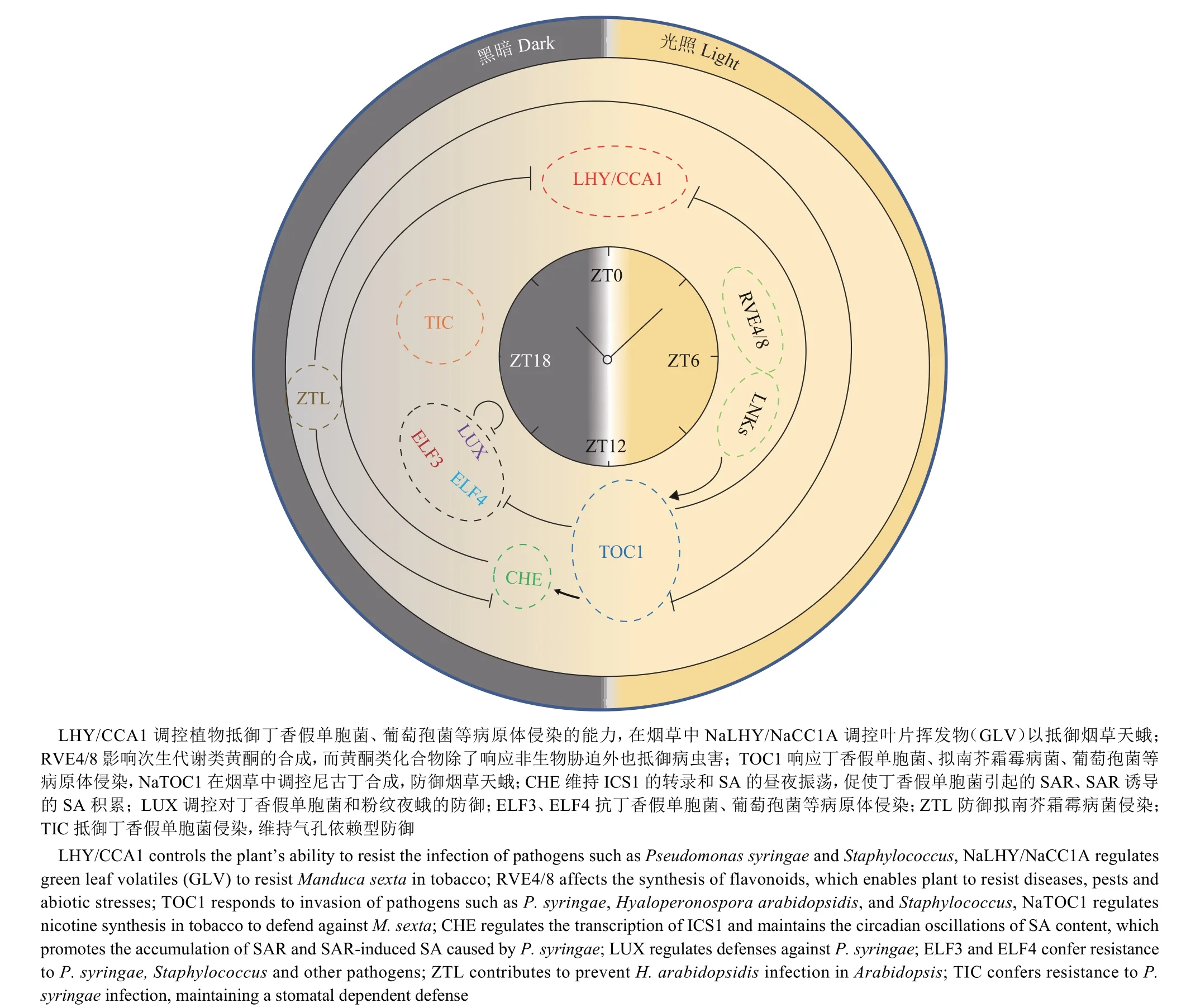
图2 生物钟以不同方式抵抗生物胁迫示例图Fig. 2 The diagram of the circadian clock regulating plant resistance to biotic stresses in different ways
2.1 生物钟影响植物PTI和ETI
生物钟介导P T I进程,主要通过调控FLAGELLIN SENSING2(FLS2)、Mitogen-Activated Protein Kinase Kinase 4(MKK4)/MKK5、Mitogenactivated protein kinase 3(MPK3)、 MPK6和WRKY22的表达来完成。核心振荡器CCA1/LHY可以通过调控R基因的表达影响ETI进程,从而控制免疫响应时间[43-44],CCA1可以在不影响植物生长的情况下通过杂种优势增强植物防御能力[45]。CCA1/LHY间接调控PTI进程,因为其下游基因GRP7显著影响PTI[44,46]。LUX也能影响PTI信号通路中的MPK3、WRKY22和WRKY33的表达[47]。目前研究当中,只发现了CCA1/LHY和LUX对PTI信号通路的调控作用,其他核心振荡器的作用机制尚未解析。除了PTI以外,生物钟还调控ETI,Wang等[43]的一项巧妙的研究表明,生物钟能调控包含核苷酸结合位点和富含亮氨酸重复序列(Leucine-rich repeat,LRR)结构域的基因,CCA1调控RPP4基因介导的霜霉病病菌(Hpa)抗性,是由于RPP4的启动子中富集了CCA1结合基序。这些基因的表达呈现出近日节律,而在ccal突变体中发生了改变。野生型植株对于感染霜霉病病菌的抗性在清晨比黄昏时更强,但cca1突变体则失去了这种时间差异抗性,并在早晨表现出比野生型植株更强的敏感性。而CCA1过表达使植株对该菌株的抗性更强。CCA1同源基因LHY在通过RPP4介导的耐抗性中具有类似的作用[43]。此外,cca1和lhy突变体对能表达avrRpt2效应蛋白的无毒丁香假单胞菌菌株更为敏感,avrRpt2被另一个NBS-LRR蛋白RPS2识别[43]。因此,CCA1(可能还有LHY)可能通过多种R基因介导的途径调控ETI。CCA1对靶基因如RPP4基因、RPP4依赖基因以及其他R基因直接调控。目前其他生物钟核心基因调控ETI还未解析,有待进一步研究。
2.2 生物钟介导水杨酸调控植物免疫
水杨酸(SA)是植物防御病原菌建立植物系统获得抗性的关键激素[48]。SA可以通过多种途径进行合成,其中异分支酸合成酶(Isochorismate synthase 1,ICS1)是SA生物合成通路中的关键酶[48],CHE通过直接结合ICS1基因的启动子促进ICS1的转录,从而影响SA合成,SA和SA前体可以被蛋白ENHANCED DISEASE SUSCEPTIBILITY 5(EDS5)运输到细胞质中进一步修饰并发挥作用。其他蛋白,如Accelerated cell death 6 (ACD6)和EDS1,也会影响SA的积累,但它们的功能尚未完全解析。影响SA合成的主要基因ICS1、EDS1、EDS5和ACD6表达具有昼夜节律,使得SA的合成也有近24 h节律振荡,其含量在夜间达到峰值。LUX也能结合EDS1的启动子,调控SA合成。NONEXPRESSER OF PR GENES 1 (NPR1)是SA受体,虽然NPR1转录水平节律性不强,但NPR1单体积累具有较强生物近日节律,这与SA的含量密切相关[49]。这些研究有力地证明了在无病原体胁迫的条件下,生物钟参与调控SA的合成和信号传导,并且SA可以诱导生物钟基因TOC1的表达。CCA1和LHY的突变降低了对丁香假单胞菌的局部防御能力,但不影响SA的整体生物合成[44],因此CCA1和LHY可能独立于SA发挥防御调控作用。che和lux突变体呈现SAR缺失,LUX和CHE通过调节SA的合成使植物建立SAR。由于SA在植物先天免疫中起着关键作用,因此要确定在生物胁迫条件下,哪些时钟基因对SA的合成和信号转导产生重大影响仍然值得探讨。
2.3 生物钟介导茉莉酸调控植物防御
茉莉酸(JA)是一种脂质衍生物的集合,在植物防御中起着关键作用。JA和SA具有拮抗作用,植物通过JA和SA平衡自生的抗性以防御不同病虫的入侵[50-51]。生物胁迫和损伤会诱导JA快速合成,其中JA类似物茉莉酰基-异亮氨酸(JA-Ile)的活性最强。在JA-Ile缺失的情况下,JA的阻遏物JAZMONATE ZIM-DOMAIN (JAZ)蛋白会结合到转录因子MYC2,从而抑制JA信号转导[52-53]。通过JA-Ile结合受体复合物CORONATINE INSENSITIVE1 (COI1)和JAZ,从而解除对MYC2的抑制,并激活JA信号。
由茉莉酸介导的防御方式受昼夜节律调节[54],JA生物合成关键基因的表达受昼夜节律的影响。JA信号通路关键基因COI1、MYC2和JAZ5的表达依赖于生物钟基因TIC[54]。TIC与MYC2蛋白互作,并抑制MYC2的积累。JA处理tic突变体,其超敏感性依赖于MYC2,这表明TIC作为负调控因子调节JA信号转导。而这种tic突变体也更容易受到丁香假单胞菌感染,这可能是由于增强了JA信号,并抑制了SA信号的结果。LUX直接结合JAZ5的启动子参与调控对JA信号转导[47]。但最近有研究发现,EC复合体能直接与MYC2的启动子结合,从而抑制JA介导的拟南芥叶片衰老,表明生物钟可以直接调节MYC2的转录。
与抵御丁香假单胞菌的防御方式不同,JA及其类似物能激活植物对食草昆虫的防御[47]。如粉纹夜蛾Trichoplusia ni等昆虫在正午时刻进食,植物会对此行为预判,使得JA含量在中午达到高峰。植物生物钟与昆虫进食行为不在同一个相位时,昆虫会啃食更多的植物组织。拟南芥对灰霉菌Botrytis cinerea的抗性也依赖于时间,需要核心生物钟基因和完整的JA信号的参与[38,55]。灰霉菌入侵拟南芥过程中,可根据入侵时间激活一系列不同的防御反应[56]。植物在受病原菌和昆虫入侵时激活定时防御,并依赖于时间,激活针对入侵者的特异性免疫反应。生物钟协同JA信号通路在植物抵御食草昆虫和腐植性真菌病原体方面具有重要意义。
2.4 生物钟调控植物体内活性氧介导植物免疫
ROS是在光合和呼吸作用中产生的小分子化合物[57]。ROS调节细胞和器官的生长和细胞间的信息传递,对植物的发育具有重要作用。ROS的产生也可以在生物和非生物胁迫期间快速和/或大量诱导,这种现象术语称为氧化猝发(Oxidative bursts)[58]。ROS可作为信号分子,通过交联激活防御,强化细胞壁。高浓度时,ROS对宿主细胞和病原体细胞均有毒性,会引起脂质过氧化、蛋白质修饰、核苷酸和细胞膜损伤,最终导致细胞死亡。活性氧的多功能使得平衡植物细胞内活性氧稳态显得尤为重要。
生物钟参与调节活性氧的产生、清除和信号传导。活性氧的主要形式H2O2的基础水平呈现出昼夜节律模式,并在黎明后7 h达到峰值。许多光合基因在黎明后4 h表达量达到峰值,促使H2O2积累[59],这说明活性氧是光合作用副产物。生物钟也控制着ROS相关基因的表达[60]。在拟南芥中,与ROS相关的基因(包括参与ROS产生、清除和信号转导的基因)39%的表达具有节律。这些ROS相关基因的周期表达,在很大程度上依赖于CCA1、ELF3、LUX和TOC1。甚至一些非周期表达的ROS基因也受到这些核心生物钟元件的调节。尤其是CCA1会与一些富含EE(Evening element)和CBS(CCA1 binding site)基序的ROS基因启动子结合。cca1和lhy突变会导致ROS积累,过氧化氢酶活性降低[60]。与CCA1和LHY一样,TTFLs的其他几个组分,包括ELF3、ELF4、LUX、TIC、PRR5、PRR7、PPR9和GIGANTEA(GI),也能调控植物对ROS胁迫的反应[60-61]。综上,多项研究表明生物钟通过CCA1、LHY和LUX等生物钟蛋白调控相关基因的表达,从而影响依赖于活性氧分子的免疫反应。此外,其他生物钟蛋白ELF3、ELF4、TIC、PRR5、PRR7、PPR9和GI也能对ROS应激反应产生门控效应[37]。
最新的研究表明,在缺乏TTFL功能基因的条件下,高度保守的氧化还原蛋白使氧化还原循环持续进行,因此植物对氧化还原的感知可能是独立生物钟。在病原体入侵时,生物钟调控ROS相关基因的表达机制还未解析。但周期性表达的ROS相关蛋白,如过氧化物酶(Peroxidase),也参与植物防御[62-64]。在PTI、ETI和ETS过程中, 不同时间ROS的含量在细胞中分布位置都不相同,这可能是由于ROS合成酶和清除酶活力不同造成的[64]。目前尚不清楚生物钟是否会影响应激条件下ROS分布模式。仍需要进一步的研究来解决这些问题,并深入了解植物-病原体相互作用过程中ROS的昼夜节律调控。
3 结论与展望
生物钟是调控植物先天免疫系统的重要组成部分,对于多层防御反应和广谱抵抗各种病原体和害虫至关重要,是植物通过与病原体和害虫共同进化而获得的一种适应能力,能够预测病原体和害虫攻击,激活定时防御。生物钟协调植物免疫防御病虫害的研究,我们尚处于初级阶段。生物钟调控植物激素的合成与信号转导、活性氧分子的含量以及稳态等多种生理生化过程,使植物抵抗病原菌和昆虫呈现昼夜差异。植物对大多数病原体抵抗能力一般呈现为早晨最强,晚间最弱。
病原菌和昆虫侵染植物时间或者方式发生变化,植物也会进化出防御能力更高的机制,其中包括植物的生物钟重设。病原体的分子模式和效应蛋白以及植物的抗病激素和活性氧分子既是激活免疫系统的关键因子,也在调控植物生物钟方面起重要作用。研究生物钟与植物抗虫性的关系,有利于平衡作物的产量和植物的免疫力,从而寻求更好的作物植株。通过对模式植物拟南芥中生物钟对植物抗虫性影响的研究,目前已经发现了多个关键蛋白及其作用的分子机制。未来将会有更多研究聚焦作物生物钟与植物抗虫性的关系,挖掘新的关键蛋白及其作用机理,深入理解生物钟对于植物抗虫性的生物学意义等重要的科学问题,并将其应用于提高重要经济作物的产量和植物防御中。
目前我们对于植物生物钟与植物免疫关系的研究有了一定的了解,但仍有许多问题并未解决,今后的研究可以关注以下方面:
1)是否有更多的生物钟蛋白参与调控了植物免疫?虽然拟南芥生物钟主要的蛋白已经被发现,但仍然可能有新的生物钟蛋白未被解析,这些潜在的生物钟新成员可能与植物的抗虫性有关;
2)其他的免疫信号对生物钟是否具有调控作用? 虽然已经明确病原体的分子模式和效应蛋白会影响植物的生物钟,但具体的分子机制尚未明确。除了免疫激素和活性氧分子,是否还有其他的信号也能调控植物的生物钟?
3)病原体的生物钟是否在病原体和植物互作的过程中发挥作用? 尽管人们对宿主生物了解很多,特别是在模式植物拟南芥中,但对病原体和害虫生物钟的研究却相对落后。已有研究表明,灰霉病菌的生物钟蛋白Botrytis cinereaFREQUENCY 1(BcFRQ1)可以调控灰霉病菌对于拟南芥的致病性。对于更高等的线虫、昆虫等病原生物的生物钟研究将有助于从病原体角度深入了解生物钟与植物免疫的互作关系;
4)病原体调控植物生物钟的意义是什么? 是有利于病原体的定殖还是有助于植物平衡免疫与生长的关系?有学者提出宿主与病原体共同进化的想法,即病原体、害虫及其宿主的生物钟协调可以塑造有机体水平的相互作用,但缺乏具体的试验支撑,有待后续进一步研究;
5)目前的研究主要聚焦植物叶片生物钟与叶际病原体的互作关系。植物根部生物钟与根际病原体之间是否存在相互作用? 已有研究表明,烟草根部吸收氮元素转化成尼古丁调控烟草的抗虫反应;
6)大多数关于植物生物钟的研究主要以模式植物拟南芥为研究对象,因此对于作物中生物钟与植物抗虫性的研究比较有限,还需后期进一步研究;
7)生物钟对于植物抗虫性的调节作用如何应用在实际的农业生产中,以提高农作物产量和对害虫的抵御能力。
