减数分裂重组的分子遗传机制研究进展及在作物育种中的应用
2022-10-31黄霁月王应祥
黄霁月,王 聪,王应祥,
(1 华南农业大学 生命科学学院/ 岭南现代农业科学与技术广东省实验室,广东 广州 510642; 2 复旦大学 生命科学学院, 上海 200438)
减数分裂是生殖细胞中产生单倍体配子的一种特殊细胞分裂方式,产生的雌雄配子通过受精融合后恢复至二倍体状态,对基因组的稳定性至关重要。同源染色体重组和染色单体的自由组合显著促进了后代的遗传变异。然而,减数分裂重组在染色体上的分布和数量限制了育种进程中的等位基因变异或整合。因此,改变减数分裂重组事件的数量和分布对改善和加快植物育种具有很大的应用潜力。近年来,对植物减数分裂过程和重组的研究取得了很大进展。在模式生物拟南芥Arabidopsis thaliana中,许多参与调控减数分裂染色体重组的因子被发现。模式植物拟南芥的研究显著带动了其他物种(包括水稻、大麦、玉米、小麦和芸苔属植物等)减数分裂的重组机制研究。因此,充分认识植物减数分裂重组的分子遗传基础,并比较不同物种间的共性和特性,再结合现代分子育种技术,可以显著拓展现代生物育种的方法。
1 减数分裂重组模型
1.1 染色质上的重组骨架-牵回环-轴复合物的形成
基于电子显微镜、超分辨率显微镜和免疫荧光技术的应用,主流的观点接受减数分裂染色体重组的起始依赖于一种称为牵回环-轴复合物(Tethered loop-axis complex)的染色质-蛋白质结构模型[1]。首先,在减数分裂前DNA复制完成后形成的姐妹染色单体通过减数分裂特异的黏连蛋白REC8(Cohesin)联系成一体;从细线早期开始,REC8、ASY1和ASY3[2-3]等蛋白质与绑定在其上的DNA 环(DNA-loop)一起形成一个线性的轴,使得结合了REC8的DNA沿着轴的方向排列形成了一个个染色质环(Chromatin loop),统称为牵回环-轴复合物结构(图1)。
1.2 双链断裂形成
在形成的牵回环-轴复合物结构基础上,细胞程序性诱导DNA双链断裂(Double-strand breaks,DSBs)由包含SPO11[4]和MTOPVIB[5]的类DNA拓扑异构酶VI复合物介导产生。植物具有3个编码SPO11的同源基因,其中只有SPO11-3不参与减数分裂[6];而SPO11-1和SPO11-2以异源二聚体构成减数分裂拓扑异构酶复合物的一部分,为诱导减数分裂DSBs所必需[7](图2)。除了SPO11复合物,在酿酒酵母Saccharomyces cerevisiae中还有至少9种包含Spo11在内的DSB相关蛋白,其中Mre11、Rad50、Xrs2、Ski8、Rec102、Rec104、Rec114、Mei4和Mer2能够形成不同的亚复合物,为Spo11产生DSB所必需[8];它们在植物中对应的同源蛋白是AtPRD1、AtPRD2、AtPRD 3、At DFO、OsCR C1、OsSDS和OsP31comet(OsBVF1)[9-12]。酿酒酵母中的研究发现,细胞核内的Spo11蛋白存在2种状态:与染色质不重合的游离态和与轴重合的结合态;DSB主要发生在染色质环内,而大多数对DSB形成至关重要的Spo11辅助蛋白则位于轴上[13],这呼应了牵回环-轴复合物中“牵回”的含义-酿酒酵母中含PHD结构域的Set1复合物成员Spp1能够与染色质环中基因启动子区附近的H3K4me2/3结合,并通过与染色体轴上的Spo11辅助蛋白Mer2互作[13],将染色质环牵回染色体轴上。这是第1次以牵回环-轴复合物结构为基础,解释DSB形成的分子机制的尝试(图1)。植物中鲜见类似的作用机制,但是已有的一些结果也印证了该模型在植物中也可能成立:ChIP-seq结果显示,定位于轴向元件的REC8和DSB结合的染色质区域不同[14];在重组富集的基因区,标记DSB位点的SPO11-1-oligos与ASY1和REC8在全基因组水平无显著的正相关性[14-15]。
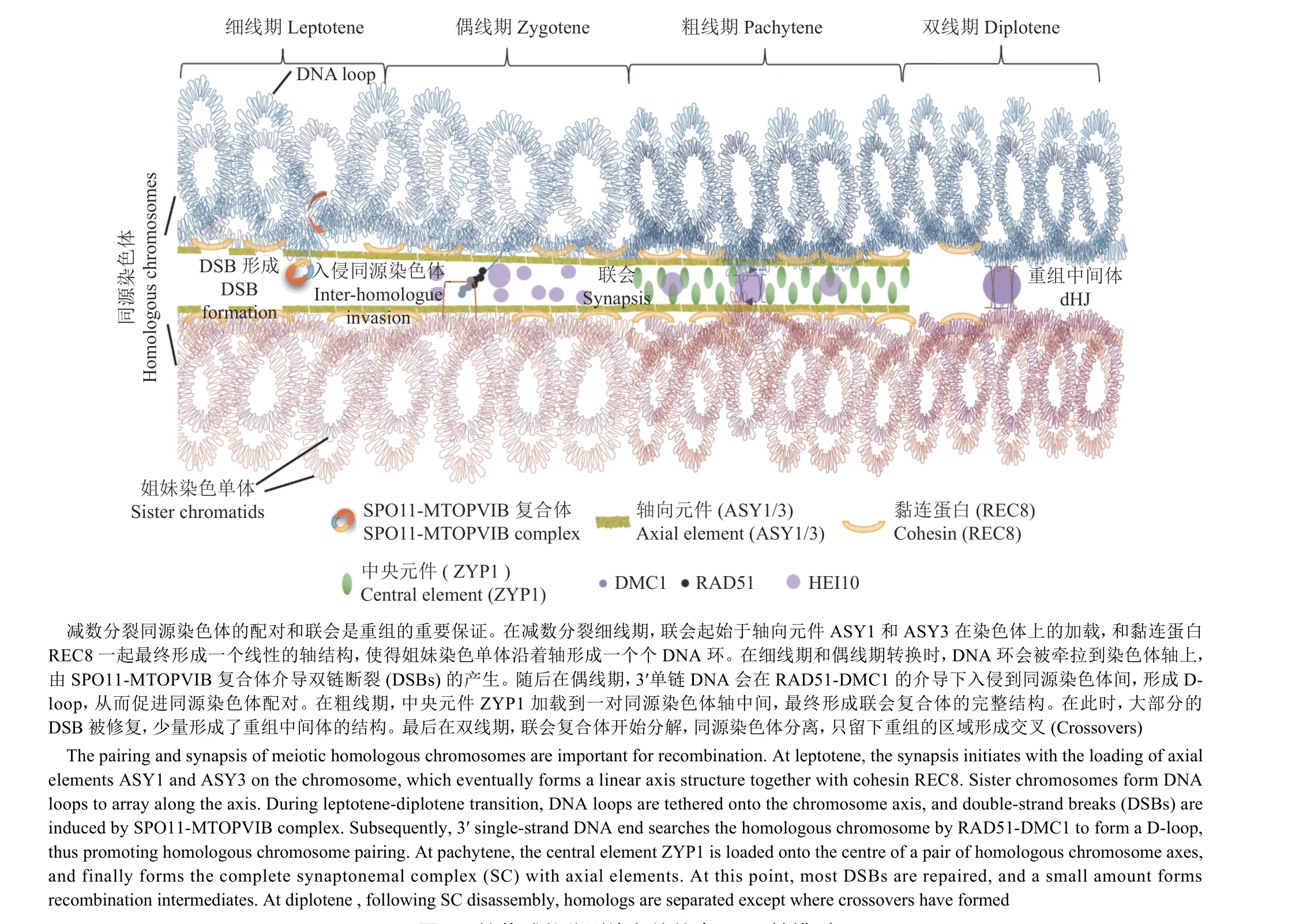
图1 植物减数分裂染色体的牵回环-轴模型Fig. 1 The model of tethered loop-axis of meiotic chromosomes in plant
1.3 双链断裂末端加工
酵母中的工作表明,Spo11在切割DNA双链产生DSB后,通过其酪氨酸残基共价连接在断裂的5′末端DNA上[4,16],如不及时移除将会对后续的修复造成直接阻碍[8]。MRX/N复合物[Mre11-Rad50-Xrs2(Nbs1)]和Com1(Sae2)共同完成DSB处Spo11结合的5′单链末端的移除,从而产生单链的3′末端[8](图2)。在拟南芥中也有这4个基因的同源基因。其中At MRE11、At RAD50和AtCOM1为减数分裂修复所必需[17-18];而AtNBS1突变只显示了轻微的DNA损伤表型,其突变能够加剧DNA损伤相应激酶ATM突变体的表型[19]。此外,水稻中也报道了OsCOM1和OsMRE11具有与拟南芥同源基因相似的功能[20-21]。这表明MRX/N复合物和相关蛋白在DSB末端加工中的功能在真核生物中保守。最后,酿酒酵母中的研究报道了DSB的5′末端被Exo1进一步切除以产生更长的3′单链DNA[22]。并且这一过程也受到DNA末端切除辅助因子9-1-1复合物的作用[23-24]。
1.4 单链入侵
游离裸露的单链DNA很容易成为生物细胞内四处游弋的核酸酶攻击的对象。复制蛋白A(Replication protein A, RPA)是一种保守的单链DNA结合蛋白,可与3'末端单链结合以保护它们免于降解[25]。小鼠中的研究表明,RPA1介导重组酶的招募并参与重组[26]。酵母中的Rpa1蛋白通过消耗ATP招募重组酶Rad51和Dmc1,并替换自己与单链DNA形成核丝,从而入侵同源染色体双链进行同源搜索,形成置换环(Displacement loop,Dloop)结构[27](图1、图2)。与小鼠和酵母不同,植物中的RPA1基因存在多个拷贝,拟南芥中有RPA1a~ RPA1e共5个拷贝[28]、水稻中则有RPA1a、RPA1b和RPA1c共3个拷贝[29],暗示其功能可能发生了分化。现有的研究证实了这种可能,表明PRA1在植物中很可能不参与重组酶招募这一早期重组环节,而是作用于第2末端捕获(Second end capture)这一更晚的过程[30]。

图2 植物减数分裂重组修复途径模型Fig. 2 The model for meiotic recombination in plant
大多数真核生物都具有与细菌DNA修复重组酶RecA同源的2个同源基因RAD51和DMC1[31]。RAD51和DMC1这2个重组酶的功能既有重叠又有差异。前者在有丝分裂和减数分裂中都有参与,而后者只在减数分裂中发挥作用。近年来在拟南芥中的研究工作表明,AtDMC1是同源着丝粒配对所必需的,而AtRAD51为染色体臂配对所必需[32]。丧失了催化活性而保留了RAD51 DNA结合能力的RAD51::GFP融合蛋白能够恢复rad51突变体中的染色体碎片,但却恢复不了dmc1 rad51双突中的染色体碎片,证明了DMC1在正常减数分裂染色体重组中的核心作用;而RAD51起到了DMC1的重要辅助因子的作用[33],这一结果与酵母中的发现一致[34]。BRCA2也是RAD51和DMC1的辅助因子[35]。除了DMC1基因,在脊椎动物和植物中,RAD51基因家族还有高度保守的其他5个成员-RAD51B、RAD51C、RAD51D、XRCC2和XRCC3[36]。小鼠中除DMC1外,其他同源基因的突变都会导致胚胎致死[27]。相反,拟南芥中这7个基因都不影响营养生长[11,37],这为研究该基因家族的功能提供了契机。研究发现RAD51C和XRCC3是RAD51在染色体上定位所必需[38];AtRAD51B、AtRAD51D和AtXRCC2不是减数分裂DSB修复所必需[39];有研究发现AtRAD51B和AtXRCC2在抑制减数分裂重组形成方面有作用[40]。
1.5 双链断裂修复中的DNA合成
广义上讲减数分裂过程中总共发生了2次DNA合成:第1次是在减数分裂前的全局性的DNA复制,使得每条染色体加倍并形成1对姐妹染色单体;第2次是只发生在染色体局部范围对减数分裂重组进程中断裂的DNA进行修复。已有的工作支持前者与有丝分裂的DNA复制类似[41];而后者的具体分子机制在1983年由Szostak等[42]提出重组的双链断裂修复模型,认为断裂的DNA修复是一个利用现成的单链3′末端作为引物进行DNA合成的相对简单的过程,之后30多年来未得到深入探究。尽管期间陆续有研究表明减数分裂重组相关的DNA合成可能会对减数分裂重组或非重组的产生有影响[43-44]。
本研究团队近些年的工作主要通过植物遗传学的手段对该环节进行了一些研究。首先,对拟南芥雄性减数分裂细胞进行转录组测序后发现,许多DNA复制基因,如复制中的前导链和后随链合成因子都有很高的表达量[45],暗示了减数分裂染色体重组相关的DNA合成可能没有模型中想象的那么简单,其可能与有丝分裂DNA复制共享了某些重要的DNA复制因子。这个发现解释了为什么重组修复DNA合成这一环节的研究较为困难的原因,同时也给我们提供了通过创建弱表型突变体或条件型突变体开展研究的一个思路。于是借助拟南芥这个高效的遗传学研究工具,通过获得DNA复制因子营养生长正常的弱突变体或使用DMC1启动子的减数分裂特异性RNA干扰策略,我们发现了DNA复制因子C1(RFC1),DNA复制聚合酶α、δ和ε(Pol α、Pol δ和Pol ε)的突变都显示了重组依赖的染色体碎片,证实了它们都参与了减数分裂重组修复中的DNA合成[46-49](图2)。在DNA复制的模型中,Pol ε是主要的前导链合成酶;Pol α和Pol δ则主要负责后随链(或称为冈崎片段)的合成;RFC1对于增殖细胞核抗原(Proliferating cell nuclear antigen, PCNA)在复制叉处的加载中具有重要作用[50],且对于后随链合成中Pol α的活性和Pol δ替换Pol α完成冈崎片段的合成不可或缺[51]。这一系列的分子遗传证据支持我们提出了一个修订的双链断裂修复模型:减数分裂重组中的双链断裂以类似DNA复制中的前导链和后随链协同合成的形式完成修复。与此同时,我们发现RFC1、Pol α和Pol δ的突变体中重组频率降低[8,39,52];前导链合成聚合酶Pol ε中的突变并没有降低重组率,但其分布发生了改变,暗示了重组干涉发生变化[47]。这些结果与酿酒酵母中后随链合成突变体pol3-ct显示出重组减少与基因转换(Gene conversion)区域变短[53]的结果一致,表明减数分裂重组双链断裂修复中的DNA合成为重组形成所必需,且这一功能是保守的(图2)。
1.6 非交换与交换
DNA合成推动了由DMC1/RAD51入侵同源染色体形成的D-loop结构的拓展,并完成了双链断裂的修复。D-loop这一类重组中间体后续可产生非交换(Non-crossover,NCO)与交换(Crossover,CO)2种类型[54]。虽然在植物减数分裂开始时引入了数百甚至上千个DSB-拟南芥中约200个[55]、水稻中约400个[56]以及小麦中750~1500个[57],但其中只有很小一部分最终发生重组形成交换,其他绝大部分都是以非交换的形式完成修复。非交换与交换由2个相互拮抗的机制决定:一方面,解旋酶FANCM[58]及其辅助蛋白MHF1和MHF2[59]通过一个称为“合成依赖的链退火”过程(Synthesis dependent strand annealing, SDSA)将已经完成了双链断裂区域修复工作的重组中间体解开,从而抑制交换、促进形成非交换[60](图2);同时,另一部分重组中间体进入一个在植物中占85%~90%的被称为干涉敏感型(I型)或者ZMM蛋白依赖的重组途径[61](图2)。顾名思义,该途径依赖于一类统称为Z M M的蛋白[62],在拟南芥中Z M M蛋白由SHOC1[63]、HEI10[64]、ZIP4(SPO22在拟南芥中的同源蛋白)[65]、PTD[63]、MER3[61]、MSH4[66]和MSH5[67]构成。在酵母中已经发现,这些蛋白的同源蛋白主要的作用是结合在同源染色体之间形成的重组中间体上,并稳定后者的结构,比如识别和扩展D-loop的Mer3[68]、稳定双Holliday交叉[42](Double Holliday junction, dHJ)结构的Msh4-Msh5异源二聚体[69]和既结合D-loop又结合dHJ的Zip2(AtSHOC1在酿酒酵母中的同源蛋白)和Spo16(AtPTD在酿酒酵母中的同源蛋白)[70]。ZMM蛋白Zip4是酵母中一种含有四肽重复序列的支架蛋白,可分别与重组中间体中的Msh5、Zip2和Spo16,染色质轴结构中的Red1(AtASY3在酿酒酵母中的同源蛋白),联会复合体中的Emc11和Gcm2[70]以及E3连接酶Zip3(HEI10在酿酒酵母中的同源蛋白)[70]互作,串联起了重组中间体的稳定、联会复合体的组装和交换形成的一系列核心事件[71]。HEI10所在的E3连接酶具有2个主要的亚家族:HEI10/CCNB1IP1和Zip3/RNF212。植物仅编码HEI10家族成员[64],酿酒酵母仅保留Zip3家族成员,而哺乳动物基因组两者都有[72-73]。现有的报道显示,HEI10蛋白量的多少与重组数量呈正相关性[74]。免疫荧光试验显示,在重组早期,HEI10蛋白在联会的染色体上形成很多很小的信号,但到重组晚期则仅存在若干个干涉敏感型重组位点的大信号[75](图1)。此时,HEI10与标记干涉敏感型重组位点的MutL同源蛋白MLH1和MLH3共定位[75]。HEI10信号数量和大小的变化可能暗示其具有2方面的功能:在重组早期拮抗、降解SDSA或其他非重组途径因子[69];在重组晚期起到了解除dHJ的功能。除了ZMM蛋白依赖的重组途径外,还有10%~30%的重组通过非ZMM途径发生[61]。这一小部分重组由于不受重组干涉影响,因此被称为干涉不敏感型(II型)重组。在拟南芥中,这些重组依赖于重组酶MUS81(图2)和FANCD2的2个不完全独立的途径[76]。
2 减数分裂重组的特征
在20世纪初,重组在果蝇中被发现[77],之后不久,一系列重组的特征被陆续报道,如重组干涉的存在可能导致每个细胞的重组频率稳定在一个远低于DSB数量的数字上;重组在染色体上分布不均匀-存在热区和冷区;染色体杂合性与重组位置的相关性;一些组蛋白变体和修饰等染色质特征以及转座子与重组的关系等特征。对这些特征以及背后的分子机制的研究进展详述如下。
2.1 重组干涉与重组频率
通过对动物、植物、真菌等多个物种的研究发现,无论染色体的长度多长,平均每条染色体的重组数量很少会超过3个,酿酒酵母和裂殖酵母Schizosaccharomyces pombe除外[37]。例如:小麦的巨型染色体3B,物理大小约为1 Gb;拟南芥最长的染色体有31 Mb。虽然它们长短悬殊,但是每对同源染色体上平均每次减数分裂都只发生1~3个重组事件。从前文“1.6”可知,这并不是由于DSB数量少造成的。部分原因可以用前文“1.6”中详细介绍的重组和非重组途径的相互拮抗作用来解释;另一部分原因是减数分裂研究中发现的一种古老却未曾解答的现象-重组干涉的结果。重组干涉是一种使染色体上连续的重组(交换)相距的距离比随机预期更远的现象,即一个交换的发生会抑制距离其较近的交换的发生。
近些年,超分辨率显微镜的应用帮助我们能够直接观察到促重组因子如HEI10和MLH1定位于联会复合体的2个轴之间[78](图1);而早前的遗传结果也表明,联会复合体结构蛋白如ASY1/PAIR2和ASY3/PAIR3的突变体会降低重组频率[2-3,79-80],表明联会复合体在重组形成中具有重要的功能(图1)。那么重组干涉是否也和联会复合体结构有关呢?最近,拟南芥中2个独立的针对联会复合体的中央元件-zyp1突变体的研究发现,干涉敏感型重组不仅增加了近60%,而且在染色体上随机分布[78,81]。这一结果表明,重组干涉随着联会复合体中央元件的消失而消失了。有意思的是,虽然总体重组频率增加了,但是仍然能在中期I发现染色体单体[78,81],表明由ZYP1代表的联会复合体不仅与重组干涉的成因有联系,也和每对同源染色体间必需的至少一个重组事件-重组保证(CO assurance)这一现象密切相关。最近的一项在预印本公布的工作更是证明了不仅仅是ZYP1代表的中央元件,轴向元件ASY1同样在重组干涉和重组保证中起作用[82],加强了联会复合体与重组形成之间的紧密联系。
尽管拟南芥zyp1突变体完全丧失了重组干涉,但重组频率只增加了60%左右[78,81],并没有达到DSB数目的水平。表明除了重组干涉,还有其他更关键的因素限制着重组数量。最近的一些证据表明,在没有重组干涉的情况下,限制重组数量的关键因素是HEI10[74,83]-一个属于ZMM蛋白的E3连接酶。拟南芥中,HEI10蛋白的量与重组数目正相关-在HEI10过表达材料中重组数目增加1倍多;在HEI10杂合材料中重组频率降低[74]。更有价值的是,不同HEI10的等位基因可以用来解释拟南芥不同生态型中存在的重组频率的自然变异度[74]。细胞学研究表明,HEI10蛋白在联会的染色体上形成很多很小的信号,但到重组晚期则仅存在于若干个干涉敏感型重组位点,形成大的点信号[64,75]。此时,HEI10与标记干涉敏感型重组位点的MutL同源蛋白MLH1和MLH3共定位[64,75]。上述的这些新发现推动研究人员提出了一种新的重组形成的“粗化”(Coarsening)模型[75]:联会复合体是一种介于固体和液体之间的液晶态结构[84],HEI10蛋白可以通过非耗能的自由扩散形式沿着联会复合体移动;在重组早期,除了在联会复合体上的重组中间体上分布了高密度的HEI10位点外,低浓度的HEI10均匀分布在联会复合体上的其余区域;大HEI10位点(可能是早期联会的区域)的HEI10向外扩散的速度较慢;小HEI10位点的HEI10向外扩散的速度更快;最终导致联会复合体上所有HEI10小位点消失,只保留几个大位点,达到HEI10蛋白运动相对稳定的状态[75](图1)。该模型能够对重组干涉、重组保证、细胞的总体重组频率和联会复合体与重组频率的正相关关系这些特征给予解释,并得到来自线虫的数据支持[85]。其准确性和适用性尚需深入研究,然而其无疑是当前结合了分子细胞遗传学和数学建模绘制的包容性最强的重组模型。
虽然HEI10过度表达会大大提高重组率,但对重组分布无影响[74]。这就涉及到基因组和表观组特征对重组分布的决定作用,详述如下。
2.2 重组热区和冷区
大多数植物都具有重组在染色体上分布不均的特点,构成了染色体上所谓的重组热区和冷区,例如在大麦[86]、小麦[87]、玉米[88]、番茄[89]和大豆[90]等具有大基因组、大重复序列的物种中尤为明显。这些作物在染色体尺度上都有着近端粒端重组率高、近着丝粒端重组率低甚至几乎不发生重组的现象,与基因的分布类似。然而在大多数物种中,重组率降低的速率远大于基因密度下降的速率,导致相当一部分基因位于重组冷区。例如,在大麦和玉米中,大约20%的基因位于重组频率很低的着丝粒周围区域[86];约30%的大豆基因在异染色质区[91],对作物育种产生了相当大的负面影响[92]。
综合相关的研究可以认为,染色质结构、复制时序、基因密度等基因组和表观组特征都可能是决定重组分布的因素[93-97]。拟南芥、马铃薯、小麦和玉米中的研究已经证明重组位点与开放的染色质状态、基因的转录起始位点/终止位点和低水平的DNA甲基化区域正相关[98-102]。然而这些因素的影响不分主次,因为本身这些特征之间就存在一定的正相关性。如,高基因密度与开放的染色质密切相关[103]。尽管如此,最近的一项工作仍然表明基因组特征可以相当准确的方式预测重组分布。该工作使用机器学习方法预测基于17个基因组特征的重组分布,最终发现结合开放染色质(ATAC-seq)、基因密度和CHH DNA甲基化3类数据可以对85%的重组进行准确预测[97]。这3类是在减数分裂发生之前就确定了的基因组特征,暗示了可能在比DSB形成甚至更早的时期,重组在染色体上的分布就已经确定了。
2.3 多态性与重组的关系
多态性与重组的关系目前似乎尚未有确定的结论。拟南芥和小麦中的报道显示,高单核苷酸多态性(Single nucleotide polymorphism, SNP)区域往往拥有较高的重组率[104-105]。然而在小麦与黑麦的杂交种以及不同品种的大麦和番茄的杂种中却相反-高SNP区域拥有较低的重组频率[106-108]。在拟南芥中,更细致的研究表明,重组率随着SNP密度从0到0.5%先增加,然后在SNP密度高于0.5%后降低[109]。最近的一项通过高通量测序检测甲基磺酸乙酯(EMS)诱变造成自交系材料SNP对重组分布的研究发现,多态性位点并非影响重组分布的主要决定因素[97]。
此外,由于大多数植物减数分裂研究主要是在拟南芥和谷类作物等自交或高度近交的材料中开展的,导致现有的重组形成的理论存在一定局限性-对占植物大多数(约 70%)的异交物种的适用性尚需时间观察[110]。例如,在异交的沙地拟南芥A. arenosa种群中,编码序列区在核苷酸水平上的差异约为1.5%[111],在非编码序列区可能差异更大。可以想像在这些高杂合度的物种中,对DSB修复模板序列匹配度的过高要求会使重组失败并最终导致配子不育。因此,减数分裂重组对序列差异性存在较大的容忍度是合理但是仍需深入研究以辨析其作用细节的假说。最后,尽管减数分裂重组可以适应杂合度,但很有可能干涉敏感型与不敏感型2类重组途径对杂合度如SNP的影响存在差异。拟南芥fancm、recq4和figl1单突变体在自交种中增加了干涉不敏感型重组;但在杂交种中没有增加(fancm),或增加幅度很小(recq4,figl1)[60],暗示SNP可能起了抑制干涉不敏感型重组的作用。
2.4 染色质特征和基因组结构与重组的关系
重组与转录基因在基因组染色体上具有相似的分布特征,表现为在常染色质上多、异染色质上少。由于两者结构差异显著,这里将分开讨论。在常染色质区,前文已经介绍了开放染色质、基因密度和CHH DNA甲基化3类数据可以准确预测85%的重组事件,重组事件主要发生在常染色质区[97]。拟南芥中,DSB在具有低核小体占有率且含有开放染色质标记(如H3K4me3的基因5'和3'末端)的区域富集[96]。人类和小鼠中,PRDM9是一种锌指DNA结合蛋白,能够识别人类重组热点中的13 bp DNA基序,起催化H3K4的三甲基化、促进非转录起始位点的DSB形成的作用[112-113]。植物中没有PRDM9蛋白,然而对拟南芥重组热点序列分析发现,CTT、CCN和poly-A这3个基序与重组热点显著关联[99,114](图3),此外还发现组蛋白变体H2A.Z也在重组热区富集[99]。同样的基序后续也在玉米[115]、小麦[116]和番茄[117]中被发现,表明该机制在植物中是保守的。
在异染色质区,已有证据表明,着丝粒和近着丝粒区高度富集的组成型异染色质起了抑制重组的作用[118]。例如,在拟南芥常染色质区的重组热点位置,通过RdDM途径定向引入CHH DNA甲基化后,能将这些区域转化为具有组成型异染色质特征-高DNA甲基化、H3K9me2和低核小体占有率的区域,从而显著降低重组率[98](图3)。DSB发生频率的降低(异染色质区DSB产生率只有常染色质区的约40%)是植物着丝粒和转座子(Transposable element,TE)密集的近着丝粒区成为重组冷区的直接原因。此外也有其他因素起到了关键的作用:有报道显示,拟南芥中H3K9me2和non-CG(CHG和CHH,H代表G、A或T)甲基化缺失的突变体在着丝粒区显示了DSB和重组率的增加[14,95];而CG甲基化转移酶met1突变体中H3K9me2水平不变、CG甲基化丢失导致DSB增加,但在异染色质区重组率降低[95]。由此可知,H3K9me2甲基化可能作用于DSB形成之后的重组环节,在抑制着丝粒和近着丝粒区重组中也扮演了关键的角色 (图3)。
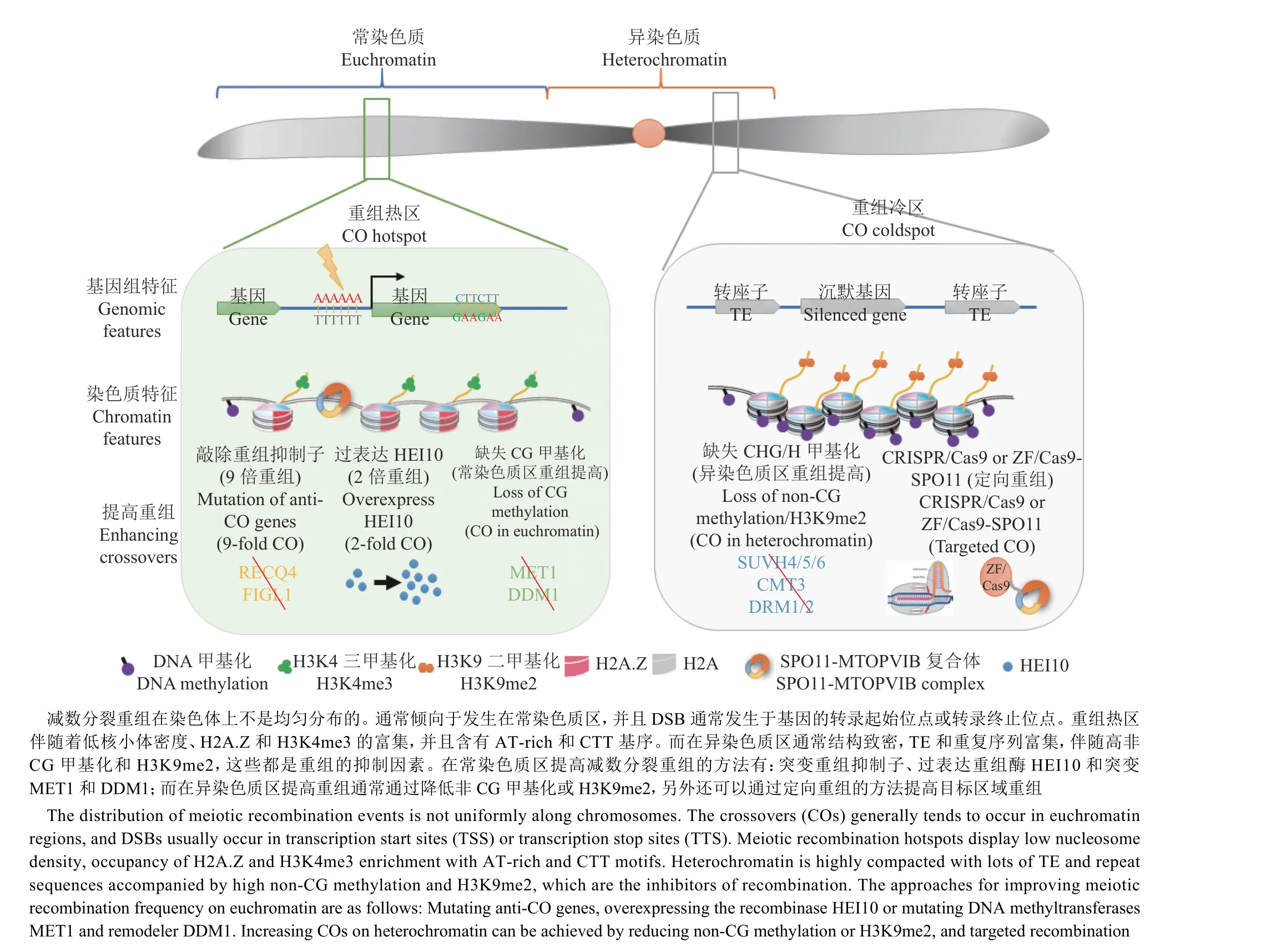
图3 拟南芥减数分裂重组(CO)热点的基因组/染色质特征和调控模型Fig. 3 The model for regulation of Arabidopsis meiotic crossover hotspots by genomic and chromatin features
3 减数分裂重组操纵和应用
近十多年来,我们对植物减数分裂重组和基因组多样性的认知有了很大的进展。DNA测序技术的创新极大地促进了植物基因组遗传和表观遗传信息的探索,使得通过高通量基因分型、连锁和关联分析设计育种方案并加速植物育种成为现实。同一时期,对减数分裂重组的遗传和表观遗传调控机制的认识取得了巨大进展,多个层面的重组调控网络被认识,使得育种可行方案得以扩展。并且研究者们已经在理论或实践中通过操控重组优化作物育种,实现改良作物和杂种优势的固定,这些应用包括重组的遗传操控、无融合生殖、靶向重组等[119-120]。
3.1 提高重组频率
植物杂交育种依赖于减数分裂期同源染色体间遗传物质的相互交换,从而产生新的等位基因组合。杂交可以使优良作物的有利性状组合起来,并消除不利性状。然而,由于自然过程中的重组频率和分布受到限制,具有不可控性,染色体的大部分是不参与遗传交换的,如拟南芥中80%的重组事件只发生在约25%的基因组上[99]。并且在大部分植物中,由于存在重组干涉、重组抑制和染色质结构等多种调控机制,最终重组形成的数目远少于DSB数目[11,37],在育种中的直接后果便是造成连锁拖拽(Linkage drag)现象,延长育种周期并增加获得集合优势性状品种的难度。连锁拖拽是育种中的一种普遍现象,指的是由于某一区域重组频率过低,造成引入一个有利等位基因往往会连锁着另一个不利等位基因。解决该问题的一种方法是增加重组频率。
3.1.1 操纵重组抑制子 减数分裂主要依赖2条重组通路形成交换(图2)[11]。其中1条干涉敏感型(I型)重组主要由ZMM(ZIP1、MSH4、MSH5和MER3)通路介导,并贡献了大部分(85%~90%)重组[65-66];另一条干涉不敏感型(II型)重组通路主要依赖于MUS81[121]和FANCD2[76]。拟南芥中,zmm突变体通常表现为重组数目大量降低而导致的育性大幅降低,但仍然保有一部分育性。因此研究者便可利用这类材料进行正向遗传筛选zmm抑制子,研究抑制重组的机制。通过对zmm抑制子的基因定位和分析,发现存在3条独立的抑制重组形成途径,分别是:DNA解旋酶FANCM和其辅助因子MHF1/2途径[58-59],解旋酶RECQ4A/B、Topoisomerase 3 alpha(TOP3α)和RMI1途径[122-124],以及AAA-ATPase FIGL1(FIDGETIN-LIKE1)和其互作蛋白FLIP途径[31,125],且这3条途径的任何基因突变导致的都是依赖于MUS81的干涉不敏感型重组数量的增加。FANCM是一个DNA解旋酶,作为植物中发现的第1个重组抑制子,其功能在芸苔属、豌豆、水稻和小麦中都保守[126-128]。其突变会导致重组频率在拟南芥中增加3倍[58]、六倍体小麦中增加31%[127],但是在番茄Solanum lycopersicum和生菜Lactuca Sativa中未发现类似重组增加的现象[128-129]。我们的研究发现,FANCM在拟南芥和生菜中都参与影响重组的分布,突变会导致染色单体的产生,降低育性[130]。最近在小麦中的研究支持了这一结果,并证明了FANCM在2个重组途径中都有功能:在干涉敏感型重组通路的第2链捕获中起了促进HEI10定位的促重组因子作用;在干涉不敏感型重组通路中起了解除重组中间体的抑重组因子作用[127]。第2条途径中,敲除RECQ4使水稻、豌豆和番茄等作物在育性正常的前提下重组率增加了3~4倍[128],并且在番茄和大麦中也得到了验证[52,131]。在多个物种中功能稳定并且提高全基因组减数分裂重组频率的一致表现,使得DNA解旋酶RECQ4可以作为通用的加速育种进程的工具。更进一步,拟南芥中的遗传分析表明,集合了RECQ4和FIGL1这2个途径的突变体recq4a recq4b figl1重组率升到最高(约为野生型的9倍),而三重途径都有缺陷的recq4a recq4b figl1 fancm突变体的交叉频率并没有进一步升高,甚至出现减少[60]。因此RECQ4和FLGL1的突变可以作为提高重组频率加快作物育种的最优组合(图3)。
3.1.2 HEI10的剂量效应 HEI10编码一个RINGfinger E3泛素连接酶[64,132],是ZMM蛋白成员,在干涉敏感型重组中发挥重要作用。HEI10的缺失突变会导致重组数目大量减少并伴随育性的降低[64]。前文提到,研究者发现HEI10对于重组的调控有明显的剂量敏感性,即重组的数目和表达量呈正相关关系;表现在hei10杂合突变体中重组数目下降了约25%,而当在野生型背景下表达额外的HEI10会显著提高重组频率(大于2倍)[74]。值得注意的是,HEI10突变对重组分布没有影响-过表达HEI10只会增加常染色质区的重组,而着丝粒附近的重组仍然被抑制[74]。另外,当HEI10过表达和recq4a recq4b突变体组合会发生加性效应,重组频率进一步提升,并且近着丝粒的异染色质区重组频率也提高1.5倍[133]。在突变体recq4a recq4b figl1的背景下,增加HEI10是否仍然会将重组频率提升到一个新的高度?目前不太清楚,但是HEI10的剂量效应可以作为一个有效的育种策略(图3)。
3.1.3 异染色质区重组的激活 异染色质区因富含DNA甲基化、H3K9me2、H2A.W和转座子等特征和结构,抑制了减数分裂重组的发生,是重组冷区(图3)[11]。但是异染色质区也存在很多基因,例如在大麦和玉米中,大约20%的基因位于重组频率很低的着丝粒周围区域[86];约30%的大豆基因在异染色质区[91],该区域等位基因的高度连锁对作物育种产生了相当大的负面影响[92]。同时,低重组频率也会导致有害突变在这些区域累积[134]。
分析维持CG甲基化(DNA甲基化转移酶MET1和染色质重塑因子DDM1)、non-CG甲基化(编码CHG甲基化转移酶CMT3)或催化H3K9me2(H3K9甲基转移酶KYP/ SUVH4、SUVH5、SUVH6)的基因突变体内的DSB和重组位点发现,表观遗传因子影响了重组的频率和分布[95,98,103,135]。在拟南芥中敲除MET1或DDM1基因会引起CG甲基化的丢失。在met1中,重组位点重新分布:增加染色体臂和着丝粒区等重组频率,降低近着丝粒区重组频率[95,103];而在ddm1中,同样会造成染色体臂重组频率增加,但是异染色质区变化不大[135](图3)。研究者还发现,在met1突变体的近着丝粒区和转座子存在的重组冷区中,DSB数量比野生型增加,但重组水平并未提高[95];相比之下,SUVH4/5/6和CMT3突变后都会导致近着丝粒异染色质区重组频率和DSBs水平升高 (图3)。这些结果表明,可以通过敲除催化non-CG甲基化或H3K9me2的表观遗传因子加快作物育种进程,将新的遗传等位基因组合引入到近着丝粒异染色质区(图3)。
3.1.4 其他潜在的调控因子 在水稻中,拟南芥联会复合体横向元件ZYP1在水稻内的同源基因ZEP1的部分失活可使干涉敏感型重组增加1.8倍。然而,ZEP1完全缺失可导致完全雄性不育,但保持雌性育性[136-137]。在拟南芥中,最近的研究发现ZYP1的缺失消除了同源染色体的联会,重组干涉也消失了,突变体中重组数量不仅没有减少反而增加了54%,而且对于育性没有影响[78]。Replication protein A(RPA1a)作为一个单链末端结合蛋白参与到重组过程,保护DSB修复过程中暴露的单链。在水稻中其被发现对限制重组形成至关重要,研究表明RPA1在重组中间体的加工过程中通过与FANCM-BTR复合物的相互作用抑制干涉不敏感型重组[30]。近期,研究者们还在拟南芥中鉴定到了一个新的抑制重组因子:蛋白磷酸酶X1(HCR1/PPX1),其主要抑制干涉敏感型重组,并对干涉不敏感型重组也有影响,其突变后会导致重组频率的升高。其中ZMM途径蛋白HEI10、MSH5和MLH1等可能作为HCR1的直接靶标被调控[138]。但是目前该磷酸酶具体的调控机制和其在其他作物中的作用还不清楚。以上这些基因都可能成为在作物中激活重组、加快育种进程的新靶点。
3.2 降低重组频率/无融合生殖(Apomixis)
杂交产生的后代植物往往比它们的亲本更有活力,这种现象称为杂种优势。在作物应用中,杂交品种通常会因为杂种优势而具有高产的特点,比如水稻、玉米等[139]。然而杂交作物的后代在第2遗传定律的支配下存在遗传和表型的可变性和多样性,无法在后代中稳定保留其优势表型。而新的具有杂种优势的种子需要重新生产获得,这一过程费时费力。因此如何能够高效地固定杂种优势是杂交育种的关键问题。减少重组频率可以作为固定杂种优势的一个途径。但是通常调控重组的基因(如ZMM途径)不仅仅会导致CO数目的大量减少,同时由于CO缺失造成同源染色体之间无法捆绑,还会造成减数第1次分裂过程中同源染色体不等分离,从而导致不育[11,37]。因此单纯的降低重组频率很难应用于农业育种。
无融合生殖,是一种在没有减数分裂和受精作用的情况下,产生与母体基因完全相同的后代,种子或后代可以实现克隆母系的繁殖方式[120]。无融合生殖可以固定和繁殖任何基因型的种子,从而实现F1代杂交优势基因组的迅速固定,因而是一种具有革命性潜力的农业育种方式。自然条件下,无融合生殖多发于多倍体情况下,已经在不同科、属的数百种植物中发生,然而在主要的农作物中并未发现[140]。无融合生殖是有性生殖逃逸的结果,主要依赖于3个方面的操作:1)有丝分裂形式的减数分裂过程;2)跳过受精作用并激活未受精的配子体进行孤性繁殖;3)无受精前提下胚乳功能的激活[120,140](图4)。通过基因工程目前已经在实验室初步实现了拟南芥和水稻中的无融合生殖[141-142]。
减数分裂过程中同源染色体重组以及非同源染色体自由组合,会打乱从亲代继承来的遗传信息,产生单倍且重组的配子。由于每个配子的遗传信息都是独一无二的,因此有性生殖产生的后代存在无限的遗传变异。因此,无融合生殖的基础是对于减数分裂和受精作用的回避。因为有丝分裂DNA只复制一次,并伴随姐妹染色单体的分离,而产生遗传信息完全相同的细胞。所以规避减数分裂的一个重要途径就是利用有丝分裂代替减数分裂(Mitosis instead of meiosis,MiMe),从而阻止同源重组和染色体倍性减少。目前MiMe体系已经在模式植物拟南芥中建立[143]并初步成功应用于水稻[144],其主要策略就是打破减数分裂的3个关键步骤。1)抑制减数分裂重组,防止配子体遗传信息重组。通常这一目标是通过突变关键基因阻止减数分裂DSB的产生而实现的,而DSB形成是重组的开端。在拟南芥中,初始的MiMe体系是通过突变介导DSB形成的SPO11-1基因实现[143]。此外突变其他参与DSB形成的重组酶PRD1、PRD 2和PRD3基因也都成功地在水稻中建立起来MiMe体系[144]。因此,敲除在减数分裂DSB形成中保守的功能基因应该都能在不同作物中实现该目的,例如SPO11-2和MTOPVIB等[11,37]。2)允许姐妹染色单体提前分离。有丝分裂只有1次染色体分离,就是复制产生的姐妹染色单体分离。而减数第1次分裂是同源染色体的分离,而姐妹染色单体由黏连蛋白(Cohesin)捆绑向同侧分离,因此通过敲除减数分裂特异性黏连蛋白REC8可以造成姐妹染色单体的提前分离。在缺失DSB的spo11-1突变体背景下,同时突变REC8基因,就会造成减数第1次分裂的同源染色体分离变成姐妹染色单体的分离。但是由于减数分裂第2次分裂的存在,这些染色单体之后仍然会随机分离1次,最终造成不育[143]。3)不发生第2次减数分裂,允许产生二倍体配子。这一步是通过敲除OSD1(OMISSION OF SECOND DIVISION 1)基因实现的。OSD1是后期促进复合物APC/C的调节因子[145],其通过抑制APC/C的活性影响减数分裂进程。当OSD1缺失后,减数分裂会在减数第1次分裂后终止,并产生二倍体的孢子,最终会导致多倍体后代的产生[143]。但是OSD1基因突变不影响减数分裂重组的发生,因此其产生的仍是同源染色体重组后的二倍体配子[143]。另外,在拟南芥中还鉴定到了osd1突变的替代方案,如敲除细胞周期蛋白CYCA1;2/TAM1或转基因表达一个磷酸化(第16位苏氨酸)位点突变的TDM1(THREE DIVISION MUTANT1),同样可以实现抑制第2次分裂和减数分裂提前退出的效果[120]。综合以上研究,通过把3种调控不同步骤的突变体结合起来,spo11-1抑制重组,rec8解放姐妹染色单体,osd1促使第1次分裂后退出减数分裂,最终把减数分裂转变为有丝分裂,从而产生相同遗传信息的克隆细胞,并且其可以正常发育成为配子体[143-144](图4)。
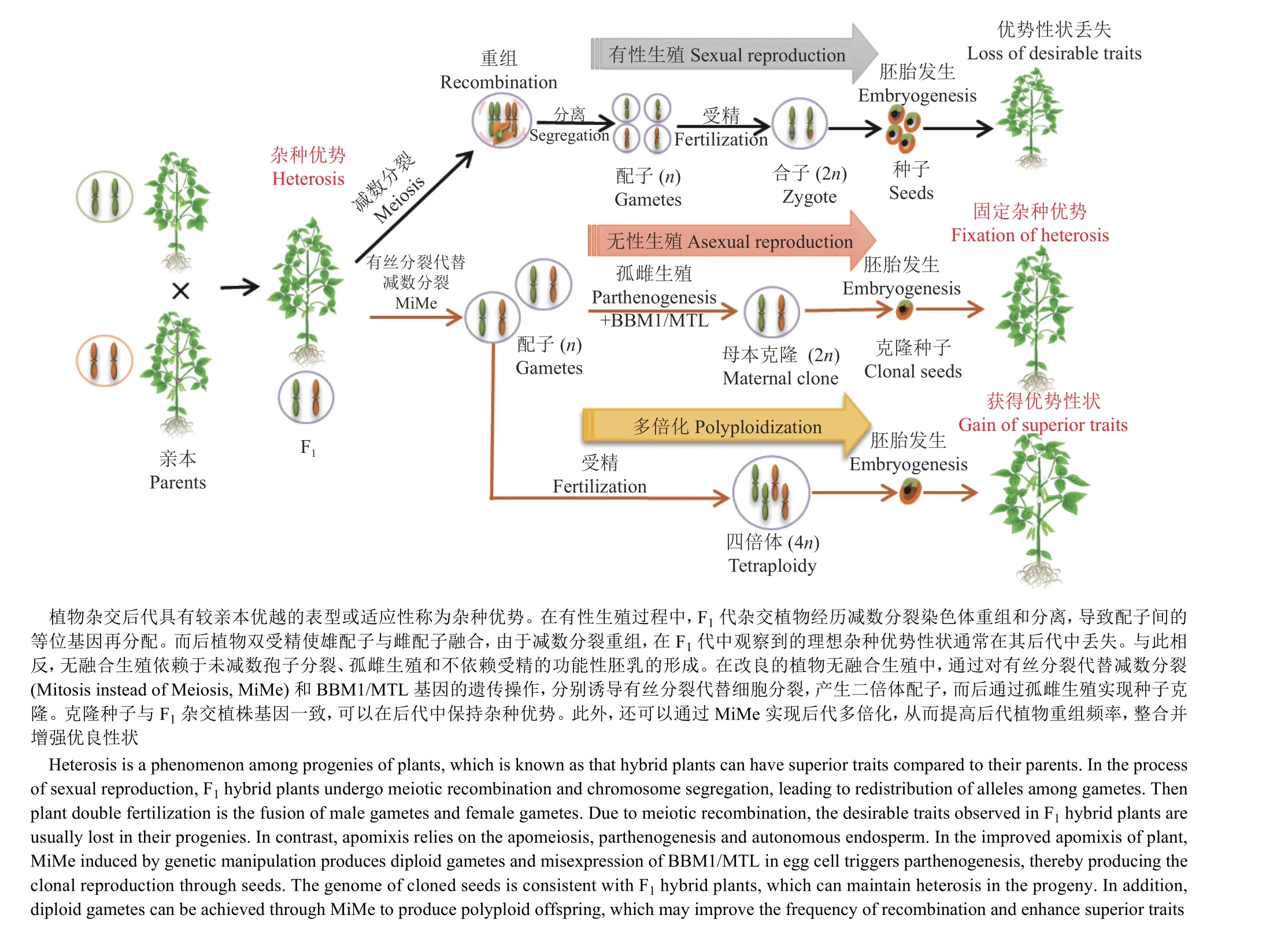
图4 操纵减数分裂创新作物种质Fig. 4 Manipulating meiosis for crop improvement
除了多基因组合以外,还存在一些单基因突变导致MiMe发生的例子,比如:拟南芥的DYAD/SWITCH1(SWI1)基因,是一个减数分裂染色质结构的调节因子,并参与保护黏连蛋白,而且影响减数分裂的进入[146]。而SWI1单突变后足以产生雌性的无融合生殖,产生二倍体的雌配子[146]。但是其发生率仅有约50%,此外还会导致严重不育,所以应用价值大大降低。另外,玉米中还发现了雌性无融合生殖突变体nonreduction in female 4(nrf4),但也只有5%的双倍体配子可以无性生殖[120]。因此单基因突变引发的MiMe的直接应用还存在很大局限。
由于通过MiMe会产生二倍体配子,如果通过受精作用将造成后代染色体加倍 (图4),所以为了实现无融合生殖,需要进一步绕过受精过程,通常可以通过在卵细胞中诱导雄性表达基因BABY BOOM 1(BBM1)诱导孤雌生殖,或通过操纵如着丝粒特异组蛋白CENH3变体实现单倍体诱导,从而实现种子克隆[120]。此外还需要实现胚乳的自主生成[120](图4)。由于这些部分不直接涉及减数分裂过程,所以在此不做详述。
3.3 靶向重组
前文所介绍的改变重组频率的方式多是在整个基因组层面进行增加或减少,对于特定目标区域的重组贡献并不明显,缺乏针对性和灵活性。靶向重组可能是一个潜在的首选策略,其可以用于精确调节特定位置的重组事件的发生,主要目的是打破不利的连锁,增加遗传收益。在原则上,定向重组可以使用2种不同的方法实现靶向重组这一目标:1)使用可编程的DNA核酸酶诱导DSB在特定位置发生,或通过具有与靶标位点DNA/染色体结合能力的系统引导自然的DSB诱导机制定位到特定位点;2)改变靶标位置的染色体特征,从而促进或抑制靶位点重组的发生,比如前文所介绍的DSB热区和冷区的特征(图3)。
CRISPR/Cas系统作为一种精确的基因组编辑工具[147],其包含DNA内切酶,能够在基因组的几乎任何位置诱导DSBs,并可以被合成的gRNA引导到所需的剪切位点。随着CRISPR技术的发展,操纵高等真核生物的基因组和控制减数分裂重组将引领作物改良的新时代[148]。因此,一个可行的策略是在减数分裂过程中直接通过CRISPR/Cas系统定位目标区域,引入DSB形成机制并诱导同源重组。在酿酒酵母的研究中,基因组编辑工具操纵减数分裂重组的适应性首次被证明,使用锌指蛋白(ZF)、转录激活因子(Transcription activator-like effector,TALE)或CRISPR-Cas系统作为DNA结合模块,并融合SPO11,可以在特定位点诱导减数分裂DSB,显著增加交叉频率[149]。近期在植物中,研究者将参与DSB形成的MTOPVIB与dCas9蛋白融合,从而靶向诱导了减数分裂DSB发生于3号染色体的亚端粒区域,但该位置DSB的增加并没有造成重组的频率升高[150]。可能的主要原因是在酿酒酵母中,约40%的DSB可以被转化为COs[151]。而在拟南芥和其他作物中,DSB转化为CO的概率只有2%~5%[11,152]。因此,即使在靶位点有大量DSB形成,但CO低转化率限制了该技术在农作物中的进一步应用。有意思的是,研究者直接利用CRISPR/Cas9系统在番茄体细胞中在一个调节果色的位点定向诱导DSB的发生,并成功诱导了同源重组,其中一小部分遗传给了后代[153]。最近在玉米体细胞中,研究者通过引入CRISPR/Cas12a系统,在3号染色体相距约180 kb处选择2个gRNA靶位,可以显著提高F1代体细胞中CO的频率,而这种靶向CO的发生可能是通过体细胞的非同源端连接(NHEJ)或同源定向修复(HDR)途径介导的[154]。这些成果预示着RNA介导的核酸酶技术在诱导靶向重组和加速育种中的巨大潜力。
除了定点诱导重组,研究者还利用CRISPR/Cas9对拟南芥特定染色体区域进行重排,通过Cas9核酸酶的卵细胞特异性表达系统实现靶向和可遗传的方式重新排列植物染色体的结构[155-156]。值得注意的是,在拟南芥4号染色体上的1.17 Mb异染色质钮(Heterochromatic knob)的反转恢复了该区域CO的形成,而自然条件下该区域CO是被完全抑制的[156]。随后,有研究者在玉米中也获得了染色体大片段交叉和倒位的株系[157]。因为许多作物都经历了大量的染色体重排,影响CO的形成,这一方法通过物理分离打破了一些区域的遗传连锁,对于作物改良有着巨大的应用潜力。
通过改变目标区域染色质修饰也可以改变DSB或CO形成的频率。如缺失DNA甲基化会增加DSB和重组[95-97]。研究者将人源去甲基化酶TET1与人工的锌指结构或CRISPR/dCas9融合,有效地将拟南芥中靶位点的DNA去甲基化[158]。该方法在理论上可以与前面提到的定点重组系统(如Cas9-SPO11的融合蛋白)结合使用,促进DSB在一些高甲基化区域形成,并诱导CO发生[119]。还有研究者利用人工锌指蛋白融合non-CG甲基化的催化蛋白实现定点升高DNA甲基化,进而实现目标基因沉默[159]。由于DNA甲基化对DSB和重组的发生有抑制作用[95,103],同样该方法也可以运用于增加某些重组热点的甲基化水平,实现重组抑制,进而实现优良性状基因的整合和固定。
3.4 反向育种
前文提到的无融合生殖是固定杂种优势的有效策略,而反向育种是另一种替代方法。反向育种和杂交育种相反,其通过阻止同源染色体交换和重组,获取具有非重组的亲代染色体组合的雄性或雌性的配子体,而后单倍体配子进一步通过培养获得纯合的双单倍体植物(Doubled haploid plants,DHs),最终可以从不同染色体组合的DHs中选择染色体互补的株系重新杂交,最终大量获得和初始杂交种基因型一样的杂交系,从而实现固定杂种优势[160-162]。目前在拟南芥中已经建立了比较成熟的反向育种流程[161]:1)构建和转化减数分裂特异重组酶DMC1的RNAi株系,获取无重组的亲本;2)通过野生型(父本)和DMCRNAi转基因株系(母本)的杂交获得无重组的杂交后代;3)用杂交后代给GFP-tailswap(CENH3的一个嵌合突变体,其表达了一个融合GFP标签、H3 氮端和CENH3 碳端尾巴的嵌合蛋白,从而导致染色体选择性消除,最终产生单倍体的胚)植株授粉获得单倍体植株;4)单倍体植株自交成为D H s;5)选择染色体互补的DHs杂交获得初始的杂交种,固定杂种优势。这种策略存在很大限制,是由于通过抑制DMC1表达会禁止重组发生,导致减数分裂时期染色体随机分离,因此无交换的配子体是否可育完全依赖于概率很低的偶然事件,因此该方法对于作物上的进一步应用很有局限。另一个解决方案是通过减少而不是完全抑制CO的产生,提高配子体成活率。最近,研究者在拟南芥中通过病毒介导的基因沉默技术(VIGS)降低减数分裂重组酶MSH5基因 的表达,从而瞬时降低CO形成[163],为这一理论提供了支持。而且VIGS技术支持瞬时下调目的基因,避免了影响整个基因组的稳定性,更有利于育种。然而,目前反向育种技术还没有在作物中实践。
4 结论与展望
近年来,对拟南芥和各种作物的减数分裂的机制研究增加了人们对植物减数分裂进程和重组的认识,并明确了多个参与调控减数分裂过程的基因和因子。虽然目前开发了一些加快育种的创新策略,但很多策略都是基于对模式植物拟南芥的研究,这些策略能否顺利转移到作物育种中,在实际操作和未来应用中仍值得探索。其原因是,尽管物种间减数分裂进程和重组的机制相对保守,但由于不同植物间基因组(组成和倍性)的不同,导致物种间减数分裂进程和重组模式存在一定差异,这为制定作物育种策略带来了一定阻碍。因此,我们需要更好地了解植物间减数分裂进程和重组的异同,研究包括作物和非模式物种在内的多种植物减数分裂的基本机制,并将相关知识应用到作物育种中,从而突破传统作物育种模式,加快定向改良作物品种,在振兴种业和实现国家未来粮食安全方面发挥关键作用。
