蛋白修饰调控植物育性与生殖发育的研究进展
2022-10-31李构思张雅玲谢勇尧陈乐天
李构思,张雅玲,马 坤,谢勇尧,陈乐天
(1 华南农业大学 生命科学学院/亚热带农业生物资源保护与利用国家重点实验室, 广东 广州 510642; 2 岭南现代农业科学与技术广东省实验室, 广东 广州 510642)
花粉发育是植物有性生殖的重要过程,包括体细胞绒毡层发育和小孢子母细胞分化、小孢子母细胞减数分裂和小孢子发育最终形成成熟花粉。花粉发育的任何一个环节出现异常均可能导致植物雄性不育,尤其是绒毡层作为体细胞与雄性生殖细胞交流和连接的通道,其发育和凋亡对花粉发育更是至关重要[1-2]。植物雄性不育虽然不利于植物的自交繁殖,却有利于驱动自交植物通过异交繁衍后代,增加基因交流和重组频率,使植物适应不断变化的外部环境。在农业生产上,杂种优势利用是提高农作物产量、保障粮食安全的关键策略。杂交育种通过利用雄性不育系解决了雌雄同株同花作物杂交母本人工去雄困难的问题,降低了劳力成本,同时显著提高了制种效率,促进杂种优势利用[3]。因此,解析花粉发育和育性形成的分子调控网络,既可以解答植物生殖发育的基础科学问题,也能为农作物杂交育种提供理论指导和技术支撑。
前期的植物生殖生物学研究重点在于鉴定不同花粉发育时期的关键基因和育性调控的分子网络,现已从拟南芥Arabidopsis thaliana、水稻Oryza sativa等植物中克隆获得上百个雄性不育基因,这些基因主要构成了由转录因子调控网络介导的糖代谢和脂代谢分子调控通路[2,4-6]。近年来,越来越多的研究表明,多种蛋白质修饰参与了育性的调控和生殖发育过程,但蛋白修饰作为翻译后调控的重要方式,如何影响植物花粉育性却缺乏系统性的总结。为填补这一空白,本文整理归纳参与蛋白质修饰过程的已报道雄性不育基因,以及花药/花粉发育过程中受到修饰的底物蛋白,梳理了花粉发育各个阶段的关键蛋白的调控网络(图1),系统了解蛋白翻译后修饰调控植物育性发育过程的分子机制,为后续植物生殖研究提供参考。
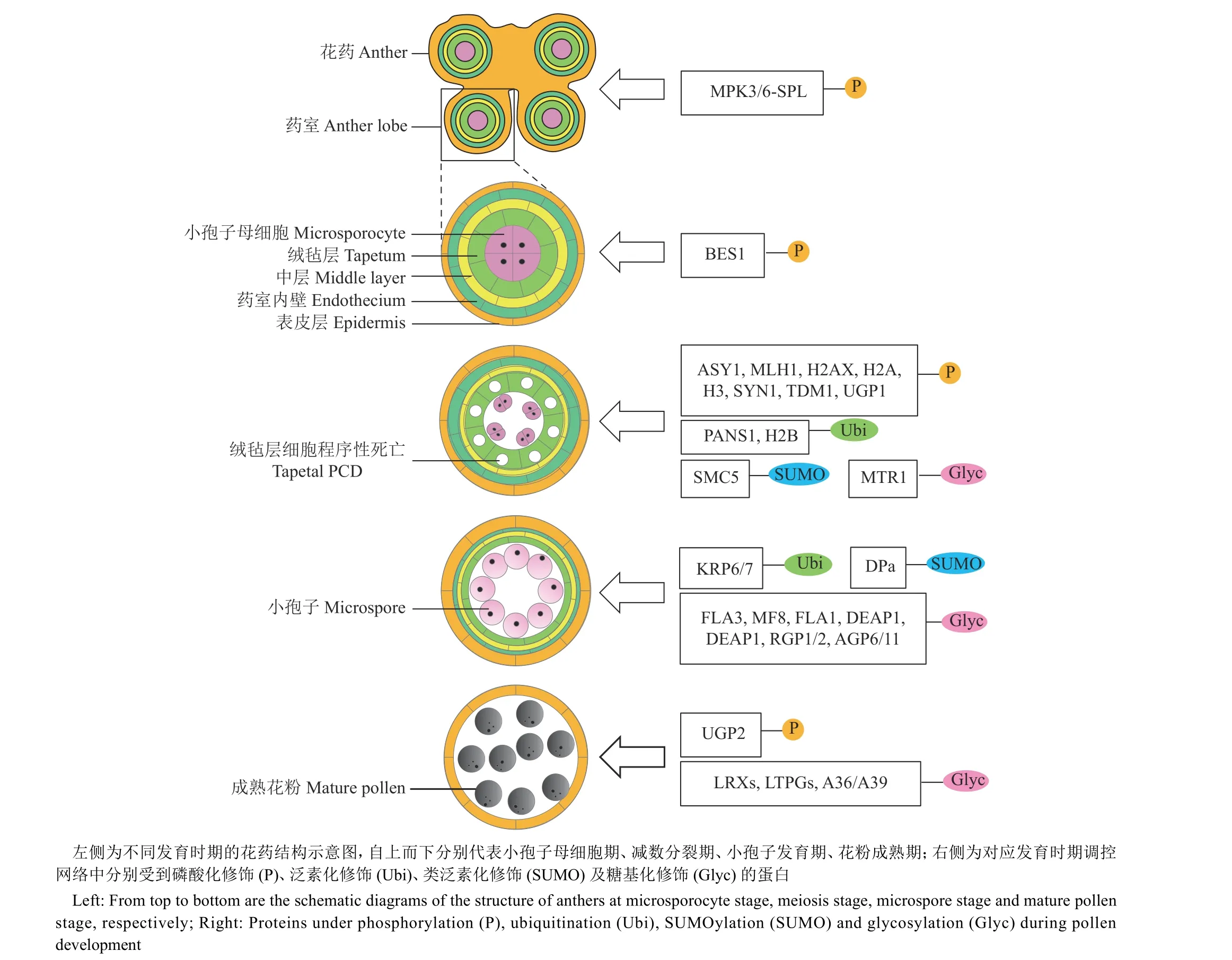
图1 花粉发育各个阶段的蛋白质修饰Fig. 1 Protein modifications during pollen development
蛋白质修饰是指将功能基团或生物大分子共价结合到多肽链,从而改变蛋白质结构和功能的一种翻译后调控方式。迄今为止,有多种不同的氨基酸修饰在真核生物蛋白中被发现,它们作用机制各异,通常影响蛋白活性、稳定性、亚细胞定位以及蛋白间互作。其中,磷酸化(Phosphorylation)、泛素化(Ubiquitination)、类泛素化(SUMOylation)和糖基化(Glycosylation)是在植物各个发育阶段普遍存在的修饰类型。磷酸化修饰是由蛋白激酶催化磷酸基团添加到多肽的丝氨酸、苏氨酸或酪氨酸残基的过程,而磷酸酶则能实现蛋白去磷酸化,与激酶共同调节蛋白的动态磷酸化水平。泛素(Ubiquitin,Ubi)和类泛素(Small ubiquitin-like modifier,SUMO)是一类结构相似的小分子量蛋白,能以单分子或多聚链的形式共价结合在底物蛋白的赖氨酸残基上。泛素化和SUMO化修饰经历相似的过程:Ubi/SUMO分子依次通过E1活化酶、E2结合酶和E3连接酶被激活并传递到底物上。糖基化修饰则依赖糖基转移酶使单糖或多糖和蛋白之间以糖苷键共价连接,是一种更复杂多样的修饰类型。根据连接方式的不同,糖基化可分为N-糖基化、O-糖基化和GPI(Glycosylphoshatidylinositol)锚定等类型,且底物与不同类型糖供体的结合通常由特异的糖基转移酶介导,同时存在对应的去糖基化酶。这些修饰过程常改变蛋白构象、活性和稳定性,可影响蛋白定位、添加识别标记、调节蛋白相互作用等,从而调控蛋白质的功能,在植物生长发育、物质代谢、生物和非生物逆境响应等生命活动中发挥重要作用[7-12]。
1 蛋白磷酸化修饰作用于花粉发育
1.1 蛋白磷酸化修饰调控植物生殖器官细胞分化和花药形态建成
花药是花粉(小孢子)发育的场所。在雄性生殖发育早期,花分生组织经过多次增殖和分化,形成具有4个药室的花药。每个药室自外向内由表皮层、药室内层、中层和绒毡层4层花药壁体细胞包裹着小孢子母细胞[13-14]。在这一发育阶段,类受体激酶(Receptor-like protein kinases,RLKs)介导的磷酸化修饰发挥了重要作用[15-16]。RLKs是一种常见的跨膜蛋白激酶,通过胞外受体结构域接收配体信号分子,调节胞内激酶结构域的活性,从而向下游传递外源信号。
目前被报道的RLKs调控花药细胞分化的途径包括:1) ERf(ERECTA family)类RLKs介导的ERf-MPK3/6-SPL通路调控药室形成[17-19];2) LRRRLKs(Leucine-rich repeat RLKs)蛋白BAM1/2、RPK2及它们的共受体激酶CIKs控制初生壁及次生壁细胞分裂分化产生4层花药壁[20-22];3) LRRRLKs蛋白EMS1/EXS传导的信号通路调节绒毡层细胞和小孢子母细胞的分化[23-24]。在这些调控过程中,常以“胞外配体-RLKs-转录因子”的信号传导路径调控花药细胞分化。其中,由EMS1/EXS介导的信号转导调控机制最为明确。研究表明,在拟南芥中,涉及EMS1/EXS介导的信号转导相关基因的突变体tpd1、ems1/exs、serk1serk2和bes1均表现为小孢子母细胞过多和绒毡层缺陷,无法产生可育花粉。研究还发现,胞外分泌的富半胱氨酸小肽TPD1作为配体与EMS1/EXS的LRR受体结构域结合,诱导后者发生磷酸化[25-27];功能冗余的一对LRR-RLKs蛋白SERK1/2作为共受体与EMS1/EXS相互作用并增强其功能,协同传递信号[28-30];TPD1-EMS1/EXS-SERK1/2复合体产生的信号促使转录因子BES1发生去磷酸化而被激活,从而调控绒毡层发育相关基因的表达[31-32]。
此外,在水稻、玉米Zea mays和棉花Gossypium hirsutum中,也相继鉴定获得TPD1的同源基因OsTDL1A/MIL2和ZmMAC1、EMS1/EXS的同源基因OsMSP1以及SERK1/2的同源基因GhSERK1,这些基因突变后均会导致雄性不育[33-37]。这些研究表明TPD1-EMS1/EXS-SERK1/2-BES1调控花药细胞分化的通路在植物中是相对保守的。尽管如此,这一通路在单子叶和双子叶植物的调控机制中还是存在差异,表现在不同物种呈现不同的败育程度和核心调控基因有不同的表达模式。例如,与拟南芥相比,水稻和玉米相关突变体的花药壁中层和绒毡层均缺失,表现出更严重的细胞分化紊乱。此外,拟南芥TPD1和EMS1/EXS的时空表达为先重叠、后分化的模式,而水稻T D L 1 A/M I L 2和MSP1的表达模式则基本一致。
1.2 蛋白磷酸化修饰精确调控减数分裂
小孢子母细胞分化形成后,需要通过减数分裂产生单倍体小孢子,后者进一步发育为成熟花粉。减数分裂首先经历间期的DNA复制物质准备过程,随后发生2次细胞分裂,第1次细胞分裂后同源染色体分离、染色体数目减半,第2次细胞分裂后姐妹染色单体分离,遗传物质减半。在第1次细胞分裂时,染色体会发生联会、重组交换等区别于有丝分裂的活动,这些活动均受到磷酸化修饰的精确调控。
染色体轴蛋白ASY1是联会复合体组成的必需蛋白。细胞周期蛋白依赖性激酶CDKA;1通过介导ASY1的磷酸化修饰维持ASY1在染色体轴的正确定位,同时促进其与另一联会复合体蛋白ASY3的互作并调控其多聚化过程。拟南芥突变体asy1和cdka;1因同源染色体无法正常联会而不育,且磷酸化位点突变后的ASY1不能回补asy1表型[38]。除了参与调控联会过程,拟南芥CDKA;1还参与了联会后的同源染色体重组交换,其激酶活性的降低导致重组频率下降,这是由于它可能介导染色体交换标记蛋白MLH1的磷酸化,从而促进重组交换过程[39]。与之相反,HCR1/PPX1磷酸酶则是减数分裂中同源染色体交换的抑制因子,但该基因突变后并不造成拟南芥育性变化[40]。染色体重组交换等过程涉及DNA双链断裂(Double-strandbreak,DSB)产生及修复,磷酸激酶ATM参与了拟南芥和水稻的DSB修复过程[41-42]。突变体Osatm同源染色体能正常联会,但小孢子母细胞中出现了非同源染色体异常黏连和DNA片段化,最终导致花粉不育[42]。虽然ATM可直接磷酸化组蛋白H2AX,且H2AX的磷酸化属于DSB应答机制的一部分,但ATM的突变并不影响水稻减数分裂时H2AX的磷酸化,说明ATM可能通过介导其他底物磷酸化,进而调控这一过程[42]。
在联会和重组交换完成后,同源染色体需要在纺锤体的牵引下实现分离并被分配到二分体中,在这一阶段磷酸化修饰同样发挥重要作用。水稻丝氨酸/苏氨酸蛋白激酶BRK1通过直接或间接介导着丝粒区组蛋白H2A和H3的磷酸化修饰,并募集SHUGOSHIN1蛋白定位到着丝粒中,维持减数分裂I纺锤体的正确组装[43]。突变体brk1在减数分裂中期I纺锤体形态异常,导致后期Ⅰ姐妹染色单体提前分离,引起不育[43]。同样,蛋白去磷酸化修饰对同源染色体的正确分离也起重要作用。拟南芥磷酸酶PP2A通过介导染色体凝聚环蛋白SYN1/REC8去磷酸化,保护后者在减数分裂早期免受降解,该基因突变会导致染色体凝聚力提前丧失,姐妹染色单体在减数分裂后期I提前分离,育性下降[44-45]。
1.3 蛋白磷酸化修饰参与其他花粉发育活动
绒毡层是花药壁最内层包裹着小孢子母细胞的体细胞层,主要负责花药壁和小孢子母细胞/小孢子之间的物质传递和营养输送,并在减数分裂期启动细胞程序性死亡(Programmed cell death,PCD)。绒毡层PCD的提前或延迟都会造成雄性不育,已报道的多个不育基因共同形成了绒毡层PCD的调控网络,处于调控网络中上游的基因大多数编码转录因子。目前仅有少量报道关于磷酸化修饰调控绒毡层PCD过程,其中棉花酪氨酸激酶CKⅠ通过磷酸化淀粉合成酶抑制后者的酶活性,在高温环境下,CKⅠ表达上调,葡萄糖含量升高导致活性氧平衡被破坏,最终引发绒毡层PCD延迟,花粉不育[46]。在水稻中,编码磷酸激酶的2个功能冗余的同源基因TMS10和TMS10L是绒毡层PCD所必需,其中TMS10L的表达受到低温诱导。单突变体tms10高温下绒毡层不降解且花粉不育,低温时TMS10L能补偿TMS10的功能,恢复育性;双突变体tms10tms10l在高低温下均为不育[47]。这些研究提示磷酸化可能广泛参与花粉发育对外界环境的应答机制。
在小孢子壁形成前,四分体由胼胝质包裹,后者为小孢子提供保护功能。水稻凝集素受体激酶LecRK5/LecRK-S.7/DAF1/AP1通过对胼胝质合成酶UGP1磷酸化,促进花药中胼胝质的合成,维持花粉正常发育[48]。此外,该蛋白还被报道在花粉外壁和萌发孔形成、花粉淀粉积累及成熟中发挥重要作用,说明该蛋白激酶存在多个磷酸化修饰底物[49-51]。在拟南芥中同样发现了由凝集素受体激酶编码基因突变产生的不育突变体sgc,突变体减数分裂后小孢子壁发育异常导致花粉不育,其具体调控机制可能与水稻相似[52]。
以上在花粉发育各个阶段发挥作用的蛋白涉及大量的磷酸激酶和磷酸酶,其中多数为类受体激酶(表1)。
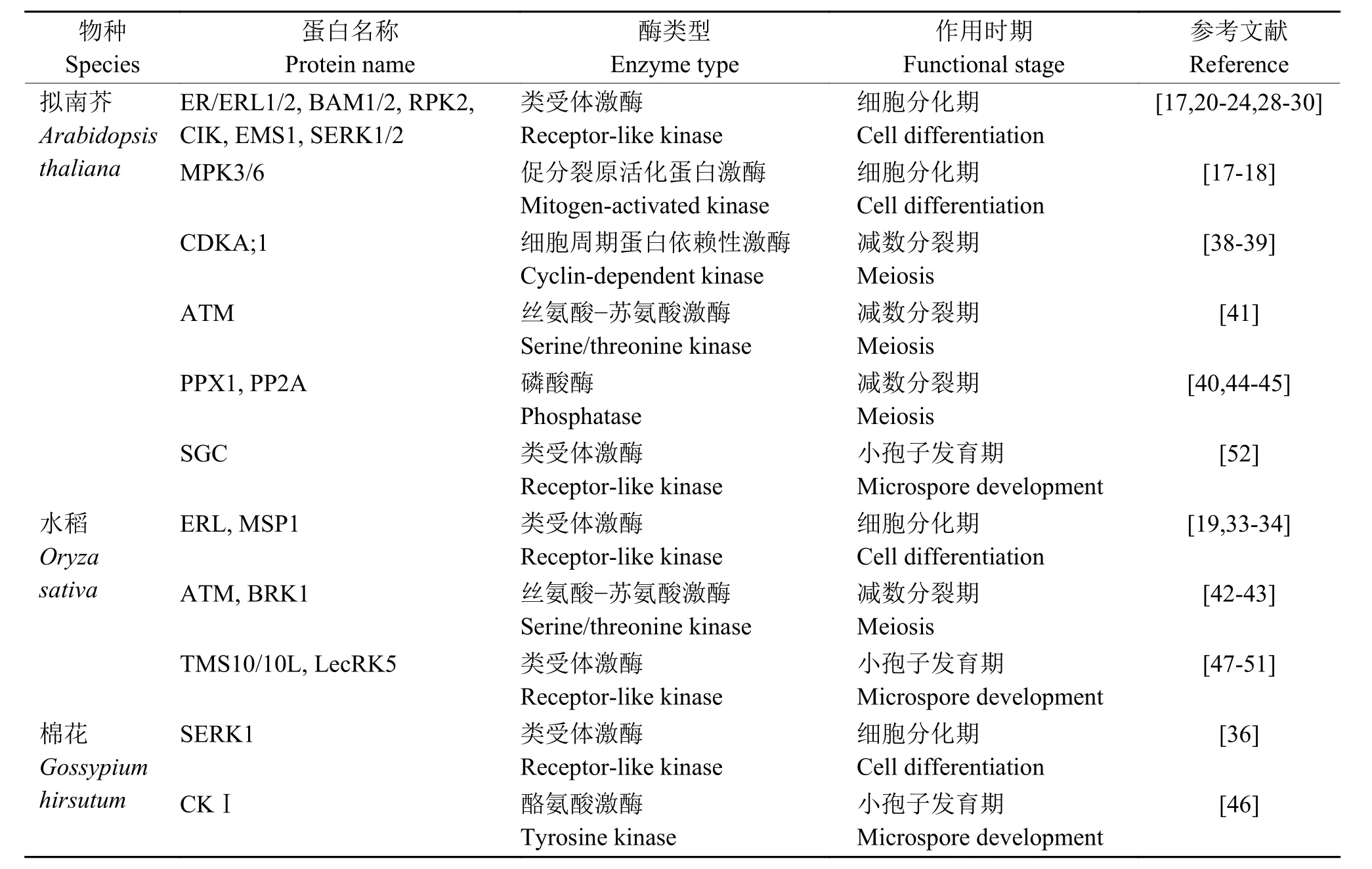
表1 花粉发育过程中参与蛋白磷酸化修饰的催化酶Table 1 Enzymes for protein phosphorylation during pollen development
2 蛋白泛素化和SUMO化修饰作用于花粉发育
2.1 蛋白泛素化和SUMO化修饰控制减数分裂过程
在真核生物中,泛素化修饰参与调控减数分裂同源染色体联会、染色体重组交换和分离、DSB修复、端粒束形成等过程,且在不同物种中存在相对保守的调控机制[53]。泛素E3连接酶是直接与底物互作,决定泛素化底物特异性的蛋白。因此,泛素E3连接酶数目繁多,被分为多个蛋白家族。目前,被报道与植物减数分裂相关的泛素E3连接酶主要包括SKP1-Cullin-F-box(SCF)复合体、后期促进复合体/细胞周期体(Anaphase-promoting complex or cyclosome,APC/C)以及HEI10蛋白[53]。
SCF复合体中,F-Box蛋白特异性结合底物SKP1负责连接F-Box和Cullin蛋白,Cullin蛋白直接或间接与泛素E2结合酶互作,将E2上的泛素分子传递给底物。拟南芥SKP1突变后花药减数分裂时同源染色体联会、重组、分离及核仁迁移均出现异常,表示SCF复合体同时调控减数分裂多个步骤[54-55]。SCF主要通过不同的F-Box蛋白对特定底物进行泛素化修饰从而实现不同功能,如水稻F-Box蛋白MOF和ZYGO1同时调控端粒束形成和同源染色体联会,MOF还发挥DSB修复功能,突变体mof的花粉降解,zygo1的雌雄配子同时败育[56-57]。玉米F-Box蛋白ACOZ1则是染色质浓缩必需蛋白,突变体染色体维持在细线期而不进入偶线期,端粒束形成和同源染色体配对受阻,DSB形成和修复不受影响,导致雌雄配子败育[58]。然而,这些蛋白具体的泛素化修饰底物尚不明确。
APC/C同样是由多个蛋白组成的复合体,是植物减数分裂必需的泛素E3连接酶之一[59]。拟南芥APC/C的组成蛋白APC8以及活性辅助因子CDC20.1被证明参与减数分裂染色体分离和花粉育性调控[60-61]。细胞周期蛋白是APC/C的泛素化底物之一,APC/C通过降解前者调节细胞周期蛋白依赖性激酶CDKs的活性,从而控制减数分裂进程;同时A P C/C本身又会受到细胞周期蛋白和CDKs的反馈调控[53]。例如,拟南芥的细胞周期蛋白OSD1和TAM功能丧失会导致减数分裂提前终止,小孢子发育异常[62];细胞周期蛋白编码基因TDM1突变则会导致减数分裂无法正确终止,细胞多次分裂[63]。OSD1通过结合APC/C的蛋白亚基抑制后者的活性,T A M-C D K A;1通过磷酸化TDM1抑制后者对APC/C的激活作用[62-63]。此外,APC/C还能通过降解PANS1蛋白释放黏连蛋白分离酶的活性位点,促使后者降解SYN1/REC8,保证减数分裂后期I同源染色体分离[64]。
HEI10蛋白是携带RING结构域的一种泛素E3连接酶,该蛋白与多个ZMM蛋白相互作用共同调控减数分裂同源染色体重组交换,拟南芥HEI10突变后染色体重组水平和育性均明显下降[65-66]。然而,HEI10的具体泛素化修饰底物及其作用机制尚不完全清楚,有待进一步研究。
目前发现的蛋白SUMO化修饰调控减数分裂主要与SMC5/6复合体的功能相关。SMC5/6是真核生物染色体结构维持所必需的其中一类复合体,在DNA损伤修复、缓解DNA复制压力、维持细胞正常分裂等过程中发挥作用[67]。SUMO E3连接酶MMS21/NSE2/HPY2与SMC5蛋白互作,是SMC5/6的组成蛋白之一。拟南芥MMS21突变体减数分裂时染色体出现碎片化及异常黏连,多个减数分裂相关基因表达水平发生变化,引起雌雄配子育性下降[68]。最新研究表明:拟南芥MMS21或其他SMC5/6组成蛋白的功能缺失均会造成同源染色体分离异常,产生二倍体花粉[69]。而玉米MMS21能对SMC5进行SUMO化修饰,从而影响染色质的状态,调节基因转录水平[70]。
2.2 蛋白泛素化和SUMO化修饰调控减数分裂后花粉发育过程
绒毡层PCD的发生是保证花粉正常发育的必要条件,该过程也受到蛋白泛素化修饰调控。拟南芥PUB4和水稻PUB73均编码U-box泛素E3连接酶,突变pub4绒毡层增厚未及时降解,而pub73的绒毡层则提前出现液泡化,以上2种情况均导致花粉外壁发育异常而败育,其中pub4的育性能在低温环境下恢复[71-72]。在水稻中,另一对泛素E3连接酶HUB1和HUB2介导组蛋白H2B的单泛素化,该泛素化修饰通过表观调控UDT1、CP1、C4等下游基因的表达维持绒毡层的正常发育和降解[73]。此外,编码细胞膜定位F-Box蛋白的水稻ADF基因被敲减后同样会导致绒毡层降解异常,尽管ADF的作用靶标尚不清楚,但这表明蛋白泛素化复合体SCF可能参与了绒毡层的正常降解[74]。
在花粉发育后期,单倍体小孢子经历2次有丝分裂,最终形成带有3个细胞核的成熟花粉。在这一过程中,拟南芥FBL17与SKP1结合形成SCF复合体,泛素化降解细胞周期抑制蛋白,促进生殖细胞发生第2次有丝分裂[75-76]。除了调控减数分裂,拟南芥MMS21也对转录因子DPa进行SUMO化修饰,阻碍E2Fa/DPa转录因子复合体的形成与细胞核定位,后者参与了细胞周期调控和花粉有丝分裂过程[77-78]。
另一类SUMO E3连接酶SIZ1和SIZ2被报道与水稻花粉发育和花药开裂相关,而拟南芥去SUMO化蛋白酶SPF1和SPF2被认为在SIZ1的下游发挥功能,这些蛋白的功能丧失均会引起育性下降[79-83]。这些研究提示SUMO化的缺失或过度均会影响正常生殖发育过程。
上述参与花粉发育过程中蛋白泛素化和SUMO化修饰的各类催化酶总结列于表2。
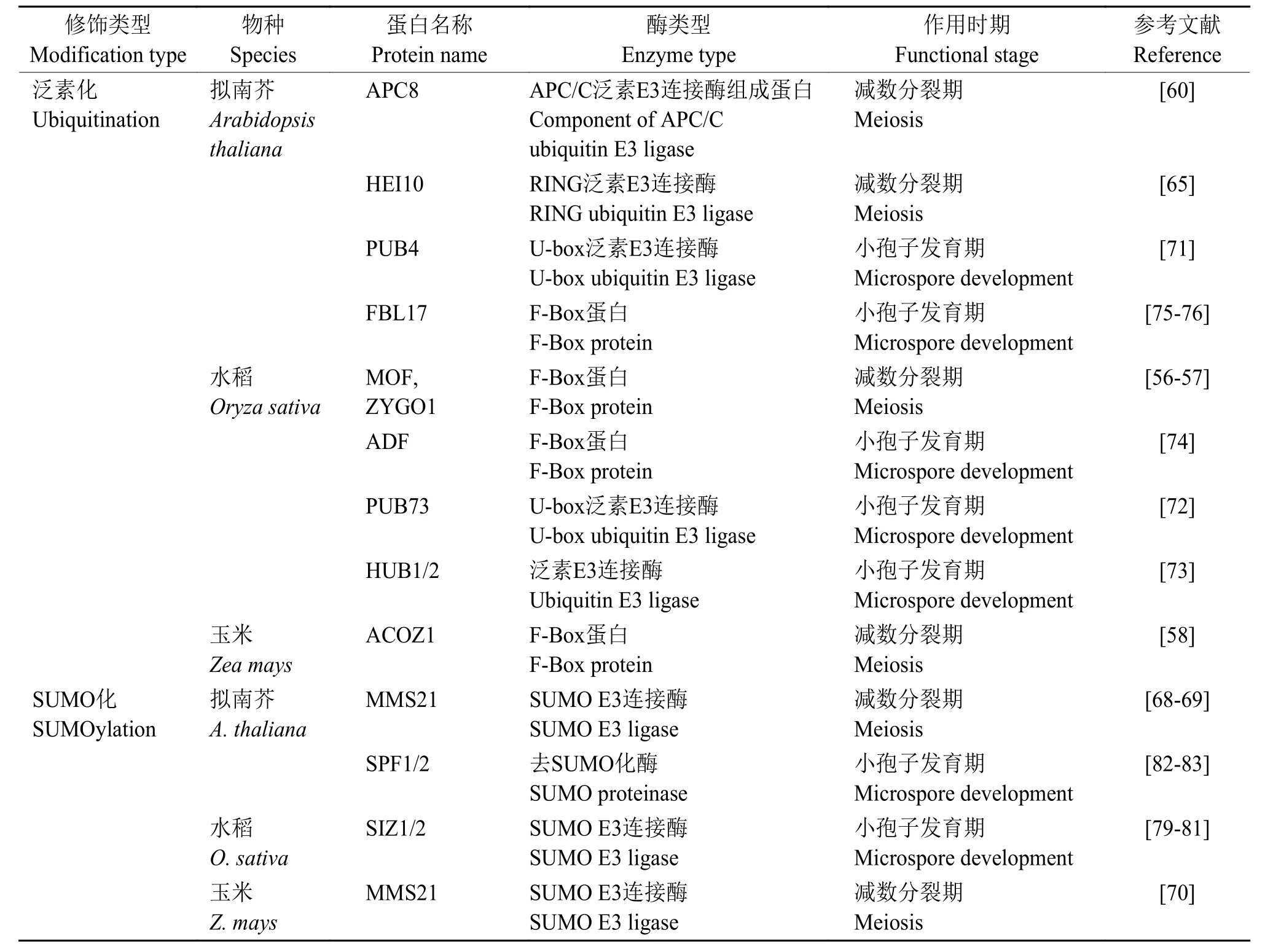
表2 花粉发育过程中参与蛋白泛素化和SUMO化修饰的催化酶Table 2 Enzymes for protein ubiquitination and SUMOylation during pollen development
3 蛋白糖基化修饰作用于花粉发育
3.1 蛋白糖基化修饰影响绒毡层和花粉壁发育
细胞膜、细胞壁富含糖蛋白,后者常作为结构成分或信号传导因子发挥重要生物学功能。水稻MTR1编码细胞膜定位的成束糖蛋白,该蛋白的N-糖基化位点或膜定位信号缺失均会影响绒毡层和小孢子正常发育[84]。阿拉伯半乳糖蛋白(Arabinogalactan-proteins,AGPs)是富含脯氨酸的高度糖基化蛋白,研究发现AGPs在绒毡层、小孢子母细胞及小孢子等部位高水平表达,提示该类蛋白参与花粉发育过程[85-86]。目前已有多个AGPs被报道调控花粉育性,且主要与花粉壁形成相关。例如,拟南芥AGP编码基因FLA3的下调表达造成花粉内壁发育异常而不育[87];白菜Brassica campestrisAGP编码基因MF8的沉默破坏了花粉壁正常发育,导致花粉活性下降[88];水稻AGP编码基因FLA1突变后乌氏小体和小孢子外壁异常,致使花粉不育[89];水稻另一个AGP编码基因DEAP1丧失功能会产生多种发育紊乱,包括绒毡层延迟降解、花粉外壁缺陷、萌发孔畸形,进一步研究表明DEAP1可能通过与2个萌发孔发育相关蛋白D6PKL3(D6 protein kinase-like 3)互作,参与花粉萌发孔的形态建成[90]。半乳糖基转移酶(Galactosyltransferases,GALTs)主要介导AGPs的半乳糖基化修饰,部分GALTs同样参与调控植物的生殖发育。例如,GALTs编码基因ZmMs8、KNS4/UPEX1功能丧失分别引起玉米和拟南芥雄性不育[91-92]。KNS4/UPEX1主要通过介导小孢子初生外壁中AGPs的β-1,3-半乳糖链合成,维持小孢子外壁的网状结构,从而确保花粉正常发育[92]。此外,KNS4/UPEX1突变后会导致四分体胼胝质延迟降解,反而帮助部分花粉壁缺陷型光温敏雄性不育系的花粉育性得到一定程度的恢复[93]。
3.2 蛋白糖基化调控花粉后期发育途径
在花粉发育后期的有丝分裂及成熟阶段,参与蛋白糖基化修饰的多种糖供体合成和代谢相关的催化酶,如UDP-糖焦磷酸化酶、N-乙酰氨基葡萄糖-1-P尿甙基转化酶、谷氨酰胺:果糖-6-磷酸酰胺基转移酶,是维持花粉育性正常的必需因子,表明糖代谢及蛋白糖基化修饰在花粉后期发育阶段发挥着重要作用[94-96]。目前,糖蛋白在花粉发育后期的功能研究主要在拟南芥中被报道。可逆糖多肽编码基因RGP1和RGP2的突变体、AGP6/AGP11双基因突变体均表现为有丝分裂异常、花粉不育。携带GPI锚定修饰糖链的多个非特异脂质转运蛋白LTPGs功能同时丧失后,花粉染色正常,但在扫描电镜观察下表现为畸形皱缩,表明花粉成熟过程出现问题[97]。同样受到GPI锚定修饰的天冬氨酸蛋白酶A36和A39在成熟花粉中高水平表达,该蛋白功能被破坏会导致花粉发生PCD而不育[98]。花粉特异表达的伸展蛋白LRXs是参与细胞壁结构组成的其中一类糖蛋白,它们参与维持细胞壁稳定并调节胞内生理指标特性,保证了成熟花粉的正常萌发[99]。
以上研究表明,参与花粉发育过程的糖蛋白及糖基化修饰类型具有多样性,因此其调控方式也各不相同。本文总结了参与花粉发育时蛋白糖基化修饰的不同催化酶(表3),这些酶可能同时调控了多个蛋白的糖基化修饰过程。

表3 花粉发育过程中参与蛋白糖基化修饰的催化酶Table 3 Enzymes for protein glycosylation during pollen development
4 总结与展望
尽管目前围绕不育突变体鉴定及不育基因克隆已开展了大量研究,但这些不育基因的具体作用机制、基因所在的调控通路以及各通路之间的互作关系等问题有待进一步明确。除了文中提及的4种常见蛋白质修饰,近期少量研究表明蛋白乙酰化、组蛋白甲基化等其他修饰类型也参与了植物生殖发育调控过程[100-102]。而目前已有超过300种蛋白翻译后修饰类型被报道[10],说明了植物中的育性与生殖发育相关蛋白修饰调控网络可能比我们想象的更加复杂。此外,借助蛋白修饰组学分析,能够高效获得特定发育时期的花药/花粉中受到翻译后修饰调控的蛋白,为进一步的功能验证提供参考。例如,对减数分裂期的水稻花药进行磷酸化蛋白组测定,发现3203个蛋白受到磷酸化修饰,这些蛋白参与DNA修复、转录调控、信号转导等过程[103]。拟南芥、烟草Nicotiana tabacum、玉米等蛋白磷酸化组学分析表明,成熟花粉中也存在大量蛋白被磷酸化修饰,其中包括各物种共有的同源蛋白[104]。在水稻幼穗中开展的赖氨酸泛素化修饰组学研究显示,鉴定获得的916个泛素化修饰蛋白中有710个是未经报道的新底物蛋白,还包括7个已发表的花粉发育相关蛋白[105]。这些研究表明花粉发育各个阶段的蛋白普遍存在翻译后修饰,然而这些蛋白是如何通过修饰参与水稻花药发育以及生殖过程,如生殖细胞的分裂分化、绒毡层与小孢子之间的物质信息传递、花粉与柱头的识别等,仍是值得研究的重要科学问题。
另一方面,花粉发育过程的同一蛋白或同一调控通路往往涉及多种蛋白修饰的协同或拮抗作用。例如,在花药细胞分化过程中起重要作用的RLKs蛋白激酶,其胞外受体结构域常受到糖基化修饰从而与配体信号分子相互识别。此外,部分蛋白的磷酸化修饰能帮助其被泛素E3连接酶识别并降解,如染色体凝聚环蛋白SYN1/REC8,该蛋白在减数分裂后期被磷酸化,随后通过泛素化途径降解,促进染色体正常分离[44]。又如泛素E3连接酶APC/C通过降解细胞周期蛋白调节CDKs蛋白激酶的活性,而CDKs又能通过磷酸化修饰对APC/C进行反馈调节[53]。而泛素化和SUMO化修饰普遍被认为在蛋白稳定性调控中起拮抗作用,且这2种修饰都在花粉发育特别是减数分裂过程中发挥重要作用,但它们之间确切的调控关系仍需具体的研究验证。
综上,尽管目前关于蛋白的翻译后修饰已经有相当多的研究,但蛋白修饰的多样性决定了其在调控花粉发育过程中的多效性和复杂性。该领域的研究仍面临着诸多困难与挑战:1)同一蛋白往往存在着多种修饰,不同种类的修饰如何彼此作用影响蛋白功能的完整性和蛋白间的相互作用;2)对蛋白修饰的系统性鉴定仍缺乏高效的技术手段;3)蛋白的修饰存在着一个动态的过程,蛋白修饰的动态过程与植物生长发育之间的关系存在较多的未解之谜。本文所总结的蛋白或许仅仅是翻译后修饰调控网络中的冰山一角,仍有大量相关功能蛋白以及蛋白翻译后修饰的生物学机制有待进一步探索。随着各种质谱技术和蛋白修饰组学技术的不断兴起,并日益走向成熟,我们对蛋白修饰调控花粉发育的认知将持续扩大和深入,对花粉发育相关基因的分子作用机制和调控网络的了解将不断完善。
