Hcy及叶酸、EGCG对HUVECs TM启动子甲基化状态的调节作用☆
2022-10-31王丽珍周雪颖韩沙如拉袁瑞杨志甫
王丽珍 周雪颖 韩沙如拉 袁瑞 杨志甫○☆
血栓调节蛋白(thrombomodulin,TM)具有抗凝、促进纤溶、抗炎、保护血管内皮等生理功能,在预防心脑血管疾病和血栓形成性疾病方面发挥重要作用[1-4]。DNA 甲基化是目前影响基因转录表达最常见的表观遗传方式。TM 启动子区异常高甲基化与多种疾病相关[5-7]。高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)是心脑血管疾病发生的独立危险因素[8]。升高的Hcy 能够通过影响DNA 的甲基化而参与心脑血管疾病的发生[9]。FA参与Hcy 经再甲基化途径的代谢过程,补充FA 可显著降低HHcy患者血浆Hcy水平;EGCG是绿茶中主要的活性部分,属于新型DNMT;二者均能通过逆转异常的DNA 甲基化状态发挥作用[10-12]。本课题组前期研究发现,脑梗死患者TM 基因启动子区呈异常高甲基化状态,且其甲基化水平与其mRNA表达水平呈负相关,与血浆Hcy 水平呈正相关,推断HHcy 可能通过对TM 异常甲基化调控而下调其mRNA 表达,进而参与脑梗死的发生发展[6]。考虑到DNA 甲基化调控存在组织、细胞特异性,本实验以主要合成分泌TM 的HUVECs 为研究对象,观察不同浓度Hcy 对HUVECs TM 基因启动子区甲基化状态及mRNA 表达的影响,以体外实验的方法验证上述研究结果,并进一步探究Hcy 影响TM 启动子区甲基化水平的具体机制,以及FA 与EGCG 对Hcy所引起的上述变化的干预作用及机制。
1 材料与方法
1.1 HUVEC 培养与分组无菌条件下复苏HUVECs(锐赛生物医药有限公司惠赠,中国),采用常规条件培养传代,培养液为含10%胎牛血清的DMEM 高糖完全培养基(Gibco,美国)。间隔48 h给予换液操作,细胞长满视野后传代,直至每个培养皿细胞数达106以上进行下一步干预实验。实验分组:对照组(正常生长的HUVECs)、Hcy(Sigma公司,美国)干预组(分别为50、100、200、500、1000 μmol/L Hcy+HUVECs)、Hcy+FA(Sigma 公司,美国)干预组(100 μmol/L Hcy+100 μmol/L FA+HUVECs)与Hcy+EGCG(Sigma 公司,美国)干预组(100 μmol/L Hcy+25 mmol/L EGCG+ HUVECs),每组3个样本,各组均干预24 h。
1.2 流式细胞技术检测HUVECs 的凋亡情况各组细胞用0.25% 胰酶消化1 min,用预冷4℃的DPBS 漂洗2 次,每管加入400 μL Binding Bμffer 重悬细胞,使细胞浓度调整为1×106/mL。取100 μL细胞悬液到5 mL 细胞培养管中,加入5 μL FITC 和PI(BD Biosciences Pharmingen,美国)轻摇混匀,室温避光15 min,经流式细胞仪检测细胞凋亡率,以百分比表示。
1.3 巢式甲基化特异性PCR 法检测TM 基因启动子区甲基化水平用基因组DNA 提取试剂盒(Axygen,美国)提取各组细胞DNA,用EZ DNA Methylation-GoldTMKit 试剂盒(Zymo Rearch,美国)对各组细胞DNA 进行修饰(亚硫酸氢钠)与纯化。为了增加目的片断的产量,本研究采用巢式甲基化特 异 性PCR(nestler methylation specific PCR ,nMSP)法,即先以修饰后的DNA 为模板,用外侧引物(TM-P)进行扩增;然后再用TM-P扩增的产物为模板,用甲基化特异性引物(TM-M)和非甲基化特异性引物(TM-U)分别进行扩增。同时,为了增加目的片断的特异性,本研究使用降落PCR(Touchdown-PCR),即在扩增过程中将每个循环的退火温度降低1℃。最后将PCR 扩增产物经2%琼脂糖凝胶电泳、紫外凝胶成像系统下观察结果并拍照,经Image J 进行灰度分析。引物合成委托上海生工生物工程有限公司完成,引物序列参照本课题组前期研究[6],详见表1。
1.4 荧光实时定量PCR 法检测TM mRNA 表达水平使用RNAiso PLUS(TaKaRa,日本)提取各组细胞总RNA,逆转录试剂盒(Monad,中国)合成cDNA。然后以cDNA 为模板,加入TM 与内参基因β-actin引物与Mix进行荧光实时定量PCR(real-time quantitative PCR,Q-PCR)反应,共40 循环,具体反应条件:95℃预变性5min、95℃变性10s、55℃退火20s、72℃延伸20s。根据各基因Ct值计算PCR 结果:TM基因的表达量用2-ΔCt描述,△Ct=CtTM基因- Ctβ-actin。引物合成委托上海生工生物工程有限公司完成,引物序列参照本课题组前期研究[6],详见表1。

表1 试验中使用的引物
1.5 Western Blot 检测DNMT1 蛋白表达提取各组样品总蛋白,并测定其浓度。加上样缓冲液混合均匀,并在95 ℃条件下变性5 min。每组取总蛋白15 μg 经SDS-PAGE 凝胶80V 电泳30 min、120 V 电泳60 min,90 V 电转膜90 min,用膜封闭液封闭1 h,加入DNMT1 和内参Tubulin 一抗(Novus,美国)4℃过夜,加入相应二抗,室温孵育1 h,TBST 漂洗4 次,将发光液均匀滴在膜上,曝光显影,经凝胶图像成像系统扫描成像,经Image J进行灰度分析。
1.6 统计学方法使用SPSS 26.0 分析实验数据。计量资料以±s表示,多组间计量资料均数的比较,正态分布的数据采用单因素方差分析,非正态分布的数据采用Kruskal-WallisH检验;计数资料以百分数表示,组间均数比较采用χ2检验。检验水准α=0.05。
2 结果
2.1 Hcy 对HUVECs 凋亡的影响及FA、EGCG 的干预作用流式细胞技术检测不同浓度Hcy对各组HUVECs 凋亡的影响,细胞凋亡率=Q2+Q4。结果显示,与对照组相比较,各浓度Hcy 组细胞凋亡率明显升高,且随着Hcy 干预浓度的增加,HUVECs凋亡率呈逐渐上升的趋势,差异有统计学意义(χ2=1411.74,P<0.01)(见图1,表2)。与100 μmol/L Hcy组相比,100 μmol/L Hcy+FA 组、100 μmol/L Hcy+EGCG 组HUVECs 凋亡率明显下降,差异有统计学意义(χ2=196.05,P<0.01)(见图1,表3)。
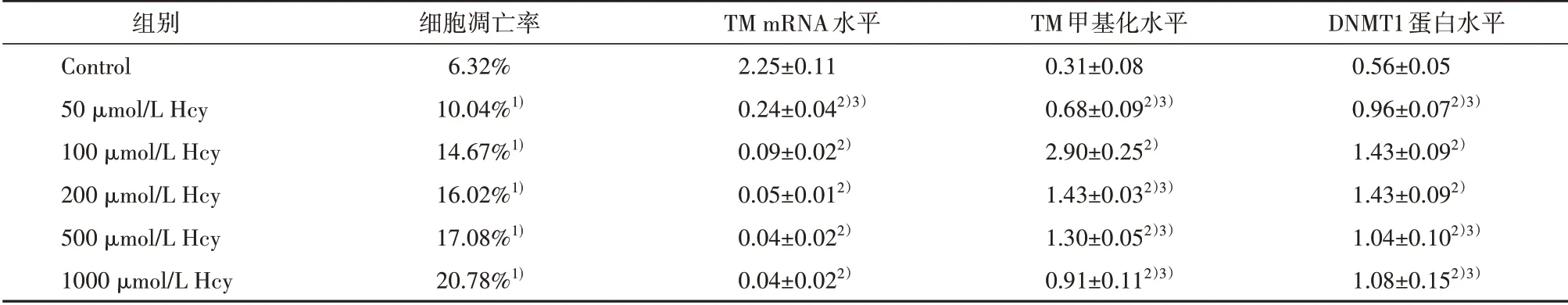
表2 不同浓度Hcy干预后各指标结果

表3 在Hcy干预同时加用FA、EGCG后各指标结果
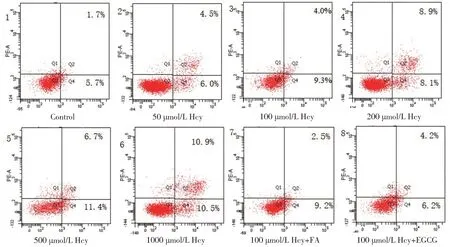
图1 流式细胞技术检测各组HUVECs凋亡率结果图
2.2 Hcy 对HUVECs TM 启动子区甲基化水平的影响及FA、EGCG 的干预作用nMSP 法检测各组HUVECs TM 启动子区甲基化水平。结果显示,各组HUVECs DNA经TM-M和TM-U扩增均有目的条带,分别为图2A 和2C 中的M 和U 条带。经Image J对M 和U 条带分别进行灰度分析,TM 基因的甲基化水平=M 条带灰度值/U 条带灰度值。结果显示,与对照组相比,各浓度Hcy 组TM 基因甲基化水平显著升高,差异有统计学意义(F=161.05,P<0.01)(见图2A,表2)。50、100、200、500、1000 μmol/L Hcy 组HUVECs TM 基因甲基化水平分别为对照组的2.19、9.35、4.61、4.19、2.94 倍。Hcy 对HUVECs TM 基因甲基化水平的影响并非完全呈剂量依赖关系,以100 μmol/L Hcy 组TM 基因甲基化水平最高,而200、500、1000 μmol/L Hcy 组TM 基因甲基化水平反而较100 μmol/L Hcy 组下降,差异有统计学意义(P<0.01)(见图2B)。与100 μmol/L Hcy 组相比,100 μmol/L Hcy+FA 组、100 μmol/L Hcy+EGCG 组TM 基因甲基化水平显著降低,分别为100 μmol/L Hcy 组的65.73%、51.75%,差异有统计学意义(F=255.37,P<0.01)(见图2B,表3)。

图2 nMSP 法检测各组HUVECs TM 启动子区甲基化水平电泳图 A.不同浓度Hcy 干预HUVECs 后nMSP 法检测TM 启动子区甲基化水平电泳图;B.在100 μmol/L Hcy 干预基础上加用FA、EGCG后nMSP 法检测TM 启动子区甲基化水平电泳图。M:经TM-M 扩增后的目的条带,U:经TM-U扩增后的目的条带。
2.3 Hcy 对HUVECs TM mRNA 表达的影响及FA、EGCG 的干预作用Q-PCR 法 检 测 各 组HUVECs TM mRNA 表达水平。结果显示,与对照组相比,各浓度Hcy 组TM mRNA 表达水平显著降低,差异有统计学意义(F=892.05,P<0.01)(见表2)。随着Hcy 干预浓度的增加,TM mRNA 表达水平呈逐渐下降的趋势,50、100、200、500、1000 μmol/L Hcy 组HUVECs TM mRNA 表达水平分别降低至对照组的10.48%、4.13%、2.40%、1.95%、1.64%。与100 μmol/L Hcy 组相比,100 μmol/L Hcy+FA 组、100 μmol/L Hcy+EGCG 组TM mRNA 表达水平显著升高,分别为100 μmol/L Hcy 组的6.17 倍、20.78倍,差异有统计学意义(F=48.02,P<0.01)(见表3)。
2.4 Hcy 对HUVECs DNMT1 蛋白表达水平的影响及FA、EGCG 的干预作用WB 法检测各组HUVECs 的DNMT1 蛋白表达水平。结果显示,与对照组相比,各浓度Hcy 组DNMT1 蛋白表达水平显著升高,差异有统计学意义(F=35.56,P<0.01)(见表2)。50、100、200、500、1000 μmol/L Hcy 组DNMT1蛋白表达水平分别为对照组的1.72、2.55、2.57、1.86、1.93 倍。Hcy 对HUVECs DNMT1 蛋白表 达水平的影响也并非呈完全剂量依赖关系,以100、200 μmol/L Hcy 组DNMT1 蛋白表达水平最高;而500、1000 μmol/L Hcy 组DNMT1蛋白表达水平反而较100 μmol/L Hcy 组下降,差异有统计学意义(P<0.01)。与100 μmol/L Hcy 组相比,100 μmol/L Hcy+FA、100 μmol/L Hcy+EGCG 组DNMT1 蛋白表达水平显著下降,分别为100 μmol/L Hcy 组的54.94%、41.42%,差 异 有 统计 学意 义(F=54.24,P<0.01)(见表3)。
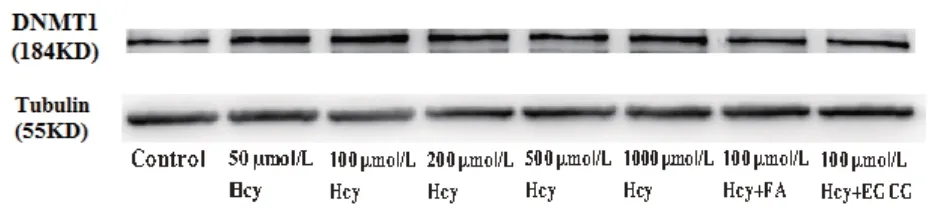
图3 WB法检测各组HUVECs DNMT1蛋白表达
3 讨论
TM 是凝血酶的特异性受体,与凝血酶结合形成凝血酶-TM 复合物,进一步激活蛋白C 系统,发挥抗凝、促纤溶、抗炎、抗血管内皮细胞凋亡的作用。正是由于TM 具有上述生理作用,使其在预防心脑血管疾病及血栓性疾病方面尤为重要。ISERMANN 等[13]研究显示,血管内皮TM 功能缺失的小鼠出生时就容易在动脉和静脉系统中自发形成致死性血栓。
研究表明,HHcy 除了通过增加氧化应激、损伤血管内皮功能等经典机制外,还可通过调控DNA甲基化而致病[9,14]。Hcy 在体内经蛋氨酸代谢途径可生成S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)和S -腺苷同型半胱氨酸(S-adenosyl- homocysteine ,SAH)。SAM 是DNA 甲基化调控过程中唯一的甲基供体,而高浓度的SAH是体内DNMT有效的竞争性抑制剂[15]。DNMT 是DNA 甲基化过程的关键酶,其中属于维持甲基化酶的DNMT1 最为重要。本研究显示,Hcy 干预可通过升高HUVECs DNMT1 的蛋白表达水平而上调TM 启动子区的甲基化水平,且这种影响并非完全呈剂量依赖关系,于100 μmol/L Hcy 组最高。BEHERA 等[16]研究发现,Hcy 可通过激活Jun/JNK 信号通路增加DNMT1基因的转录表达。我们前期的病例对照研究结果显示,脑梗死患者外周血TM 甲基化水平与血浆Hcy 浓度呈正相关,且脑梗死患者血浆Hcy 浓度很少能超过100 μmol/L。本次体外实验发现,当Hcy干预浓度≤100 μmol/L 时,HUVECs TM 基因甲基化水平随着Hcy 干预浓度的增加而增加,与上述病例-对照结果基本一致。当Hcy干预浓度大于100 μmol/L时,HUVECs TM 启动子区甲基化水平反而回落。我们推测,随着Hcy水平的增高,当TM 基因甲基化水平升高到一定程度时,作为机体的代偿,去甲基化可能会被同时启动。正如MOHAMMAD 等[17]研究显示,用高糖和Hcy 干预视网膜血管内皮细胞后,可同时激活DNMTs 和羟甲基化(一种去甲基化机制)的关键酶10-11 易位蛋白(ten-eleven translocations,TETs)。
发生在基因启动子区的异常高甲基化可下调其转录表达[18]。本研究发现,Hcy 干预可明显降低HUVEC TM mRNA 表达水平,且表现出随着Hcy 干预浓度的增加,其表达水平逐渐降低的趋势。之所以不同浓度Hcy 调控HUVEC TM mRNA 表达水平的规律与对TM 基因甲基化调控的规律不完全对应,考虑Hcy 调控TM 基因转录表达仍有其它机制参与的可能。且本研究结果显示,Hcy 可以引起HUVECs 的凋亡增加,与既往文献报告一致[19]。TM与凝血酶结合后激活蛋白C,生成活化蛋白C;后者可进一步通过激活蛋白酶激活受体1(protease activated receptor 1,PAR1)信号通路发挥对血管内皮细胞的保护作用[4]。因此,我们推测Hcy 可能通过下调TM 的转录表达而诱导HUVECs 的凋亡增加。
FA 可 通 过降低Hcy 水平;抑 制MTHFR 的 活性,减少甲基供体SAM 的生成;下调DNMT3a、DNMT1 的表达等机制逆转DNA 的异常高甲基化[20-22]。EGCG 属于儿茶酚-O-甲基转移酶的抑制剂,而DNMT 和儿茶酚-O-甲基转移酶同属于SAM依赖甲基转移酶超家族,二者催化中心的结构相似,因此EGCG 能够通过抑制DNMT 的活性逆转DNA异常高甲基化[23]。本研究发现,FA与EGCG均可通过降低HUVECs DNMT1 蛋白表达,逆转Hcy引起的TM启动子区高甲基化,恢复其mRNA表达,进而减轻Hcy所引起的HUVECs损伤。
综上所述,Hcy 可能通过上调HUVECs DNMT1蛋白表达水平,引起TM基因启动子区高甲基化,进而下调TM mRNA 表达,诱导HUVECs 凋亡。而FA和EGCG 可以逆转Hcy 所引起的上述改变。我们推测,Hcy 通过DNA 甲基化调控机制下调TM 转录表达,降低TM的抗凝、促纤溶、抗炎、抗血管内皮细胞凋亡等作用,进而参与心脑血管疾病的发生发展,而FA 和EGCG 有望成为预防与治疗心脑血管疾病的有效方法。
