高频超声及剪切波弹性成像评估乳腺癌放疗患者胸壁皮肤变化的临床价值
2022-10-31黄薪儒于粒粒岳文胜
黄薪儒 于粒粒 岳文胜
乳腺癌现已成为全球女性癌症发病首位,占所有癌症病例的11.7%,是女性最常见的癌症死亡原因[1]。术后放疗可有效降低胸壁等局部复发及乳腺癌相关死亡,然而放疗会引起多种辐射后不良反应,高达95%的患者可因电离辐射引起放射性皮炎[2]。临床上最常用的评价放射性皮炎的标准为美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)分级,但放疗医师判定时可能因主观性、临床经验不足等导致结果存在偏差,因此寻找更标准、可靠的辅助评估手段对乳腺癌的诊断、防治及预后评估均有重要的临床意义[3]。本研究旨在应用高频超声及剪切波弹性成像(shear wave elastography,SWE)评估乳腺癌患者术后放疗对胸壁皮肤厚度及硬度的影响,并分析RTOG分级的影响因素。
资料与方法
一、研究对象
选取2021年2~11月于我院拟行手术后放疗的女性乳腺癌患者54例(放疗组),根据手术方式不同分为保乳术组18例,年龄32~61岁,平均(43.89±8.32)岁,平均体质量指数(23.43±3.28)kg/m2,平均体表面积(1.67±0.11)m2,放射剂量50.4 Gy/28次,每次1.8 Gy;根治术组36例,年龄25~68岁,平均(48.61±9.01)岁,平均体质量指数(24.24±3.46)kg/m2,平均体表面积(1.65±0.13)m2,放射剂量50.0 Gy/25次,每次2.0 Gy。另选同期健康女性志愿者44例(对照组),年龄30~67岁,平均(50.55±7.39)岁,平均体质量指数(24.03±2.12)kg/m2,平均体表面积(1.65±0.07)m2;以及术后暂未行放疗的女性乳腺癌患者32例(未放疗组),年龄31~58岁,平均(48.61±8.45)岁,平均体质量指数(23.87±3.34)kg/m2,平均体表面积(1.60±0.13)m2,包括保乳术10例,根治术22例。排除标准:①系统性硬化症、干燥综合征等可引起皮肤损害的结缔组织病;②内分泌代谢疾病;③健康志愿者被测部位有皮肤瘢痕、妊娠、皮肤病、乳腺相关病史等;④乳腺癌胸壁皮肤转移者;⑤耦合剂过敏者。对照组、放疗组及未放疗组年龄、体质量指数、体表面积等比较差异均无统计学意义。本研究经我院医学伦理委员会批准,入选者均知情同意。
二、仪器与方法
1.超声检查:使用法国声科Aixplorer彩色多普勒超声诊断仪,SL15-4线阵探头,频率4~15 MHz。受试者取仰卧位,双上肢上展,以乳头为中心于乳腺4个象限分别取4个对应坐标点并标记,乳腺癌患者避开手术瘢痕,可上移或下移1 cm。皮肤与探头之间由耦合剂充填,保持探头与皮肤垂直,且不施加任何压力。选用“superficial thyroid”模式,深度调节至2 cm处,Focus调节至皮肤层水平,嘱受试者屏住呼吸,测量皮肤层厚度,每个部位测量3次取平均值。然后切换至SWE模式,调节弹性模量scale为0~100 kPa,移动感兴趣区位置使皮肤层位于中间,图像充填满意时稳定探头约5 s,冻结图像。将取样框直径调至1 mm,保证取样框包含皮肤真皮层,测量皮肤弹性值。每个部位测量3次取平均值。计算皮肤厚度比(skin thickness ratio,STRA)和 皮 肤 弹 性 比(skin elasticity ratio,SERA),即乳腺癌患者放疗侧与健侧胸壁皮肤厚度、弹性模量值比值,或健康志愿者右侧与左侧胸壁皮肤厚度、弹性模量值比值。所有超声检查均由一名经验丰富的超声医师完成,并由另一名超声医师测量超声参数。放疗组于放疗前和放疗第1、3、5周后分别行超声检查,未放疗组于术后第3、4个月复查时分别行超声检查。
2.临床资料获取:收集各组受试者年龄、身高、体质量等资料,收集放疗组患者手术至开始放疗的间隔时间、腋窝手术方式(单纯腋窝前哨淋巴结活检或腋窝淋巴结清扫),在模拟CT定位上测量放疗组患者健侧乳房大小、双侧腋窝脂肪厚度。放疗组每次检查时均由一名经验丰富的放疗医师对放疗区域皮肤进行RTOG分级并记录,以RTOG分级≥2级(即皮肤表现为触痛或鲜色红斑、片状湿性脱皮或中度水肿)判为出现皮肤毒性反应。
三、统计学处理
应用SPSS 25.0统计软件,计量资料均呈正态分布,以±s表示,多组比较采用方差齐性检验及共线性诊断,事后多重比较采用Welch单因素方差分析及Games-Howell检验。未放疗组术后不同时间STRA、SERA比较采用Wilcoxon符号秩检验。放疗组手术至开始放疗的间隔时间与STER、SERA的相关性分析采用Pearson相关分析法。STRA、SERA随放疗时间的变化评估采用重复测量方差分析。采用二分类Logistic回归分析影响RTOG分级的危险因素。P<0.05为差异有统计学意义。
结 果
一、对照组、保乳术组和根治术组放疗前STRA、SERA比较
对照组、保乳术组和根治术组放疗前STRA分别为1.00±0.04、1.14±0.21、1.07±0.08,SERA分别为1.02±0.20、1.21±0.32、2.19±0.92,各组STRA、SERA比较差异均有统计学意义(均P<0.05)。保乳术组和根治术组放疗前STRA均高于对照组,差异均有统计学意义(均P<0.05),保乳术组与根治术组放疗前STRA比较差异无统计学意义;根治术组放疗前SERA均高于保乳术组和对照组,差异均有统计学意义(均P<0.05),保乳术组放疗前SERA与对照组比较差异无统计学意义。
二、未放疗组术后不同时间STRA、SERA比较
未放疗组32例患者中,行保乳术与根治术治疗的患者术后第4个月STRA、SERA较术后第3个月均增加,但差异均无统计学意义。见表1。
表1 未放疗组术后不同时间STRA、SERA比较(±s)
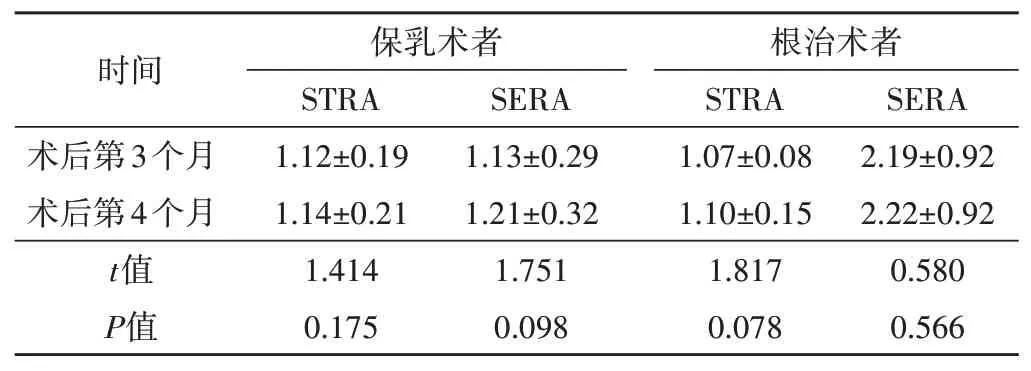
表1 未放疗组术后不同时间STRA、SERA比较(±s)
STRA:皮肤厚度比;SERA:皮肤弹性比
?
三、相关性分析
相关性分析结果表明,放疗组手术至开始放疗的间隔时间与STRA、SERA均无相关性(r=-0.226、-0.034,P=0.100、0.807)。见图1。
四、STRA、SERA随放疗时间的变化趋势
1.STRA分析显示:保乳术组与根治术组放疗前及放疗后第1、3、5周STRA比较,差异均无统计学意义。保乳术组从放疗前至放疗后第3周STRA变化差异无统计学意义,放疗后第5周时STRA较前显著增高,差异有统计学意义(P<0.05);根治术组从放疗前至放疗后第5周STRA变化差异无统计学意义。手术方式与放疗时间对STRA的交互效应无统计学意义(F=0.808,P>0.05)。见表2和图2,3。
2.SERA分析显示:根治术组放疗前及放疗后第1、3、5周SERA均明显高于保乳术组,差异均有统计学意义(均P<0.05)。保乳术组从放疗前至放疗后第5周SERA变化差异无统计学意义;根治术组SERA随着放疗时间增加而逐渐增高,两两比较差异均有统计学意义(均P<0.05)。手术方式与放疗时间对SERA的交互效应有统计学意义(F=3.858,P<0.05)。见表2和图2,3。
表2 保乳术组和根治术组不同时间STRA、SERA比较(±s)
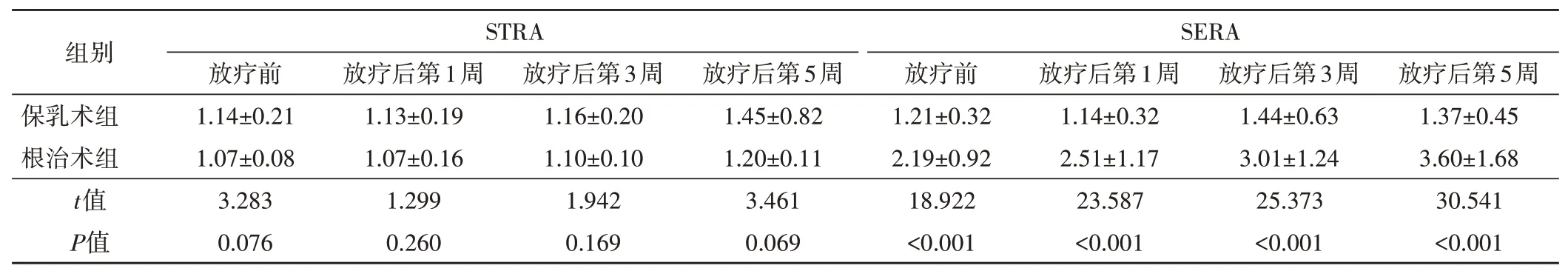
表2 保乳术组和根治术组不同时间STRA、SERA比较(±s)
STRA:皮肤厚度比;SERA:皮肤弹性比
?
五、影响RTOG分级的危险因素分析
纳入STRA、SERA构建的二分类Logistic回归方程为:Y(Logit)=0.452×STRA×10+0.502×SERA-6.173×常数项,结果表明SERA、STRA可增加RTOG分级的风险(OR=1.570、1.650,均P<0.05)。见表3。将放疗后第5周出现皮肤毒性反应为因变量,腋窝手术方式、健侧乳房大小、双侧腋窝脂肪厚度为自变量,Logistic回归分析结果表明腋窝手术方式是影响RTOG分级的危险因素(OR=3.903,95%可信区间:1.023~14.893,P<0.05),见表4。
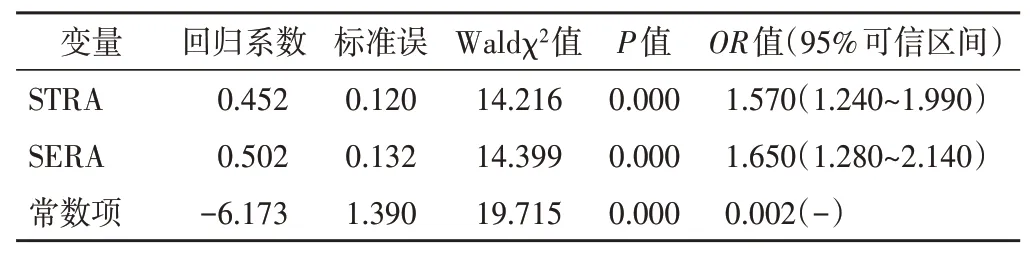
表3 STRA、SERA与RTOG分级的Logistic回归分析结果
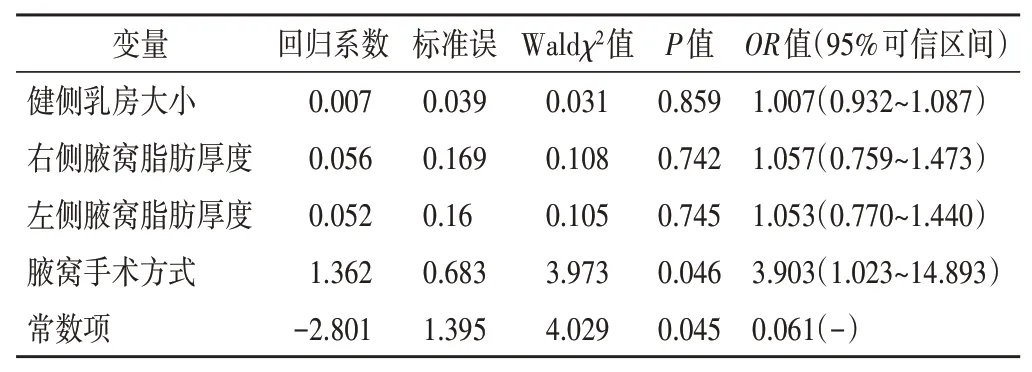
表4 放疗后第5周一般资料与RTOG分级的Logistic回归分析结果
讨 论
随着乳腺癌患者生存率逐年增加,越来越多的患者饱受术后、放疗后并发症的困扰,如乳腺癌相关淋巴水肿、放疗区域皮肤长期疼痛或发热、色素沉着等[4],严重影响患者的生活质量。本研究结果发现,保乳术组和根治术组术后(放疗前)STRA均较对照组增高(均P<0.05),分析可能与手术创伤、淋巴结活检或清扫引起回流不畅导致皮肤层水肿等有关。皮肤超声检查可有效评估皮肤水肿及皮下软组织层积液随着时间推移的演变程度[5]。研究[6]发现前胸壁皮肤层增厚可能是评估乳房和/或手臂淋巴水肿的早期指标,有助于临床医师早期识别潜在的乳腺癌相关淋巴水肿患者。本研究结果发现根治术组放疗前SERA较保乳术组、对照组均增高(均P<0.05),分析原因可能与皮肤纤维化有关。纤维化是机体内各种化学、物理、生物损伤的共同反应过程,手术和放疗造成的损伤均可引发急性炎症反应,并伴有成纤维细胞聚集和细胞外基质沉积和活化[7]。本研究通过复查未放疗组乳腺癌术后间隔一个月时间的皮肤厚度、弹性变化,发现STRA、SERA比较差异均无统计学意义,表明术后反应在短期内对皮肤的影响并不明显。
本研究结果还发现,随着放疗时间的增加,电离辐射对保乳术组、根治术组患者皮肤厚度和弹性均产生了不同影响。保乳术组主要表现为皮肤增厚而弹性值变化不明显,根治术组以皮肤弹性值增高更显著。分析其原因,可能与不同手术方式对皮肤层创伤的程度、乳房切除后皮肤层张力增加、分割剂量大小及累积放射剂量等不同有关。
目前放射性皮炎的评估标准有RTOG分级、常见不良反应事件评价标准评分,均是以主观的视觉和触觉为基础的评分量表,缺乏客观的衡量标准,存在操作者主观性强、评估准确率欠佳、皮肤受累较轻时不敏感等局限。Yoshida等[8]分析了超声评估放射性皮炎的可行性,发现皮肤厚度变化与RTOG分级相关,表明应用超声检测皮肤厚度变化可作为评估放射性皮炎的可靠方法。腋窝位于放疗外场的入口处,由于不同腋窝手术方式对腋窝结构破坏不同,可能导致放射剂量不均匀,从而影响RTOG分级[9]。本研究结果也发现腋窝手术方式、STRA、SERA均与RTOG分级相关,通过上述指标能有效监测电离辐射对皮肤的损伤情况。
此外,SWE与常规超声类似,也受到伪影的影响从而导致测量结果的准确性下降,常见的伪影包括混响伪影、穿透受限、组织运动伪影和近场失真(也称预压伪影)等。SWE用于浅表部位时常由于预压伪影导致高估测量部位弹性模量值,这种伪影形成是由于成像时对换能器不经意间施加的压力会压缩换能器头部附近的组织,而远离换能器的组织不受影响[10]。通过对探头表面涂抹适量的耦合剂,增加皮肤层与换能器间的距离,可降低预压伪影对测量结果的影响。
综上所述,乳腺癌患者术后放疗可导致胸壁皮肤厚度、弹性出现不同程度改变,且不同手术方式对患者的胸壁皮肤厚度、弹性的影响不同,其中保乳术患者主要表现为皮肤增厚,而根治术患者主要表现为皮肤弹性增高。应用超声评估乳腺癌患者术后放疗对胸壁皮肤厚度及硬度的影响,有助于评估患者皮肤毒性反应,为临床决策提供客观影像学依据。
