紫花地丁总香豆素提取工艺优化及其抗氧化和抗肿瘤活性考察Δ
2022-10-31陈仁强胡慧玲李林锋西南医科大学药学院四川泸州646000西南医科大学附属医院药学部四川泸州646000
陈仁强,刘 桢,胡慧玲,李林锋,张 春#(.西南医科大学药学院,四川 泸州 646000;2.西南医科大学附属医院药学部,四川泸州 646000)
紫花地丁是堇菜科堇菜属植物紫花地丁Viola yedoensisMakino的干燥全草,具有清热解毒、凉血消肿的功效[1]。现代药理研究证实,紫花地丁具有抗菌、抗肿瘤等多种生物活性[2]。已有研究表明,紫花地丁提取物可通过靶向蛋白酶等方式抑制肺癌细胞侵袭,对人非小细胞肺癌细胞A549 具有抑制作用,且其黄酮类成分还具有显著的抗氧化活性[3-5]。
香豆素类成分是植物中一类重要的次生代谢产物,具有抗凝血、抗菌、抗病毒等多种生物活性[6]。紫花地丁含有丰富的香豆素类成分,如秦皮乙素、秦皮甲素等[7]。本研究拟采用乙醇回流提取法提取紫花地丁总香豆素,利用响应面法优化其提取工艺,并初步评价所得纯化物的抗氧化活性和抗肿瘤活性,旨在为该药材的开发与利用提供参考依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Cary60 型紫外-可见分光光度计、Multiskan Go 型多功能酶标分析仪(美国Thermo Fisher Scientific 公司),CKX53-SLP 型倒置相差显微镜(日本Olympus公司),TS2R-LS型荧光倒置显微镜(日本Nikon公司),TD-5Z型低速离心机(四川蜀科仪器有限公司)等。
1.2 主要药品与试剂
紫花地丁药材(批号2001004)购自亳州市远光中药饮片厂,由西南医科大学药学院中药资源与鉴定教研室庄元春副教授鉴定为真品。
秦皮乙素对照品(批号5483,纯度99.3%)购自上海诗丹德生物技术有限公司;无水乙醇、过硫酸钾、抗坏血酸(批号20190528,纯度99.7%)均购自成都金山化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2-苯基-4,4,5,5-四甲基咪唑啉-3-氧代-1-氧(2-phenyl-4,4,5,5-tetramethylimidazoline-3-oxide-1-oxyl,PTIO)(批号分别为BTSJ18X80、BTSJ2020-0602)均购自成都润泽本土化工有限公司;2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic) acid ammonium salt,ABTS,批号L1803054)购自阿拉丁试剂(上海)有限公司;CCK-8 试剂盒(批号TN618)购自北仁化学科技(北京)有限公司;Hoechst 33258 试剂盒(批号20210708)购自北京索莱宝科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)试 剂 盒(批 号 分 别 为20210721、20201223)均购自南京建成生物工程研究所;水为超纯水。
1.3 细胞
人宫颈癌细胞HeLa、人胆管细胞型肝癌细胞HCCC-9810、人肝癌细胞HepG2、人乳腺癌细胞MDAMB-231 和人非小细胞肺癌细胞A549 均购自中国科学院上海生科院细胞资源中心。
2 方法与结果
2.1 紫花地丁总香豆素含量的测定
采用紫外-可见分光光度法测定紫花地丁总黄酮的含量(以秦皮乙素计)。
2.1.1 标准曲线的绘制 精密称取秦皮乙素对照品适量,用甲醇溶解,得质量浓度为354 μg/mL的储备液,贮存于2~8 ℃冰箱内,备用。取上述储备液1 mL,以甲醇定容于10 mL 量瓶内,得质量浓度为35.4 μg/mL 的母液。分别取该母液0.50、0.75、1.00、1.25、1.50 mL,用甲醇定容于5 mL 量瓶内,使用紫外-可见分光光度计于350 nm 处测定吸光度。以秦皮乙素的质量浓度为横坐标(x)、吸光度为纵坐标(y)绘制标准曲线,得秦皮乙素的回归方程为y=0.065 5x-0.023 6(R2=0.999 3),提示其检测质量浓度的线性范围为3.54~10.63 μg/mL。
2.1.2 供试品溶液的制备 将干燥紫花地丁药材粉碎,过四号筛后保存,备用。称取上述粉末3.00 g,装于无纺布内密封,采用乙醇回流提取法提取2次,过滤,合并滤液后用乙醇定容至250 mL量瓶内,即得供试品溶液。
2.1.3 总香豆素含量及得率的测定 取“2.1.2”项下供试品溶液5 mL于10 mL离心管内,以1 000 r/min离心4 min,取上清液3 mL,置于100 mL 量瓶内,用乙醇定容,使用紫外-可见分光光度计于350 nm 处测定吸光度,代入“2.1.1”项下回归方程计算总香豆素的质量浓度并按下式计算得率:Y=NVC/M[式中,Y为紫花地丁总香豆素得率(mg/g),N为稀释倍数,V为供试品溶液总体积(mL),C为总香豆素质量浓度(mg/mL),M为紫花地丁的质量(g)]。在此之前,按2020年版《中国药典》(四部)“分析方法验证指导原则”进行方法学考察,结果均符合相关规定[8]。
2.2 紫花地丁总香豆素提取工艺的优化

图1 液料比、提取时间、乙醇体积分数对紫花地丁总香豆素得率的影响
2.2.1 单因素实验 按“2.1.2”项下方法操作,采用乙醇回流提取法提取紫花地丁总香豆素。设置乙醇体积分数为65%,提取时间为2 h,提取2 次,考察不同液料比[10∶1、15∶1、20∶1、25∶1、30∶1,mL/g(下同)]对紫花地丁总香豆素得率的影响;设置乙醇体积分数为65%,液料比为20∶1,提取2次,考察不同提取时间(1、1.5、2、2.5、3 h)对紫花地丁总香豆素得率的影响;设置液料比为10∶1,提取时间为1 h,提取2 次,考察不同乙醇体积分数(35%、45%、55%、65%、75%)对紫花地丁总香豆素得率的影响。结果见图1。由图1A 可知,在液料比从15∶1 升至25∶1 的过程中,紫花地丁总香豆素得率逐渐增加;当继续增加液料比,其得率反而降低。当液料比为25∶1时,紫花地丁总香豆素得率最高(20.79 mg/g)。由图1B可知,在提取时间从1 h延长至2 h的过程中,紫花地丁总香豆素得率逐渐升高,并在2 h 时达到最大值(20.91 mg/g);当提取时间超过2 h后,其得率急剧下降,可能与提取时间过长会导致某些热稳定性较差的香豆素遭到破坏降解有关。由图1C可知,随着乙醇体积分数的逐渐增加,紫花地丁总香豆素得率呈先急剧上升后缓慢下降的趋势;当乙醇体积分数为65%时,紫花地丁总香豆素得率最高(17.82 mg/g)。
2.2.2 响应面实验 在单因素实验的基础上,本研究利用Box-Behnken 设计原理进行3 因素3 水平的响应面实验:以紫花地丁总香豆素得率(Y)为响应值,以液料比(A)、提取时间(B)、乙醇体积分数(C)为变量,优化紫花地丁总香豆素提取工艺。具体的因素与水平见表1,实验设计与结果见表2。

表1 紫花地丁总香豆素提取工艺优化响应面实验的因素与水平
采用Design Expert 8.0.6 软件对表2 结果进行回归分析,得多元二次回归方程Y=20.65-0.16A-0.17B+0.79C-0.31AB+0.54AC+0.17BC-0.46A2-0.34B2-0.17C2;随后,对回归方程进行方差分析,结果见表3。由表3可知,所得多元二次回归方程的F为12.30(P<0.01),说明该模型的拟合度良好。3 个因素中,因素C对模型有显著影响(P=0.000 5);在二次项中,A2、C2亦对模型有显著影响(P<0.05或P<0.01),而B2对模型的影响不显著(P>0.05)。
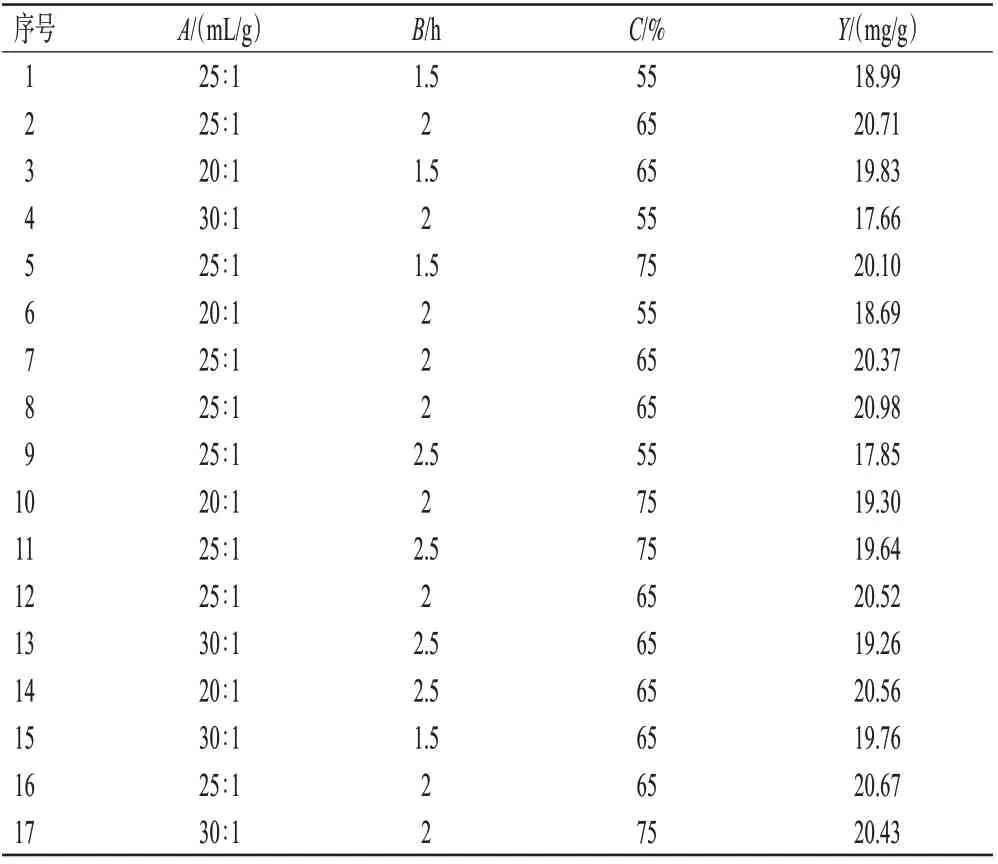
表2 紫花地丁总香豆素提取工艺优化响应面实验的设计与结果

表3 紫花地丁总香豆素提取工艺优化响应面实验的方差分析结果
为评价各因素的交互作用,本研究采用Design Expert 8.0.6 软件绘制响应面图及等高线图,结果见图2。由图2可知,液料比与乙醇体积分数的交互作用较明显,其对紫花地丁总香豆素得率的影响最大。
利用Design Expert 8.0.6 软件求解上述多元二次回归方程,得紫花地丁总香豆素的最优提取工艺为:液料比25.5∶1、提取时间1.89 h、乙醇体积分数68.43%,预测紫花地丁总香豆素得率为20.79 mg/g。考虑到实际操作的可行性,本研究将最优提取工艺参数调整为:液料比25∶1、提取时间1.9 h、乙醇体积分数68%。按此提取工艺进行3次验证实验,得紫花地丁总香豆素平均得率为(21.10±0.17)mg/g,RSD 为0.80%(n=3),与预测值的相对误差为1.49%,表明该提取工艺稳定、可行。
2.3 紫花地丁总香豆素纯化物的制备
按“2.2”项下最优提取工艺制得紫花地丁总香豆素提取物,按照相关文献的方法[9],使用HPD-100型大孔吸附树脂以50%乙醇洗脱,得到紫花地丁总香豆素纯化物(淡黄色粉末,总香豆素含量以秦皮乙素计为43.8%)。

图2 因素A、B、C 交互作用对紫花地丁总香豆素得率影响的响应面和等高线图
2.4 紫花地丁总香豆素抗氧化活性的评价
2.4.1 DPPH 自由基清除率 参照相关文献的方法[10],称取DPPH 8.00 mg,加一定量95%乙醇超声溶解并稀释,制成浓度为0.2 mmol/L 的DPPH 溶液。分别吸取95%乙醇100 μL 和DPPH 溶液100 μL 于96 孔板中,避光反应30 min,于517 nm处测定各孔的吸光度。将紫花地丁香豆素纯化物用95%乙醇溶解并稀释至4、8、16、32、64、128、256 μg/mL,以相同质量浓度的抗坏血酸作为阳性对照,分别吸取上述待测液100 μL于96孔板中,再加入的DPPH溶液或95%乙醇100 μL混合,避光反应30 min,于517 nm 处测定各孔的吸光度,按下式计算DPPH自由基清除率:DPPH自由基清除率=[A0-(A1-A2)]/A0×100%(式中,A0为95%乙醇+DPPH 溶液的吸光度,A1为待测液+DPPH溶液的吸光度,A2为待测液+95%乙醇的吸光度)。实验重复3 次。结果(图3A)显示,与抗坏血酸比较,紫花地丁总香豆素纯化物对DPPH自由基的清除能力稍弱;紫花地丁总香豆素纯化物和抗坏血酸对DPPH 自由基的半数抑制浓度(IC50)分别为21.54、15.21 μg/mL。

图3 紫花地丁总香豆素纯化物对DPPH、ABTS 和PTIO自由基的清除情况
2.4.2 ABTS自由基清除率 在相关文献方法[11]的基础上稍做改进,取7.4 mmol/L 的ABTS 乙醇溶液、2.6 mmol/L的过硫酸钾溶液各2 mL,混合后,避光放置16 h,得ABTS储备液。将上述储备液用50%乙醇稀释后,得ABTS 工作液(在734 nm 处的吸光度宜为0.70±0.02)。将紫花地丁总香豆素纯化物用50%乙醇溶解并稀释至4、8、16、24、32、64、128、256 μg/mL,以相同质量浓度的抗坏血酸作为阳性对照,分别吸取上述待测液40 μL于96 孔板中,再加入ATBS 工作液或50%乙醇160 μL,摇匀,避光反应8 min,于734 nm 处测定各孔的吸光度,按下式计算ABTS 自由基清除率:ABTS 自由基清除率=[A0-(A1-A2)]/A0×100%(式中,A0为50%乙醇40 μL+ABTS 工作液160 μL 的吸光度,A1为待测液40 μL+ABTS溶液160 μL的吸光度,A2为待测液40 μL+50%乙醇160 μL 的吸光度)。实验重复3 次。结果(图3B)显示,与抗坏血酸比较,紫花地丁总香豆素纯化物对ABTS 自由基的清除能力稍弱,紫花地丁总香豆素纯化物和抗坏血酸对ABTS 自由基的IC50分别为17.11、12.45 μg/mL。
2.4.3 PTIO自由基清除率 参照相关文献的方法[12],称取PTIO 7.50 mg,溶于磷酸盐缓冲液(pH7.4,下同)15 mL中,得质量浓度为0.5 mg/mL的PTIO溶液。将紫花地丁总香豆素纯化物用磷酸盐缓冲液溶解并稀释至4、8、16、32、64、128、256 μg/mL,以相同质量浓度的抗坏血酸作为阳性对照,分别吸取上述待测液40 μL 于96 孔板中,再加入PTIO溶液或磷酸盐缓冲液160 μL,摇匀,避光反应2 h,于557 nm 处测定各孔的吸光度值,按下式计算PTIO 自由基清除率:PTIO 自由基清除率=[A0-(A1-A2)]/A0×100%(式中,A0为磷酸盐缓冲液40 μL+PTIO溶液160 μL 的吸光度,A1为待测液40 μL+PTIO 溶液160 μL 的吸光度,A2为待测液40 μL+磷酸盐缓冲液160 μL的吸光度)。实验重复3 次。结果(图3C)显示,与抗坏血酸比较,紫花地丁总香豆素纯化物对PTIO 自由基的清除能力较弱,紫花地丁总香豆素纯化物和抗坏血酸对PTIO自由基的IC50分别为1 422.01、37.20 μg/mL。
2.5 紫花地丁总香豆素纯化物抗肿瘤活性的评价
2.5.1 细胞存活率 参考相关文献的方法[13],取对数生长期的HeLa、HCCC-9810、HepG2、MDA-MB-231、A549细胞,分别用胰蛋白酶消化,离心后调整细胞密度为1×105个/mL,按每孔0.1 mL 接种于96 孔板中,于37 ℃、5%CO2条件下培养24 h,吸出原培养基,每孔加入含药培养基(参考预实验结果,将紫花地丁总香豆素纯化物的质量浓度分别设置为20、60、100、140、180、220、260、300 μg/mL)100 μL(每质量浓度设置3个复孔),同时设置空白孔(只含培养基)和对照孔(含细胞和培养基)。常规培养24 h,加入CCK-8 试剂10 μL,继续培养45 min,使用酶标仪于450 nm处测定各孔的光密度(OD)并按下式计算细胞存活率:细胞存活率=(OD1-OD0)/(OD2-OD0)×100%(式中,OD0、OD1、OD2分别为空白孔、含药孔、对照孔的OD)。结果显示,紫花地丁总香豆素纯化物对上述5种肿瘤细胞均有一定的抑制作用,其IC50分别为(113.18±15.97)、(51.17±1.72)、(134.15±11.75)、(171.83±15.27)、(93.38±4.65)μg/mL。
2.5.2 细胞凋亡形态 由“2.5.1”项下结果可知,紫花地丁总香豆素纯化物对HCCC-9810 细胞的抑制作用相对较强,因此选取对数生长期的HCCC-9810 细胞,按“2.5.1”项下方法配制细胞悬液并接种于6 孔板中,培养过夜,在参考预实验结果的基础上,以0(对照组)、20、60、180 μg/mL的紫花地丁总香豆素纯化物(每组设置3个复孔)作用24 h后,吸出培养基,细胞用磷酸盐缓冲液清洗2 次,以Hoechst 33258 试剂染色后,置于倒置相差显微镜和荧光倒置显微镜下观察细胞的凋亡形态并拍照。结果(图4)显示,对照组细胞呈近椭圆形,染色后呈蓝色且均匀、浅淡;随紫花地丁总香豆素纯化物浓度的增加,含药组细胞数量逐渐减少,细胞核开始出现明显的固缩或分裂,多数细胞核呈现出较强的蓝白色碎块状荧光,即典型的凋亡细胞核特征。
2.5.3 肿瘤细胞中LDH、SOD 含量 按“2.5.2”项下接种、培养HCCC-9810细胞,待作用24 h后,吸出培养基,细胞用磷酸盐缓冲液清洗2次,消化,以1 000 r/min离心5 min,超声(功率180 W,频率40 kHz)后收集于2 mL离心管内,使用酶标仪检测各组细胞中LDH、SOD含量,严格按照各试剂盒说明书操作。采用SPSS 17.0软件进行统计分析并使用GraphPad Prism 8软件绘图,数据以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,检验水准α=0.05。结果(图5)显示,20、60、180 μg/mL的紫花地丁总香豆素纯化物可显著增加HCCC-9810 细胞中LDH 含量,并可显著降低细胞中SOD含量(P<0.05或P<0.01)。

图4 紫花地丁总香豆素纯化物对HCCC-9810 细胞凋亡影响的荧光显微图(Hoechst 33258染色,×200)

图5 紫花地丁总香豆素纯化物对HCCC-9810 细胞中LDH和SOD含量的影响(±s,n=3)
3 结论
本研究采用单因素实验和响应面实验对紫花地丁总香豆素的提取工艺进行了优化,得最优提取工艺为液料比25∶1,提取时间1.9 h,乙醇体积分数68%。验证实验显示,该工艺稳定、可行。
DPPH 和ABTS 为氮自由基,DPPH 自由基及ABTS自由基清除法被广泛用于中药提取物体外抗氧化活性研究领域[14]。在此基础上,本研究还选择了PTIO自由基清除法考察体外抗氧化活性。PTIO是一种常用的一氧化氮清除剂,其带电基团为氧原子[12]。本研究结果显示,紫花地丁总香豆素纯化物对DPPH、ABTS自由基的清除能力略弱于抗坏血酸,但对PTIO 自由基的清除能力较弱,这可能是由于PTIO 自由基清除法主要用于水相体系,而紫花地丁总香豆素水溶性较低,故其清除效果不佳。
抗肿瘤活性研究显示,紫花地丁总香豆素纯化物对HeLa、HCCC-9810、HepG2、MDA-MB-231、A549 细胞均有一定的抑制作用,其中对HCCC-9810 细胞的抑制效果最强,其IC50相对最低,因此进一步考察了紫花地丁总香豆素纯化物对HCCC-9810 细胞凋亡形态的影响,发现紫花地丁总香豆素纯化物能促进该细胞的凋亡。细胞中的LDH 含量与细胞膜的完整性相关,凋亡细胞越多,LDH含量越高[15]。细胞中的SOD可抵抗细胞的氧化应激反应,其含量变化可以反映细胞活力的高低,细胞活力越高,SOD 含量越高[16]。本研究结果显示,随着紫花地丁总香豆素纯化物质量浓度的增加,HCCC-9810细胞中LDH含量逐渐增加,SOD含量逐渐降低。
综上所述,本研究优化了紫花地丁总香豆素的提取工艺,所得提取物的纯化物具有抗氧化活性和抗肿瘤活性。
