金针菇多糖对大豆分离蛋白凝胶的增强作用及其结构表征
2022-10-31潘泓杉马高兴赵立艳胡秋辉
潘泓杉,马高兴,裴 斐,马 宁,仲 磊,赵立艳,胡秋辉,
(1.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏 南京 210023;2.南京农业大学食品科学技术学院,江苏 南京 210095)
大豆分离蛋白(soy protein isolate,SPI)作为目前商业化程度较高的植物蛋白,具有成本低廉、易于获取、氨基酸平衡且营养价值高等优点。凝胶性是大豆蛋白的重要性质,由于其水凝胶具有高营养、高生物相容性等优点,在食品领域具有营养补充、包埋递送风味和活性物质等多种应用。但纯大豆蛋白水凝胶具有力学性能不足、溶解性差等多种问题,限制了大豆蛋白水凝胶在食品领域的应用。
热处理及化学改性是改善大豆蛋白水凝胶性质的较为温和、方便的方式。利用大豆蛋白的热变性能使聚合物中分子链通过氢键、范德华力等交联构成复杂的网络结构,以形成更均匀、致密的凝胶网络,从而获得更稳定不易破碎的凝胶结构。有报道表明添加多糖类大分子与大豆蛋白结合也可以改善大豆蛋白水凝胶性质;刘冉等通过加入黄原胶(xanthan gum,XG)促进大豆蛋白凝胶化形成半互穿网络凝胶,提高了大豆蛋白凝胶的热稳定性。Dekkers等通过高温及高剪切力作用改善了果糖-大豆蛋白微观结构和拉伸强度。金针菇多糖(polysaccharides,FVP)作为食用菌中提取的天然多糖,不仅具有益智、免疫活性、抗肿瘤活性等高生物活性,且作为多羟基结构的非凝胶性阴离子多糖具有改善大豆蛋白水凝胶的潜力。
本研究将FVP与SPI混合并进行加热处理,通过分析水凝胶的结构变化以阐明水凝胶形成过程及凝胶强度变化的机理,旨在为大豆蛋白水凝胶高营养、宽领域的应用提供一定参考。
1 材料与方法
1.1 材料与试剂
金针菇粉 陕西金硕果业有限公司。SPI(蛋白质质量分数≥85%)、二喹啉甲酸(bicinchoninic acid,BCA)法蛋白浓度测定试剂盒、磷酸盐缓冲溶液(phosphate buffer saline,PBS)、三羟甲基氨基甲烷(Tris,纯度99%)、乙二胺四乙酸二钠(NaEDTA,纯度99%)、甘氨酸(Gly,纯度99%)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS,纯度95%) 北京索莱宝科技有限公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS,纯度98%) 上海源叶生物科技有限公司;2-硝基苯甲酸(DNTB,纯度95%)、-巯基乙醇(纯度98%) 上海麦克林生化科技有限公司;其余所用试剂均为化学分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
MCR302 流变仪奥地利 Anton Paar 公司;FreeZone真空冷冻干燥机 美国Labconco公司;HH-2数显恒温水浴锅 江苏常州国华电器有限公司;GL-21M高速冷冻离心机 湖南湘仪离心机仪器有限公司;J-1500圆二色光谱仪 日本分光株式会社;F-7000荧光分光光度计 日本日立高新株式会社;SpectraMax-190酶标仪 美国Molecular Devices公司;8000差示扫描量热仪(differential scanning calorimetry,DSC) 美国PerkinElmer公司。
1.3 方法
1.3.1 FVP的提取
参照Yang Wenjian等的方法并稍作修改。将金针菇粉和水以1∶25(g/mL)混合,置于80 ℃水浴浸提5 h,10 752×离心10 min,取上清液。加入Sevag试剂(正丁醇∶三氯甲烷=1∶4,/)静置10 min,17 808×离心15 min,取上清液。除蛋白操作重复3 次以上。向上清液中加入其4 倍体积的95%乙醇溶液沉淀过夜,滤出的絮状物用透析袋(截留分子质量3.5 kDa)透析至溶液均一状态,-20 ℃预冻后真空干燥得到FVP粗提物。使用Solarbio总糖检测试剂盒测得FVP粗提物中多糖含量为(66.52±1.59)%。
1.3.2 FVP-SPI水凝胶制备
前期预实验发现,添加5% FVP制备的FVP-SPI(以加入的干粉质量计)水凝胶稳定性最高(其余实验组FVP添加量为0%、2.5%、5%、7.5%)。因此,后续实验中FVP的添加量为5%,对照组XG的添加量也为5%。
将超纯水或5%的FVP或XG加入超纯水中以400 r/min磁力搅拌至完全溶解,加入SPI充分搅拌至顺滑无颗粒状,即为SPI、FVP-SPI和XG-SPI冷水凝胶。将冷水凝胶于90 ℃水浴加热30 min,得到热处理水凝胶(h-SPI、h-FVP-SPI、h-XG-SPI)。
1.3.3 动态流变学特性的测定
参照Sharma等的方法并稍作改动,使用MCR 302流变仪对各冷、热凝胶进行测定,用PP-50夹具以1 mm的间隙进行实验。使用刮板清除多余样品并使用硅油液封,防止水分挥发。冷水凝胶在1 Hz、1%应力条件下从25 ℃加热至90 ℃,90 ℃维持30 min,再从90 ℃降至25 ℃,最后在25 ℃、应力1%、0.1~10 Hz频率范围下扫描,以评估热处理过程中水凝胶结构变化过程。
1.3.4 持水性的测定
分别精确称取2 g各水凝胶()于离心管中,10 000×离心15 min,称取离心后各水凝胶失去的水的质量(),计算水凝胶持水率:

1.3.5 热稳定性的测定
将冷冻干燥的水凝胶粉碎,分别精确称量2.0 mg各冻干水凝胶粉末于PerkinElmer高压盘中,使用DSC仪测定。温度变化范围20~150 ℃;升温速率10 ℃/min;氮气流速20 mL/min。
1.3.6 蛋白质二级结构的测定
使用PBS溶液制备SPI质量浓度为0.2 mg/mL的各水凝胶溶液。使用J-1500圆二色光谱仪和石英比色皿。设置氮气流速为2 L/min,在190~240 nm波长处测定,使用Spectra manager分析图谱软件进行二级结构分析。
1.3.7 蛋白质三级结构的测定
使用PBS配制成SPI质量浓度为10 μg/mL的各水凝胶溶液,以PBS作为空白对照,利用荧光分光光度计测定发射波长300~500 nm下的荧光光谱。激发波长280 nm,扫描速率600 nm/min,狭缝宽度5 nm。
1.3.8 溶解度的测定
参照Wang Wenjie等的方法测定水凝胶在不同溶剂下的溶解度,使用的5 种溶剂为:A:蒸馏水;B:Tris甘氨酸缓冲液(pH 8.0,含0.086 mol/L Tris、0.09 mol/L Gly和4 mmol/L NaEDTA);C:B+2% SDS;D:C+8 mol/L尿素;E:D+1%-巯基乙醇。将1.3.2节中制备的水凝胶完全浸没于上述5 种溶剂并连续搅拌,以8 000×离心20 min,使用BCA试剂盒测量上清液中的蛋白质含量。计算水凝胶的溶解度:
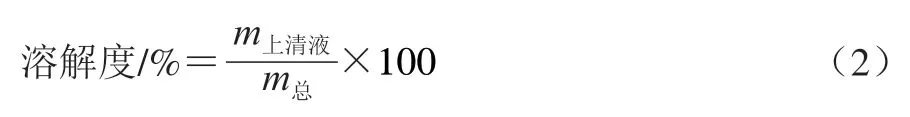
式中:为上清液中蛋白质质量;为加入水凝胶的总蛋白质质量。
水凝胶在溶剂间溶解度的差异表示分子间相互作用力的大小,其中溶剂B、A间代表静电相互作用,溶剂C、B间代表疏水相互作用,溶剂D、C间代表氢键相互作用,溶剂E、D间代表二硫键相互作用。
1.3.9 游离巯基含量的测定
参照Zhang Mingkai等的方法。分别称取40 mg各冻干水凝胶粉末溶解于pH 8.0的4 mL Tris-Gly缓冲溶液(含0.086 mol/L Tris、0.09 mol/L Gly和4 mmol/L NaEDTA)中,常温放置30 min后10 000×离心20 min。取上清液,加入30 μL Ellman试剂溶液(4 mg DTNB溶于1 mL Tris-Gly缓冲溶液),25 ℃反应15 min。使用酶标仪在412 nm波长处测定吸光度(),使用BCA试剂盒测定上清液中蛋白质质量浓度(/(mg/mL))。计算游离巯基含量:
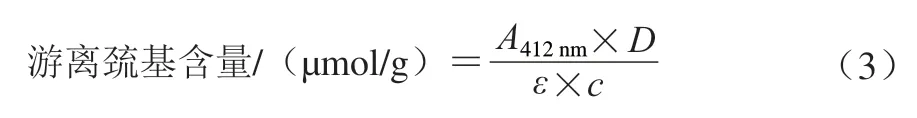
式中:=13 600 L/(mol·cm),为吸光系数;为稀释倍数。
1.3.10 表面疏水性的测定
参考Zhong Lei等的方法,用PBS制备不同SPI质量浓度(0、0.04、0.08、0.12、0.16 mg/mL)的水凝胶溶液。取4 mL水凝胶溶液与20 μL 8 mmol/L ANS混合后避光反应20 min测定荧光强度。激发波长365 nm,发射波长484 nm。计算荧光强度-蛋白质质量浓度的线性回归斜率,斜率为蛋白质表面疏水性。
1.4 数据处理
2 结果与分析
2.1 热处理对FVP-SPI水凝胶形成过程流变学特性的影响
通过测定热处理过程中水凝胶储能模量(′)及耗能模量(″)的变化模拟水浴加热至90 ℃时FVP-SPI水凝胶的形成过程。′越高代表水凝胶弹性越强,″越高代表水凝胶黏性越强。如图1所示,温度从25 ℃至90 ℃上升过程中,各水凝胶′和″均呈下降趋势,此过程是蛋白质受热变性过程。温度在稳定90 ℃的过程中,各水凝胶′和″呈先缓慢下降后迅速上升的趋势,此过程中SPI本身或与多糖相互交联形成新的网状结构,使其′和″得到明显提升,水凝胶结构更为稳定、致密。温度从90 ℃下降至25 ℃过程中,各水凝胶的′无明显变化,″有所下降,表明新的水凝胶结构已经形成,温度降低也无法使水凝胶恢复,所以这种变化并非是可逆的物理变化,而是发生了断键重组的化学变化。
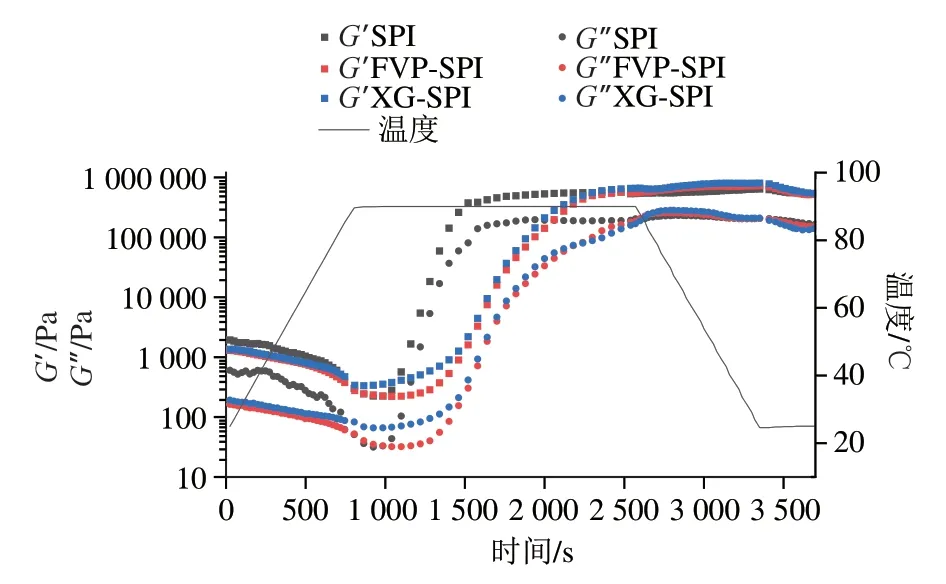
图1 热处理过程中水凝胶G′和G″的变化Fig.1 Changes in G′ and G″ of hydrogels during heat treatment
2.2 FVP对SPI水凝胶持水性的影响
如图2所示,各水凝胶的持水性有一定差异,其中SPI水凝胶的持水性最差。经过热处理或添加多糖,各水凝胶的持水性显著提升(持水率均超过95%),但这些水凝胶的持水性无显著差异(>0.05)。其中,与SPI水凝胶相比,h-FVP-SPI水凝胶的持水率增加了10.59%。水凝胶的持水性在一定程度上反应了水凝胶的抗干扰能力,在实际应用中,水凝胶在受压、切割等外界干扰下维持内部水的吸附和结合能力非常重要。通过高速离心可以反映出水凝胶在受压时的稳定性。这表明添加5% FVP和90 ℃下加热30 min的处理均能提高水凝胶对水的吸附和结合能力,提高水凝胶的稳定性和抗干扰能力。此外,FVP对SPI水凝胶持水性的提升能力与XG无显著差异。
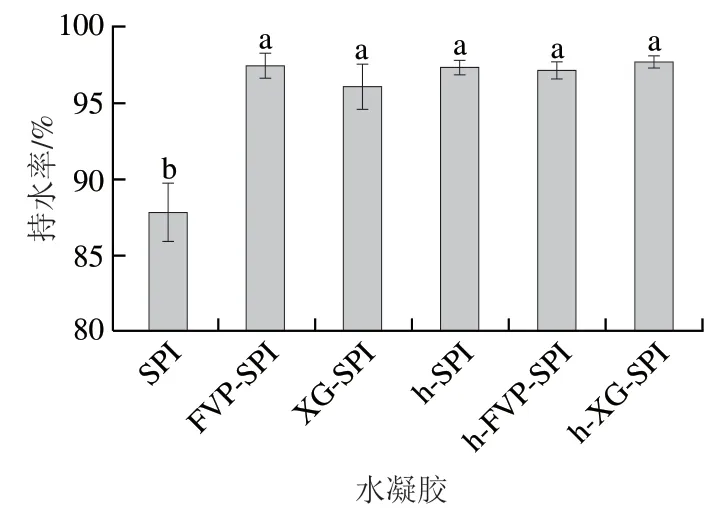
图2 不同水凝胶的持水率Fig.2 Water-holding capacity of different hydrogels
2.3 FVP对SPI水凝胶热稳定性的影响
如表1所示,各水凝胶的第一个峰出现在55~58 ℃范围内,这个小吸热峰显示蛋白纤维的“自增强”特性。对于SPI水凝胶而言,其DSC曲线中的吸热峰主要归因于-伴大豆球蛋白及11S球蛋白的溶解或分离。纯SPI水凝胶的和在热处理前后差异不显著,而添加多糖后,热处理前后的水凝胶的发生显著变化。热水凝胶样品的和较冷水凝胶升高。这些结果说明热处理后,多糖与蛋白发生交联;添加多糖后,多糖与蛋白质以非共价键结合构建了更复杂的网络结构,使得其需要更高的变性温度。Δ和Δ也有相似的变化规律,其中,h-FVP-SPI水凝胶较SPI水凝胶总焓变提高了25.46%。在热处理后,水凝胶的Δ和Δ更高;添加FVP的水凝胶比纯SPI水凝胶的Δ和Δ更高,这意味着添加FVP的水凝胶更为稳定。对比XG,FVP的添加提高了SPI水凝胶的热变性温度且焓变差异不显著。
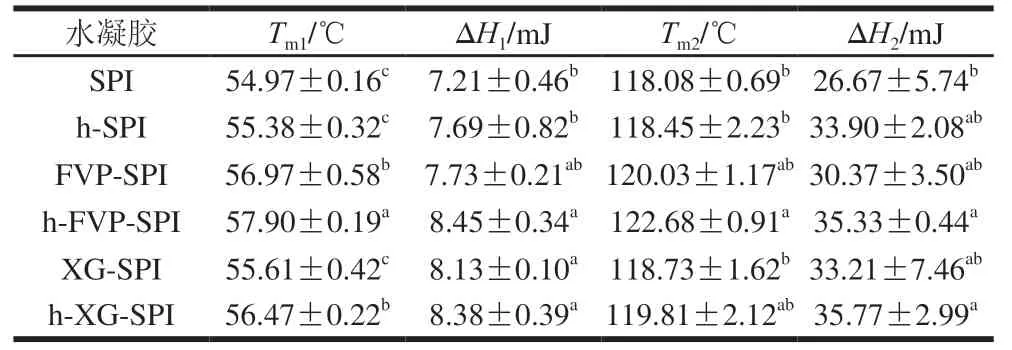
表1 不同水凝胶的热稳定性Table 1 Thermal stability of different hydrogels
2.4 FVP-SPI凝胶结构的表征分析
2.4.1 FVP对SPI水凝胶二级结构的影响
SPI水凝胶的二级结构通过蛋白质分子在部分区域上通过多肽链在一定方向上盘绕折叠维持,包括-螺旋、-折叠、-转角和无规卷曲,通过分子内蛋白质或蛋白质与连续相之间的氢键保持局部空间排列。如表2所示,与SPI水凝胶相比,FVP-SPI水凝胶的-螺旋含量无显著差异,-折叠含量增加了12.9%;h-FVP-SPI水凝胶的-螺旋含量减少了16.8%,-折叠含量增加了17.2%。在蛋白质或多肽的规则二级结构中,肽链是高度有序的,排列的方向性决定了肽键能级转换的分裂。其中破坏-折叠所需能量大于-螺旋,所以h-FVP-SPI水凝胶稳定性高于SPI,FVP能提高SPI水凝胶的稳定性。维持蛋白质二级结构的主要作用力是分子内氢键和二硫键。-折叠是羰基氧(—C=O)与相同或相邻的肽链酰胺氢(—CONH—)之间通过肽键形成的规则氢键。加入FVP后和热处理后,各水凝胶的二级结构均有所变化,这说明FVP的加入和热处理能改变SPI水凝胶的氢键和二硫键结构。FVP可以通过与SPI分子的静电和共价键的方式改善水凝胶的结构,提高SPI水凝胶的机械能。
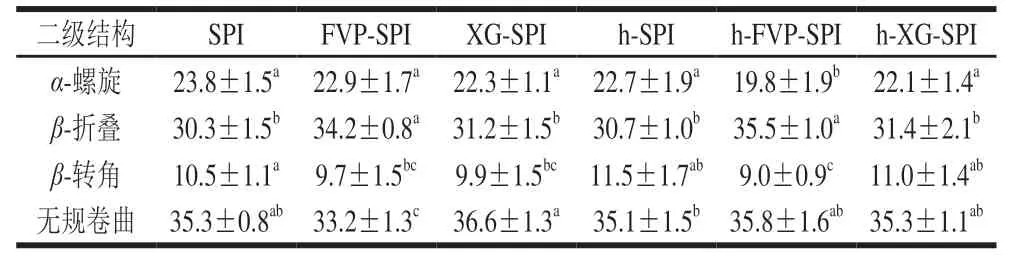
表2 不同水凝胶中SPI二级结构的变化Table 2 Secondary structure contents of soy protein in different hydrogels
2.4.2 FVP对SPI水凝胶三级结构的影响
由图3可知,与SPI水凝胶相比,h-SPI水凝胶的最大荧光强度增加,并伴有最大荧光强度对应波长()的轻微蓝移;FVP加入后,h-SPI水凝胶的最大荧光强度进一步提高(h-FVP-SPI)。这表明FVP和SPI水凝胶在加热条件下的静电或共价结合改变了SPI的折叠状态。蛋白质中芳香族氨基酸残基可以被280 nm的紫外线激发出荧光。色氨酸、酪氨酸和苯丙氨酸带有不同的侧链基团,具有不同的荧光光谱,其中色氨酸荧光强度最强。色氨酸的荧光发射很容易受到某些因素影响而改变,包括相邻位置的氨基酸残基、用于溶解蛋白质的溶剂以及色氨酸残基在整个蛋白质高级结构中的位置。蛋白质中经常发生从酪氨酸到色氨酸残基的能量转移,导致酪氨酸残基的荧光淬灭和色氨酸残基的荧光增加。热处理及FVP对SPI水凝胶荧光强度的增加表明,热处理和FVP改变了SPI的三级结构;其中,色氨酸作为一种疏水性氨基酸,在疏水性增强的过程中逐渐被安排在蛋白质分子的外侧,使SPI内部的色氨酸残留物逐渐暴露在SPI分子的表面上。
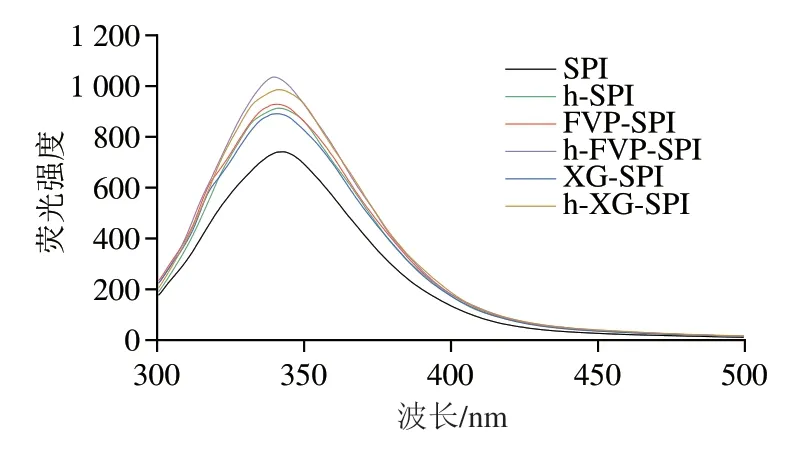
图3 不同水凝胶荧光强度的变化Fig.3 Fluorescence intensity of different hydrogels
2.4.3 FVP对SPI水凝胶分子间作用力的影响
如图4所示,疏水相互作用、二硫键和静电相互作用是形成h-FVP-SPI复合水凝胶的主导力,这个结果与Wang Wenjie等的报道相似。在热处理或添加FVP后,SPI水凝胶的静电相互作用、氢键都得到了明显的加强;热处理也能使SPI水凝胶的二硫键作用得到显著增强。FVP是一种带负电荷的多糖,而SPI带正电荷,FVP与SPI的加热混合促进了静电相互作用的发生。因此,静电作用在h-FVP-SPI水凝胶网络的形成中发挥了主要作用,这种静电相互作用的增强可以被用于解释持水性的增强。此外,由于FVP的加入引入了大量的—OH,使得氢键的作用增强,这导致亲水作用的减弱和疏水能力的增强,疏水相互作用结果与荧光光谱的结果一致。二硫键的形成可能会影响蛋白质结构的稳定性和疏水性,所以后续进行了水凝胶表面疏水性的测定。
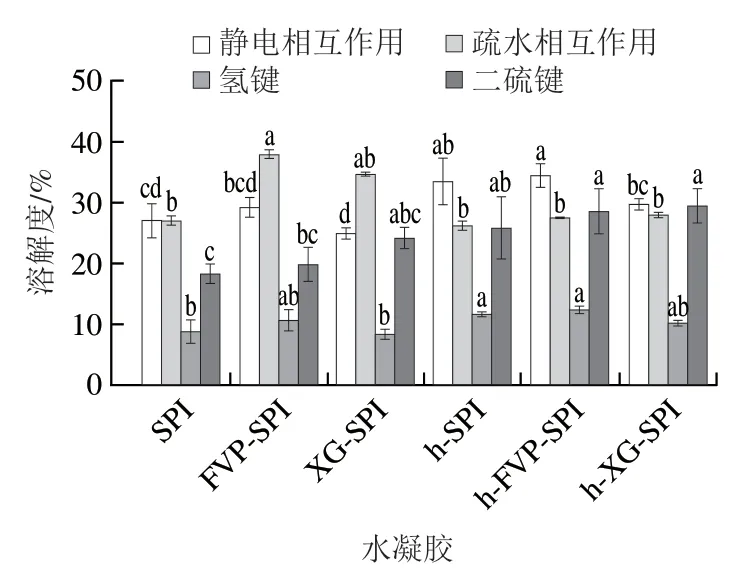
图4 不同水凝胶在不同溶剂下的溶解度Fig.4 Solubility of different hydrogels in different solvents
2.4.4 FVP对SPI水凝胶巯基含量的影响
如图5所示,各水凝胶的总巯基含量无显著差异(<0.05),说明不同处理下的水凝胶总巯基含量无变化。热处理后水凝胶的游离巯基含量显著高于未加热水凝胶。游离巯基含量是衡量蛋白质聚集的指标。由于蛋白质结构中共价键中裂解能量最低的属于二硫键和C—S键,加热至90 ℃的过程能够使-伴大豆球蛋白和大豆球蛋白变性,11S大豆球蛋白中至少有20 个二硫基,在蛋白质变性时易发生变化,并且大豆球蛋白酸性和碱性多肽之间的S—S被破坏,引发巯基-二巯基交换反应。此外,h-FVP-SPI水凝胶与h-XG-SPI水凝胶中游离巯基含量显著高于h-SPI,这表明在FVP和XG加入后,二硫键介导的交联更少,或者两种多糖的加入抑制了巯基的氧化。由于多糖中硫酸酯、硫醇基团的引入,在加热过程中二硫键和硫醇-二硫化物的互换增加了蛋白质中多肽链的表观链长,从而影响蛋白质凝胶化过程。热处理后水凝胶游离巯基含量增加的结果与分子间作用力中巯基作用的结果相互验证。
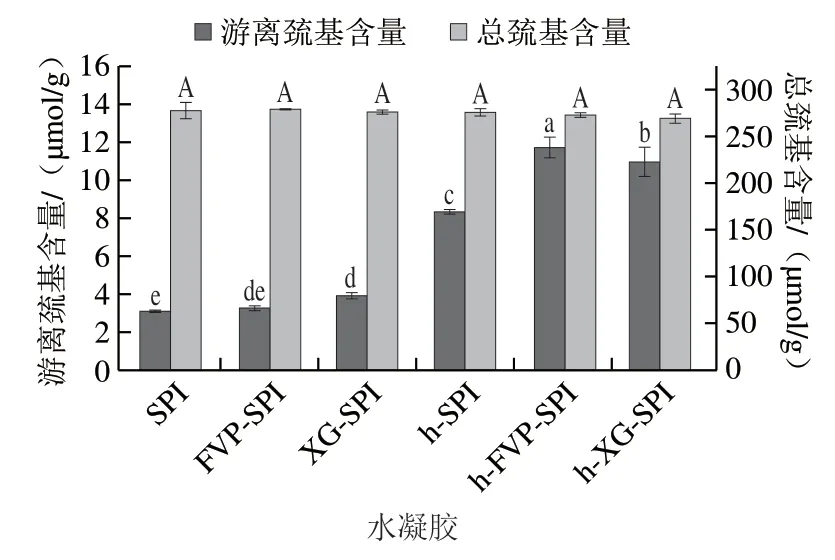
图5 不同水凝胶的游离巯基与总巯基含量Fig.5 Contents of free sulfhydryl group and total sulfhydryl group in different hydrogels
2.4.5 FVP对SPI水凝胶表面疏水性的影响
如图6所示,加入FVP和热处理均能显著提高SPI水凝胶的表面疏水性。热处理后水凝胶的表面疏水性显著高于未热处理的水凝胶(<0.05),这是由于大多数非极性氨基酸可以形成疏水性核心并掩藏在蛋白质内部,而热处理促使蛋白质的疏水性氨基酸暴露,此结果与溶解度测定结果一致。蛋白质的表面疏水性取决于其分子质量、形状、分子内和分子间交联以及氨基酸的组成和排列。ANS和蛋白表面疏水区域结合后产生的荧光变化能反映暴露在蛋白质分子表面疏水基团的数量,这很大程度决定了蛋白质溶解性。表面疏水性的增加表明热处理及添加FVP降低了SPI水凝胶的溶解性,这与蛋白质三级结构的结果中疏水性氨基酸向蛋白质表面排列的结果相互验证,与疏水相互作用结果一致。
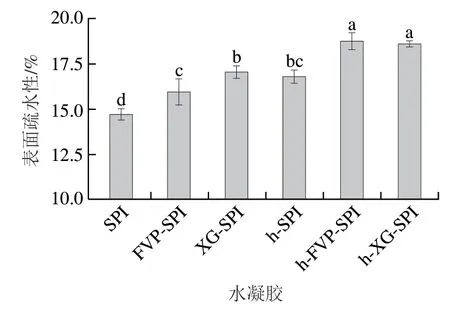
图6 不同配方水凝胶的表面疏水性Fig.6 Surface hydrophobicity of different hydrogels
3 结论
添加5% FVP并通过90 ℃水浴加热30min制备FVPSPI水凝胶。在加热过程中,SPI发生热变性,发生不可逆的化学交联形成更为致密的网络结构。疏水相互作用、二硫键和静电相互作用是形成h-FVP-SPI复合水凝胶的主导力。从二级结构上,FVP大量—OH的引入导致氢键的增加使-螺旋向-折叠转变,二硫键的增加同时影响二级结构并伴随着三级结构的变化,使h-FVP-SPI水凝胶表面疏水性增大,凝胶强度和热稳定性得到显著提高。FVP对SPI水凝胶的稳定性和持水性的增强作用与XG无差异显著性,热稳定性显著提高。本实验为高活性菌物多糖在SPI水凝胶的应用提供了一定理论依据。
