结肠镜取组织中PRL-3、XRCC2 检测在结直肠癌中的临床意义
2022-10-30陆林李亚男储凯
陆林 李亚男 储凯
(南京市江宁区中医院病理科,江苏 南京 211100)
结直肠癌作为临床常见消化系统的恶性肿瘤,因社会经济的快速发展,人们的饮食生活发生较大变化从而导致结直肠癌发病人数日渐增加[1]。结直肠癌早期无明显症状,随着肿瘤的增大会出现排便失调、腹泻、血便、便秘等,还会伴随不同程度的腹部疼痛,到了癌症晚期还会出现身体消瘦、营养不良、贫血等,发病最多的部位为乙状结肠及直肠,但盲肠、横结肠、升降肠等发病率也较高[1]。在胃肠道中的癌细胞通过血液循环等途径扩散到其他脏器组织,癌细胞扩散范围越大结直肠癌病症越严重,因此,该病需早期诊断排查,预防癌细胞组织扩散。
目前临床多用结肠镜来进行结直肠癌检测,通过纤维窥镜进入患者胃肠道取样进行活体细胞学检查及病理学检测,而据王琦[2]等学者发布的结直肠癌PRL-3 蛋白表达与临床关系的Meta 分析和秦长江[3]等学者发布的 XRCC2 在结直肠癌中的表达及其临床意义中表示组织中PRL-3 和XRCC2 均影响着结直肠癌的诊断。
因此,本文旨在探讨PRL-3、XRCC2 检测在结直肠癌中的诊断意义,为寻找结直肠癌的诊断指标,提高诊断效率提供一定基础。
1 资料与方法
1.1 一般资料
选择本院自2019 年3 月-2022 年3 月期间接收的78 例结直肠癌患者作为研究对象。其中男性51 例,女性27 例,年龄31-76 岁,平均年龄(45.38±6.49)岁,有结直肠癌癌家族史29 例,无结直肠癌家族史49例;肿瘤直径:<2.3 cm 35例,≥2.3 cm 43 例;组织分化程度:低分化38例,高分化40 例;TNM 分期:I-II 期52 例,III-Ⅳ期26 例;有淋巴结转移31 例,无淋巴结转移47 例;肿瘤部位:盲肠13 例、乙状结肠21 例、横结肠19 例、直肠9 例、升结肠3 例、降结肠13 例。
患者资料无显著差异,具有可比性(P>0.05)。
纳入标准:(1)经手术病理检查为结直肠癌;(2)可进行结肠镜检查患者;(3)为原发性直肠癌患者;(4)患者及家属已签署《知情同意书》;排除标准:(1)合并患有其他恶性肿瘤疾病患者;(2)临床资料不全患者;(3)存在严重认知障碍及精神疾病患者;(4)预计生存时间小于4 m 患者。
1.2 方法
1.2.1 XRCC2 表达水平检测
采用免疫组化检测XRCC2 表达水平。结肠镜取结直肠癌患者癌组织及癌旁组织后用浓度为4%的多聚甲醛(Paraformaldehyde,POM)溶液将组织样本进行固定,石蜡包埋,再将整个蜡块均匀切成多个4.5 μm 的薄片,将薄片用二甲苯进行脱蜡、用梯度乙醇进行脱水处理,随后将0.01 mol•L-1的柠檬酸钠加入到沸水中制作缓冲液进行高于热修复,将缓冲液pH 值稳定在6.0,再转至小火进行抗原修复,让缓冲液持续沸腾10 min后,加入浓度为 3% 的过氧化氢(Hydrogen peroxide,H2O2)10 min,将内源性灭活过氧化氢酶进行灭活,滴加浓度为10%的山羊血清,整体封闭性孵育30 mim,加入XRCC2 抗体后将其放置在4℃的环境下,次日再拿出在37℃下复热1 h 后,在加入生物素化二抗持续孵育1 h,DAB显色后用苏木素进行复染、分化。最后将脱水、封片放置显微镜下观察。
1.2.2 PRL-3 表达水平检测
采用免疫组化检测PRL-3表达水平。样本采集,包埋等方法同上。加入PRL-3 抗体(1:200)在37℃环境下继续孵育2 h,再磷酸缓冲液漂洗,滴加生物素化二抗继续在37℃环境孵育30 min,继续用磷酸缓冲液漂洗,在滴加辣根酶标记链霉卵白素工作液,30 min 后再次进行磷酸缓冲液漂洗,DAB 显色复染后脱水呈透明薄片,再用树胶进行最后封片,将薄片放置显微镜下观察。
1.2.3 直肠癌患者的病理分期
结直肠癌TNM 分期系统[4]由美国癌症联合委员会(American Joint Committee on Cancer,AJCC)和国际抗癌联盟(Union for International Cancer Control,UICC)联合发布,其分期标准为:据肿瘤浸润深度代表T,分为Tis、T1、T2、T3、T4,N 代表区域淋巴结,M代表肿瘤的远处转移,TNM 分期共有5 期,分别为0 期、I 期、II 期、III 期及Ⅳ期。
1.3 观察指标
(1)分析对比不同组织中PRL-3、XRCC2的表达水平;(2)分析对比结直肠癌患者不同分期的癌组织PRL-3、XRCC2 表达水平;(3)比较PRL-3、XRCC2 表达与结直肠癌病理特征的关系。
1.4 统计学方法
本研究数据均采用SPSS18.0 软件进行统计分析,计量资料采用平均数±标准差()描述,两两间使用t检验;计数数据采用百分比(%)表示,并采用卡方χ2检验;均以P<0.05为差异具有统计学意义。
2 结果
2.1 比较不同组织PRL-3、XRCC2 的表达水平
结直肠癌组织PRL-3 阳性率(69.23%)高于癌旁组织阳性率、XRCC2 阳性率(61.54)也高于癌旁组织阳性率(P<0.05)。见表1。
2.2 比较不同分期的结直肠癌组织 PRL-3、XRCC2 表达水平
检测出结肠癌组织0-II 期PRL-3 阳性患者有32 例,XRCC2 阳性患者有42 例;而III-Ⅳ期PRL-3 阳性患者有22 例,XRCC2 阳性患者有6例;结直肠癌组织检测出 III-Ⅳ期 PRL-3、XRCC2 阳性率均高于0-II 期(P<0.05)。见表2。
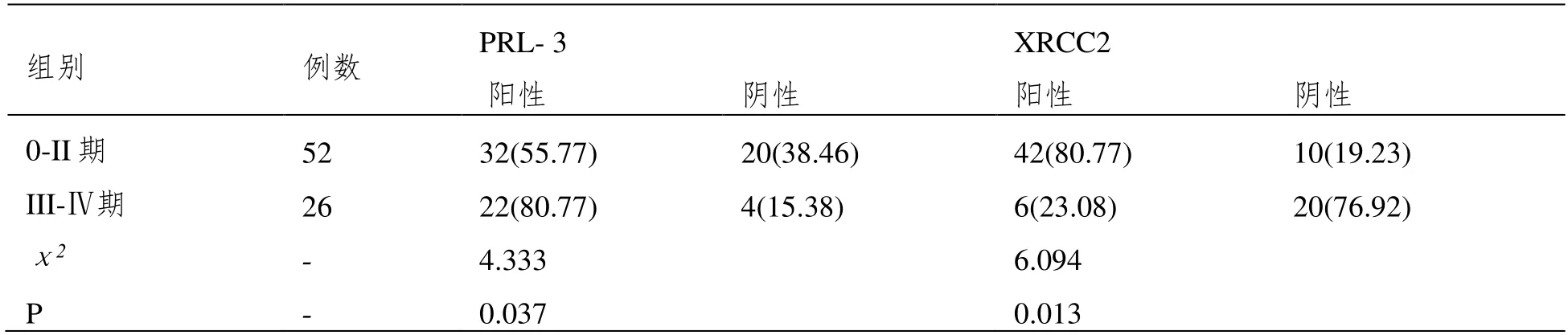
表2 不同分期的结直肠癌组织PRL-3、XRCC2 表达水平情况[n(%)]
2.3 比较PRL-3、XRCC2 表达与结直肠癌病理特征的关系
PRL-3、XRCC2 表达与年龄无显著关系(P>0.05);PRL-3、XRCC2 表达与肿瘤大小、淋巴结转移及肝脏转移有关(P<0.05)。见表3。
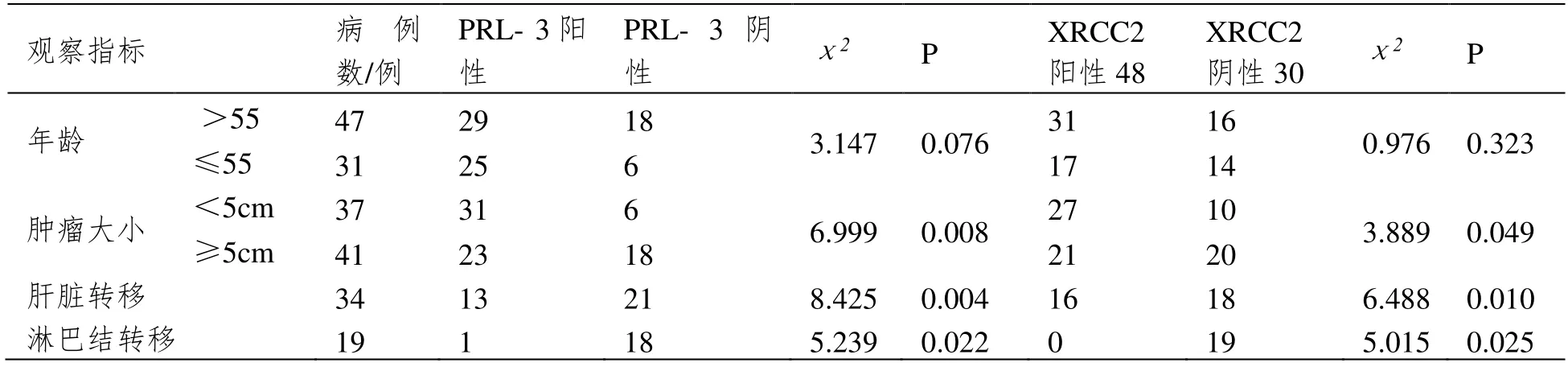
表3 PRL-3、XRCC2 表达与结直肠癌病理特征的关系情况[n(%)]
3 讨论
据统计,目前结直肠癌发病年龄多集中在45岁以上的中老年人群,其中男性患者占比多于女性患者[1]。而结直肠癌早期无明显症状,随着肿瘤的增大会出现排便失调、腹泻、血便、便秘等,还会伴随不同程度的腹部疼痛,到了癌症晚期还会出现身体消瘦、营养不良、贫血等[2]。因此,该病需早期诊断排查,预防癌细胞组织扩散[1]。结直肠癌患者多伴有肝转移或淋巴转移,据调查数据显示,有24%的结直肠癌患者在早期及已经出现肝转移,45%的结直肠癌患者在发病2-3 年内就会出现肝转移,因此,结直肠癌的死亡率日渐增加,已成为世界前三的恶性肿瘤[1-3]。
PRL-3 是一种分子量22kD 的蛋白酪氨酸磷酸酶(Protein Tyrosine Phosphatase,PTP),通过细胞的生长分化、信息传递及物质运输等。同时,也有研究表示PRL-3 多作用于肿瘤转移[6]。本文研究结果显示,PRL-3 表达与肿瘤大小、淋巴结转移及肝脏转移有关;PRL-3 阳性率高于癌旁组织;PRL-3III-Ⅳ期阳性率高于0-II 期。与李海林[7]等学者在MIF 和PRL-3 在结直肠癌及肝转移中的表达及临床意义的研究结果一致。PRL-3 具有促进细胞迁移增殖等作用,且相比未转移的结直肠癌,有肝脏转移或淋巴转移的结直肠癌表达度更高[7]。原因可能为癌细胞影响了PRL-3 的表达水平,从而使得细胞的迁移增殖等作用加强,加快癌细胞的扩散。
XRCC2 是一种参与同源基因修复的蛋白质,可以维持生物基因的活性和完善整体基因[8]。本研究结果表明XRCC2 表达与肿瘤大小、淋巴结转移及肝脏转移有关;XRCC2 阳性率高于癌旁组织;XRCC2 III-Ⅳ期阳性率高于0-II 期。推测原因为XRCC2 参与修复基因,阻碍了癌细胞病灶的扩增,增加了细胞稳定性及完整性。XRCC2 表达水平降低导致受损基因无法修复,促进了癌细胞病灶的发生。但据陈建亮[9]等学者也在X 线修复交叉互补基因与肝癌进展及预后的关系中提出XRCC2 过多表达引起了细胞增殖饱和从而加速了癌细胞病灶的形成。说明XRCC2在癌细胞中的表达机制十分复杂,而癌细胞病灶的形成与细胞增殖异常也有密切关联[8,9],但其关联机制仍需进一步临床研究。
总而言之,应用结肠镜检测组织中的PRL-3、XRCC2 表达水平,可以为结直肠癌患者的临床评估提供参考,有利于检测癌细胞的转移、生长,同时检测病情的发生发展。
