磁性Fe3O4@SiO2@介孔SiO2空心微球的制备及漆酶固定化
2022-10-30李群艳孙路瑶常其飞周运炉
李群艳,孙路瑶,常其飞,周运炉
(北京工业大学材料与制造学部,北京 100124)
生物催化技术的衍生和发展给21世纪的世界经济带来了重大发展,其中生物酶是一种对环境友好、高效无毒的催化剂,但是游离态的生物酶稳定性差、易失活、难以回收、重复利用率低。与游离酶相比,酶固定化技术的出现针对这些问题起到了很重要的作用,因而固定化酶技术具有很大的发展潜力。磁性介孔SiO具备介孔构造的同时兼具优异的磁分离回收性能,成为生物酶固定化方向的研究热点。Xue等通过溶剂热法和水热结晶法相结合制备出磁性介孔SiO,这种磁性介孔SiO介孔孔径为2.98nm,比表面积为404~442m/g,具有高饱和磁化强度,为17.7~33.5emu/g。采用这种微球对脂肪酶进行固定化后,结果表明,游离酶的催化活性远不如固定化酶分子,且十分容易通过磁体与反应系统分离,重复使用5 次,还能保存高达90%的初始活性。Fu 等通过一步反应制备出磁性介孔SiO微球,这种微球尺寸在200nm左右,包覆的壳层约50nm厚,介孔尺寸为4.2nm,比表面积为548m/g,孔容为0.3cm/g。样品的饱和磁化强度为42emu/g,在外加磁场下能够完成样品的迅速分离。以往的研究表明,SiO材料的内部孔道结构是影响酶固定化性能的主要因素。在近些年的研究报道中,磁性介孔SiO材料的相关合成大多是在碱性环境中进行的,而酸性条件方面还缺乏细致的研究报道。酸性环境可以使硅烷水解反应加快,同时妨碍硅氧烷键之间的缩合,只能在聚合物的末端进行反应,可以得到不同微观结构的介孔SiO材料。本文作者课题组提出以FeO空心微球为基础,以SiO致密层包覆保护磁性层,然后在酸性环境中再进行介孔SiO层的包覆得到磁性介孔空心复合微球,以十六烷基三甲基溴化铵(CTAB)为结构导向剂,调控其用量并研究其对空心微球微观结构的影响,最后研究考察了微球对漆酶的固定化性能以及对比了固定化酶与游离酶在不同pH和温度下的活性。
1 材料和方法
1.1 材料与仪器
1.1.1 实验材料
四水合氯化亚铁和正硅酸乙酯(TEOS)均为分析纯,天津市福晨化学试剂厂;氢氟酸、浓氨水和氢氧化钠均为分析纯,北京化工厂;CTAB,分析纯,广东汕头市陇化工厂;聚环氧乙烷-聚环氧丙烷-聚环氧乙烷三嵌段共聚物(P123)、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)和漆酶均为分析纯,Sigma Aldrich;磷酸盐缓冲溶液(PBS),自配;37%浓盐酸,分析纯,北京通广精细化工公司。
1.1.2 分析测试仪器
样品的晶型结构通过日本岛津XRD-7000 型X射线衍射仪(XRD)分析测定;样品的微观形貌及壳层厚度通过JEM-2010 型透射电子显微镜(TEM,工作电压为200kV)观测分析;样品的比表面积、孔容、孔径及孔径分布以及吸附-脱附等温线是经过Micromeritics ASAP 2020 比表面全自动物理吸附仪测定;固定化酶和游离酶的固定量及其活性采用Thermo Evolution 600 紫外分光光度计监测得到。在室温下通过Lake Shore VSM-7307 型振动样品磁强计对空心微球进行磁性能测试。
1.2 实验方法
首先进行中空β-FeOOH 微球的制备,再以致密的SiO层包覆保护β-FeOOH 磁性层,然后在酸性环境中再进行介孔SiO层的包覆,得到β-FeOOH@SiO@介孔SiO空心复合微球,最后在还原气氛下进行煅烧得到磁性FeO@SiO@介孔SiO空心复合微球,并研究微球的微观结构。
1.2.1 中空β-FeOOH微球的制备
首先,将浓度为0.1mol/L 氯化亚铁溶液和一定量的质量分数40%的氢氟酸混合,使得(F)∶(Fe)=1∶3。通过质量分数为25%的氨水来调节上述混合溶液的pH至4.5。将自制的SiO微球乳液超声1~2min 以分散,后将SiO微球乳液与上述溶液在60℃水浴环境下搅拌2h,所得样品为SiO@β-FeOOH 实心微球。使用5%的NaOH 溶液将所制备的SiO@β-FeOOH实心微球去除核心,在40℃下水浴搅拌2h,而后离心、水洗两次得到中空β-FeOOH微球样品。对自制的SiO微球以及SiO@β-FeOOH实心微球进行TEM表征,观察其微观形貌。
1.2.2 β-FeOOH@致密SiO空心复合微球的制备
将制备完成的β-FeOOH 中空微球与0.05mol/L氨水溶液在35℃下搅拌混合均匀,逐滴加入1.26g正硅酸乙酯(TEOS),水浴搅拌2h 后得到β-FeOOH@致密SiO空心复合微球样品,并对其进行TEM 表征,观察其微观形貌。另外对其进行了酸性条件下的溶解性实验,将所制备的微球在2mol/L盐酸溶液中浸泡24h,并对其进行TEM表征,观察β-FeOOH 中空微球表面致密的SiO层厚度和β-FeOOH纳米棒腐蚀情况。
1.2.3 β-FeOOH@SiO@介孔SiO空心复合微球的制备
将0.40g 聚环氧乙烷-聚环氧丙烷-聚环氧乙烷三嵌段共聚物(P123)、十六烷基三甲基溴化铵(CTAB)和0.50g KCl置于30mL盐酸溶液中,搅拌使得P123 充分溶解。CTAB 加入量分别为0、0.009mol/L、0.014mol/L,所对应的样品名为K0、K1、K2。将P123 溶液、15mL 盐酸、β-FeOOH@致密SiO空心微球混合搅拌10min,缓慢滴加1.26g TEOS,40℃下水浴24h。然后离心,醇洗、水洗各三次,在50℃烘箱中干燥后得到β-FeOOH@SiO@介孔SiO空心复合微球样品,并对其进行TEM表征,观察其微观形貌。
1.2.4 FeO@SiO@介孔SiO空心复合微球的制备
干燥完成后,通过马弗炉煅烧去除空心微球的模板剂,在500℃下保温5h,升温速率为1℃/min。最后,将样品在还原氛围(95%Ar,5%H)中煅烧,温度为350℃,保温3h,升温速率为1℃/min,得到FeO@SiO@介孔SiO空心复合微球样品,并对所制备微球进行了TEM、XRD 表征,分析其微观形貌及晶体结构,同时对其进行了磁性能测试以及孔结构的表征。
1.3 漆酶固定化实验
将0.01g的空心FeO@SiO@介孔SiO复合微球样品加入到配制好的浓度为1mg/mL的漆酶溶液中,磁力搅拌2h后离心分离样品,分别取三次上清液,测得固定化前后漆酶溶液在波长为276nm处的吸光度,再通过标准曲线计算得到漆酶溶液浓度。通过固定化前后漆酶溶液浓度的差值,利用式(1)计算得到在一定的时间内空心复合微球载体对漆酶的固定量,并计算三次结果的平均值。最后在50℃下干燥,所得样品为固定化漆酶。2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)是一种常用来测定漆酶活性的介体,可以被漆酶氧化,且氧化后其特征吸收峰位于420nm。因此,漆酶的活性可以利用紫外-可见光分光光度计在波长为420nm 处测定氧化型ABTS的吸光度。监测固定化酶、游离酶的酶活性:将二者分别加入到8mL 不同pH 的磷酸盐缓冲溶液(PBS)中,然后再分别加入1mL浓度为2mmol/L 的ABTS 溶液、1mL 浓度为0.01mol/L的HO溶液,室温下进行10min振荡反应,在冰水浴中终止反应,然后监测ABTS 在420nm 处反应前后吸光度的变化,最后得到FeO@SiO@介孔SiO空心复合微球固定化酶和游离酶的活性并进行对比。
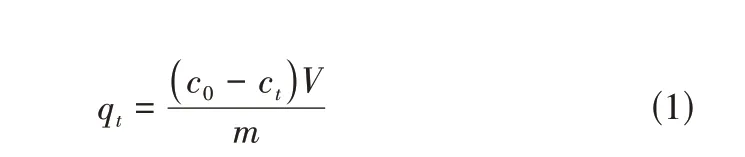
式中,q为漆酶在时刻的吸附量,mg/g;为漆酶的初始浓度,mg/mL;c为时刻漆酶的剩余酶浓度,mg/mL;为溶液的总体积,L;为载体材料的质量,g。
2 结果与讨论
2.1 空心复合微球的微观结构
图1 是几种微球的微观结构TEM 照片。图1(a)是自制的单分散SiO微球,能够看到微球的尺寸均匀,分散平均,其平均尺寸约为315nm。图1(b)是β-FeOOH 包覆在单分散的SiO微球后得到的SiO@β-FeOOH 实心微球,β-FeOOH 纳米棒在单分散的SiO微球表面互相搭接成三维网络结构,并且包覆均匀,单个β-FeOOH 纳米棒平均长度约为37nm,平均直径约为9nm,β-FeOOH 壳层平均厚度约为48nm。图1(c)是β-FeOOH@SiO中空微球的TEM 照片,能够看到其表面包覆了一层均匀致密的SiO,致密层平均厚度约为6nm,具有完整的球形结构。图1(d)是样品在2mol/L 盐酸条件下浸泡24h后的β-FeOOH@SiO空心微球的TEM照片,可以看到致密SiO层厚度也无明显变化,纳米棒未被腐蚀,样品的球形度依然良好,说明SiO致密层表现出隔离保护的作用,使纳米棒与盐酸不接触,阻止纳米棒被腐蚀。图1(e)为β-FeOOH@SiO@介孔SiO空心微球的TEM 照片,球仍具有较好的球形度,介孔层平均厚度约为11nm。再次煅烧,得到FeO@SiO@介孔SiO空心微球[图1(f)]。

图1 空心复合微球的微观结构
图2 为还原气氛焙烧后的β-FeOOH@SiO@介孔SiO空心复合微球的XRD 图。已制备出的介孔SiO@SiO@FeO空心微球继续在还原气氛中于350℃下焙烧3h,微球中的α-FeO被还原成FeO,然后得到磁性FeO@SiO@介孔SiO空心复合微球。还原后样品所测的XRD 数据见图2,对比FeO晶型(PDF#19-0629),可以看出图中FeO的(220)、(311)等衍射峰与FeO晶型PDF 各衍射峰位基本一致,并且在20°~30°出现了无定形的SiO衍射峰,并没有出现其他的衍射峰,表明具有纯的FeO晶相,并不含有其他的任何杂相,说明空心复合微球的FeO磁性层被很好地制备。

图2 还原气氛焙烧后的β-FeOOH@SiO2@介孔SiO2空心复合微球的XRD图
图3 为FeO@SiO@介孔SiO空心复合微球样品在室温下的磁滞回线和磁分离效果图。微球的饱和磁化强度为11.3emu/g,矫顽力为111.5Oe,从局部放大图可以看出中心区域的样品没有完全重合,这表明具有一定的矫顽力。分散后的样品可以利用磁铁在容器一侧迅速富集,移除磁铁后也可以迅速再分散,表明样品的再分散性良好,可以重复利用。

图3 Fe3O4@SiO2@介孔SiO2空心复合微球的磁滞回线和磁分离效果图
图4 为在不同CTAB 添加量的条件下所制备的FeO@SiO@介孔SiO空心复合微球的N吸附-脱附等温线以及孔径分布图。从图4 观察得出,4 条等温线都是标准的第Ⅳ类等温线,说明辅助模板剂CTAB 的加入并不会改变复合微球的介孔结构。相对压力/极低时,N吸附量急剧增加,是微孔填充的现象,微孔的存在导致吸附作用力加强。在/=0~0.2时,经过前期的急剧上升阶段后,此时氮气分子逐渐吸附到样品介孔内表面,N吸附量上升缓慢。在/=0.4~0.7 时,出现一个H1 型滞后环,H1 型滞后环的产生表明新型介孔材料的孔径分布较窄,孔径尺寸相对较小。此外滞后环坡度越大,样品的孔径分布越窄,孔径尺寸大小越均一。所制备的FeO@SiO@介孔SiO空心复合微球的比表面积、孔容都随着所加入CTAB的增加而增加,具体数据如表1所示。原因在于两模板剂复合后体积变大,使得FeO@SiO@介孔SiO空心复合微球的比表面积以及孔容增加。微球的孔径分布图显示其样品的孔径分布在3.21nm 左右且分布范围较窄,微球样品的介孔孔径随着辅助模板剂CTAB 量的增加,最可几孔径分布在逐步减小,孔径范围由4.30nm减小到3.19nm。原因是辅助模板剂CTAB的分子尺寸要小于P123的分子尺寸,所以CTAB量的增多会导致空心微球最可几孔径减小。
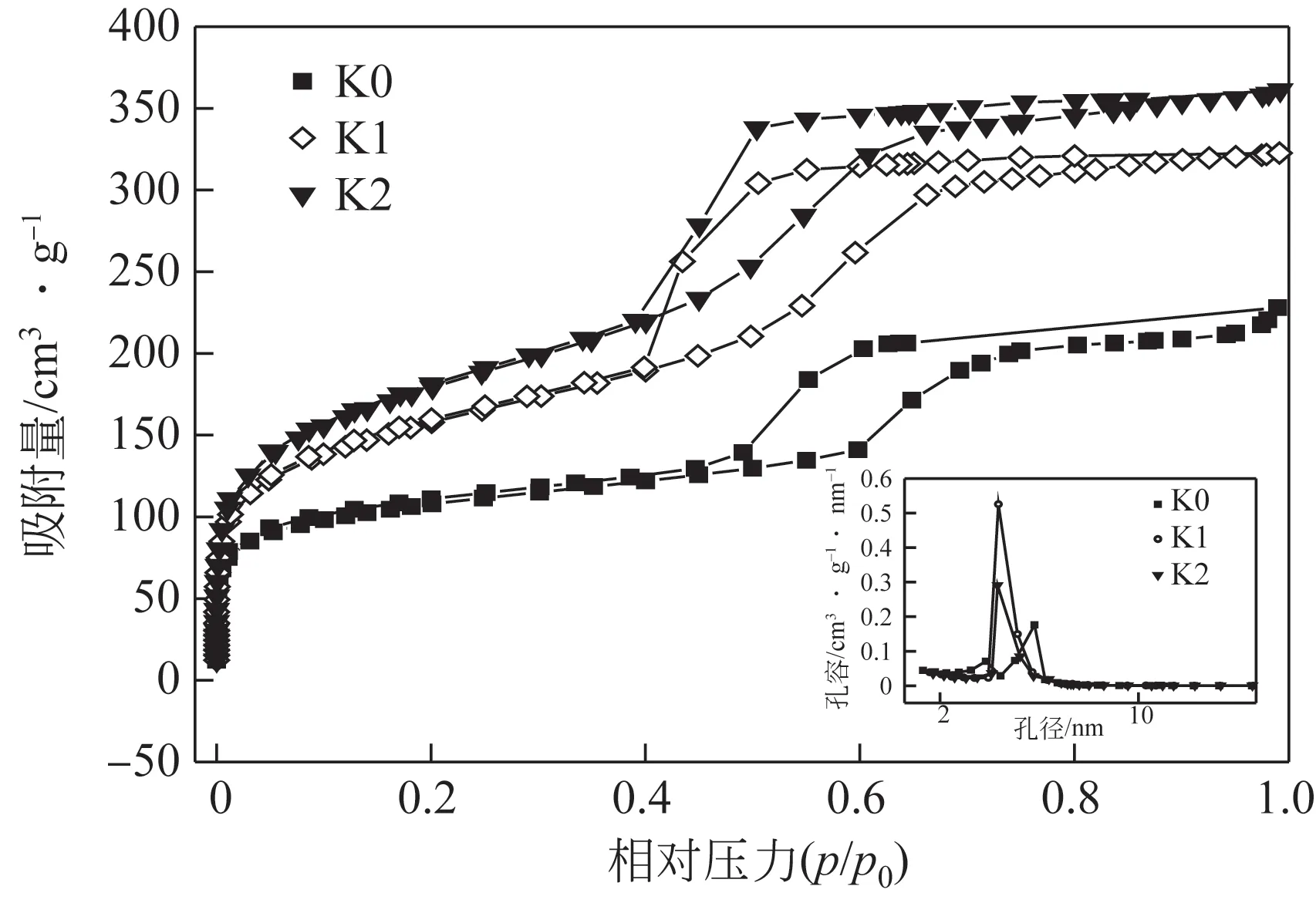
图4 在不同CTAB量条件下制备的Fe3O4@SiO2@介孔SiO2空心复合微球的N2吸附-脱附等温曲线及孔径分布图
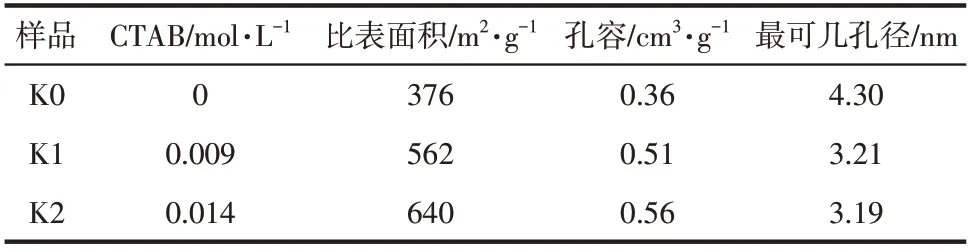
表1 在不同CTAB量条件下Fe3O4@SiO2@介孔SiO2空心微球的孔结构参数
2.2 空心复合微球的酶固定化性能
使用所制备的FeO@SiO@介孔SiO空心复合微球样品K0、K1、K2分别对漆酶进行固定化,然后测得样品在不同时间条件下对漆酶的固定量如图5所示。由图5可得,在前2h内,对漆酶的吸附处于初始阶段,空心复合微球的吸附速率会十分迅速,而随着时间增加,空心复合微球样品对漆酶的吸附量逐渐趋于饱和,8h后空心复合微球样品K0、K1、K2 对漆酶的饱和固定量分别是234mg/g、190mg/g、185mg/g。在不同条件下制备的介孔SiO@SiO@FeO空心复合微球的样品中,样品K0的漆酶固定量最高,而且在样品K0、K1、K2中漆酶固定量依次降低。这主要是因为样品K0 的最可几孔径最大,酶分子更容易进入孔道中。

图5 不同Fe3O4@SiO2@介孔SiO2空心微球对漆酶的固定量随时间的变化
漆酶分子的尺寸大约在7nm×5nm×5nm,而随着空心复合微球样品K0、K1、K2的最可几孔径依次降低,其对于漆酶的固定化能力也相应降低,因此酶分子尺寸与酶固定化载体孔径之间的匹配十分重要。介孔孔径过小会导致酶分子无法进入孔道或在孔道中堵塞,孔径过大则会导致酶分子从孔道中脱落。这说明载体孔径与酶分子尺寸之间的匹配是影响酶固定化性能的一个十分重要的因素。图6为漆酶分子在不同尺寸孔径的FeO@SiO@介孔SiO空心微球中移动方向。从图6可以看出,酶分子在过小尺寸的孔道中容易发生堵塞,在过大尺寸的孔道中容易出现泄漏。为了达到最佳的酶固定化性能,需要选择合适介孔尺寸的载体材料。
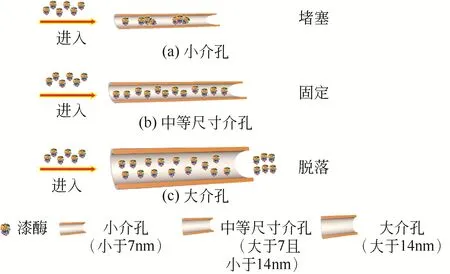
图6 漆酶分子在不同尺寸孔径的Fe3O4@SiO2@介孔SiO2空心微球中移动方向
图7 为FeO@SiO@介孔SiO空心复合微球固定化漆酶和游离漆酶的相对活性。从图7(a)可以看到,随着pH由3变到7,固定化酶的酶活性都显著高于游离酶,并且固定化酶的相对活性变动不大,游离酶变化较明显,表明固定化酶在不同pH 下的稳定性更高;pH=4 时,游离酶与固定化酶活性均最高。当pH=7 时,游离的漆酶与固定化酶的活性分别为8%和57%,这说明固定化漆酶对于酸碱环境的耐受力显然远强于游离酶。使用微球作为载体进行漆酶的固定化时,此时载体对漆酶分子提供一个保护层,同时空心复合微球的表面上含有大量硅羟基,在接触到酸性离子时会对pH 的变化起到一个缓冲作用,因此固定化酶在不同pH 下的稳定性更高。从图7(b)可以看到两者对温度变化表现出的环境抵抗力有明显差异,显然固定化酶相对催化活性更高。在30℃下固定化漆酶和游离酶都保持着较良好的催化活性,固定化酶的酶活性为93%。酶分子对于环境温度十分敏感,在非最佳反应温度下难以保持良好的催化活性。在实验条件达到70℃时,游离酶的相对活性只剩8%,酶分子大量失活,而固定化酶还能保持35%左右的酶活性。这表明,以FeO@SiO@介孔SiO空心复合微球作为载体进行酶固定化可以使酶分子具有更高的催化活性。在极端的温度和酸碱环境下,固定化酶分子的催化活性都显著优于游离酶。
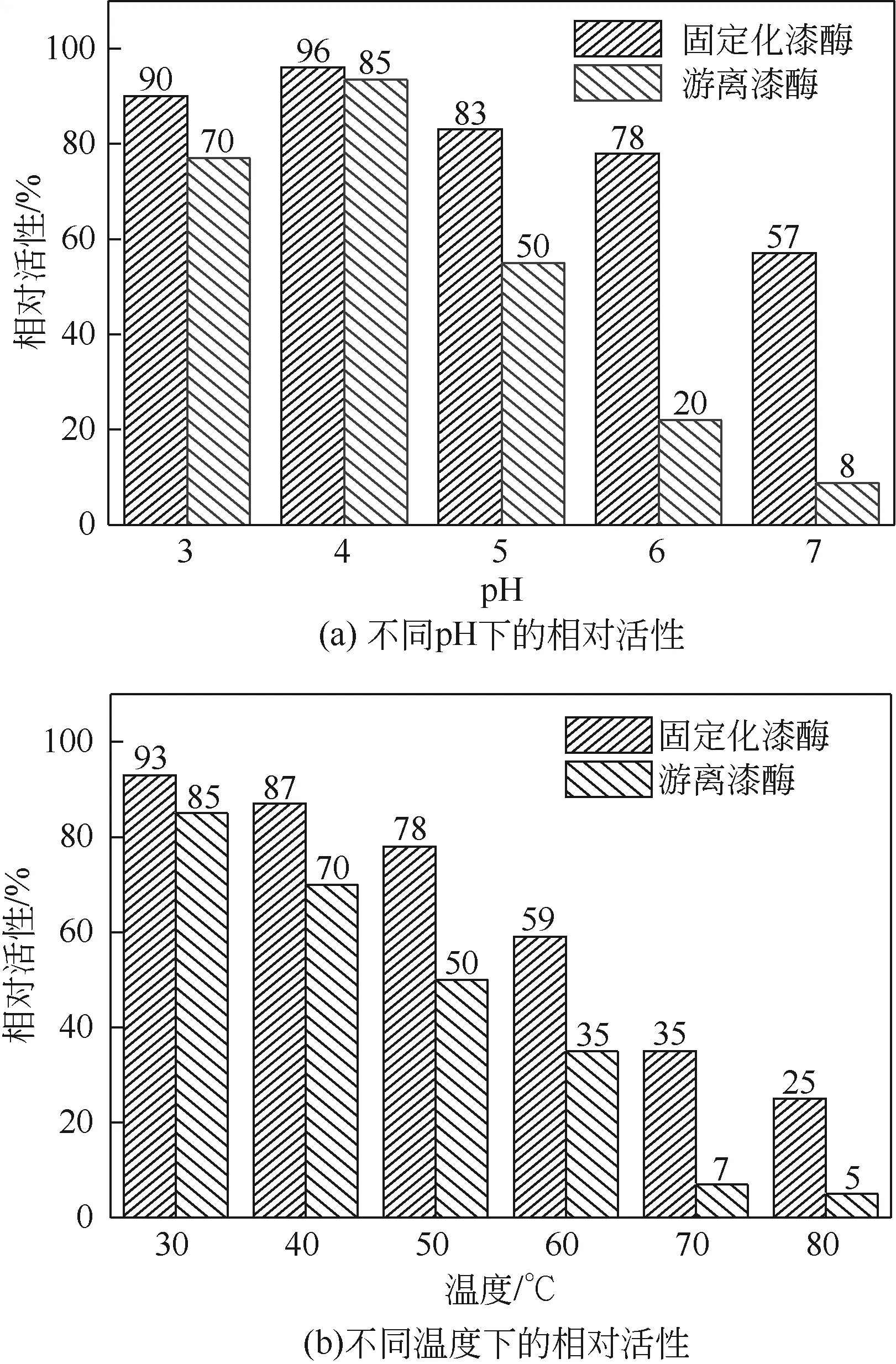
图7 Fe3O4@SiO2@介孔SiO2空心复合微球固定化漆酶和游离漆酶的相对活性
3 结论
(1)以致密层SiO作为保护层,在酸性环境下成功得到磁性介孔中空复合微球,微球具有规整的球形结构,通过改变CTAB 的量能够调控介孔孔径,孔径变化范围在3.19~4.30nm,比表面积变化范围为376~640m/g。
(2) 空心复合微球的饱和磁化强度为11.3emu/g,矫顽力为111.5Oe,在外加磁场作用下可以快速实现样品的快速分离,且样品的再分散性良好。
(3)当介孔孔径为4.30nm 时,空心复合微球对漆酶的固定量高达234mg/g,以复合微球作为载体进行酶固定化可以使酶分子具有更高的催化活性,而且固定化漆酶在不同pH 和温度下的催化活性远高于游离酶分子。
(4)载体孔径与酶分子尺寸之间的匹配是影响酶固定化性能的一个十分重要的因素。在未来的研究工作中,可以通过使用扩孔剂代替CTAB来实现载体较大范围孔径的调节,以实现良好的酶固定化效果。
