微生物源生防杀菌剂的筛选方法研究
2022-10-29张志刚王开梅吴兆圆万中义方伟
张志刚,王开梅,吴兆圆,万中义,方伟
(湖北省生物农药工程研究中心/湖北省农业科技创新中心生物农药分中心,武汉 430064)
微生物源生物杀菌剂(或微生物源提取物)的筛选和化学杀菌剂的筛选相比,生物杀菌剂样品中不仅包括微生物代谢产物(化合物),而且还含有微生物菌丝(或孢子)。在筛选培养过程中,这些菌丝(或孢子)会持续扩张生长。同时,作为防治目标的模式靶标——植物病原真菌也会持续生长。由于样品中的微生物和模式靶标同时生长,所以常用的应对措施是把2个微生物接种到同一培养基(例如PDA培养基)中,并且两者之间有一定的空间间隔,通过观察生长交汇区域的菌丝生长状况来确定这2种微生物之间是否存在抑制作用。由于样品微生物的代谢产物因培养基不同,其产量及种类有很大差异,所以这种方法不足以反映生防菌发酵液样品全部成分的活性,只能比较2种菌在测试培养基中是否形成抑制[1,2]。在微生物源生物杀菌剂的筛选培养过程中,样品微生物和靶标微生物均会持续扩张生长,形成对营养及空间的竞争,活性反应可能源于样品微生物代谢产物的杀菌作用,也可能源于2种微生物之间的竞争。因此,为了明确筛选中的活性反应来源,准确反映发酵液样品的真实活性,有必要对微生物源生物杀菌剂样品进行分类后测试。按照菌体和化合物分开测试的原则,把发酵液分解成以下4类,即发酵液、离心后的上清液、过滤除去菌体的上清液、活菌体(菌丝或孢子)。与直接使用发酵液或菌体进行杀菌活性筛选相比,进行样品分类后的筛选不仅简化了活性反应,而且能测试出菌体和发酵液中代谢产物的真实活性,减少漏筛[3,4]。
1 材料与方法
1.1 材料
1.1.1 模式靶标胶孢炭疽菌(Colletotrichum gloeobosporioides)、番茄枯萎病菌(Fusarium oxysporum)、灰霉病菌(Botrytis cinerea)、西瓜猝倒病菌(Pythium aphanidematum)由湖北省生物农药工程研究中心微生物资源室提供,试验所用菌种保存在菌种库中,保存温度为-80℃,使用前用PDA培养基进行活化。
1.1.2 培养基PDA培养基、PDB培养基,琼脂粉(DH010-4型),由北京鼎国昌盛生物技术有限责任公司生产。
1.1.3 试剂及标准样品和标准菌株溶剂为无菌水、吐温-80,均为市售分析纯试剂;微生物源生物杀菌剂标准菌株:放线菌A17815、A18851、A19053、A20939、A20946、A65560,真 菌F0006、F0206、F0835、F0836、F1669、F2353。
1.1.4 发酵液放线菌和真菌发酵液由湖北省生物农药工程研究中心微生物资源研究室提供。培养基配方编号为HB-M-15。
1.1.5 主要仪器、设备仪器、设备主要有台式高速搅拌机(0˜7 000 r/min)、血球计数板、光学显微镜、高压灭菌锅、超声波振荡器、DH-S10型手持式组织匀桨机、0.22 μm细菌滤器、5 mL无菌注射器、旋转振荡器、移液器、96孔组织培养板(浅孔)、96孔组织培养板(深孔)、90 mm培养皿、生化培养箱、无菌操作台、酶标仪(THERMO MK3型)、台式离心机(EPPENDORF 5418型)、游标卡尺。
1.2 方法
1.2.1 培养基、筛选用培养板及培养皿准备PDA培养基灭菌后分装到培养皿,每个培养皿加入18˜ 20 mL,冷却备用。PDB培养基加入琼脂粉(0.3%),灭菌后备用。
1.2.2 发酵液及其他微生物源样品准备根据试验需要,把发酵液样品进行不同处理[5,6],离心后得到上清液、无菌上清液、菌丝和发酵液4类样品。取1.5 mL发酵液进行离心,速度14 000 r/min,取0.8 mL上清液,作为离心后上清液移入96孔组织培养板(深孔)中备用。滤渣加无菌水清洗、离心3次后,加入0.8 mL无菌水,混匀后取0.8 mL,作为菌丝样品移入96孔组织培养板(深孔)中备用。取1.5 mL发酵液使用0.22 μm细菌滤器过滤得到无菌上清液,取0.8 mL无菌上清液移入96孔组织培养板(深孔)中备用。取0.8 mL发酵液移入96孔组织培养板(深孔)中备用。
1.2.3 供试病原真菌培养物准备参考已有资料制备供试病原菌培养物[7,8]。①灰霉病菌孢子悬浮液制备。取培养3周后的纯培养物(半径为45 mm的培养皿),在培养皿中加入10 mL无菌水,用刮铲轻刮培养物表面,洗下孢子,制成孢子悬浮液。用细胞计数板进行孢子计数。如其中混有部分菌丝,用灭菌的医用纱布将菌丝过滤掉。②胶孢炭疽菌、番茄枯萎病菌、西瓜猝倒病菌菌丝悬浮液制备。将扩大培养1周后的纯培养物(300 mL三角瓶,加入100 mL PDB培养),加入高速搅拌机,以5 000 r/min的速度搅拌,搅拌累计60 s,以尼龙网过滤,滤液为菌丝悬浮液。用细胞计数板进行菌丝计数。灰霉病菌孢子悬浮液浓度为10 000个孢子/mL,胶孢炭疽菌、番茄枯萎病菌、西瓜猝倒病菌菌丝悬浮液浓度为30 000个孢子/mL。
1.2.4 平板对峙法中样品和靶标的距离及培养时间与活性反应的关系试验
1)活性评价指标[9,10]。测量对照组中靶标菌落面积和样品组中靶标菌落面积,比较面积差值,计算靶标菌菌落缺损率,菌落缺损率=(1-样品组菌落面积平均值/对照组菌落面积平均值)×100%。按缺损率进行梯度分级统计,分级梯度为0、1、3、5、7、9。梯度分级标准:0表示缺损率<5%;1表示缺损率为[5%,20%];3表示缺损率[21%,40%];5表示缺损率[41%,60%];7表示缺损率[61%,80%];9表示缺损率>80%。
2)平板对峙法中样品和靶标的距离及培养时间与活性反应的关系。移取5 μL发酵液样品和5 μL靶标菌菌丝悬液(或孢子悬液),接种到“1.2.1”中提前制备的PDA培养基表面,样品菌和靶标菌接种点以培养皿中心位置为对称点,相距一定的距离接种。样品菌和靶标菌的接种距离为2个接种物外沿距离。接种距离分别为2、7、15、25 mm。其中最大距离(25 mm)的确定是以生长最快的西瓜猝倒病菌的菌落培养24 h为依准。接种点样品面积半径不超过1.5 mm。每个接种距离重复接种3个培养皿,空白对照为无菌培养基HB-M-15。培养条件:温度20℃,相对湿度70%˜80%,黑暗。每天记录所有靶标菌菌落面积,持续6 d。
1.2.5 不同样品类型在平板对峙法和半固体法中对西瓜猝倒病菌的敏感性试验
1)活性评价指标及方法[11,12]。平板对峙法的活性评价指标及测度方法同“1.2.4”。样品和西瓜猝倒病菌菌丝悬液接种点以培养皿中心位置为对称点,相距2 mm。设2个重复。空白对照为无菌培养基HB-M-15。培养条件:温度20℃,相对湿度70%˜ 80%,黑暗。记录培养1 d和3 d的靶标菌菌落面积。
2)半固体培养基法的评价指标及方法。根据活性反应的不同,使用分级指标数(0、1、3、5、7、9)标记杀菌活性;96孔组织培养板中感染培养基加入量为0.095 mL/孔,样品加入量为0.005 mL/孔。每个样品用1个浓度,设2次重复。空白对照为无菌培养基HB-M-15。培养条件:温度20℃,相对湿度70%˜ 80%,黑暗。记录培养3 d的活性反应。
2 结果与分析
2.1 平板对峙法中样品菌及靶标菌在测试培养基上菌落半径的增长速率
4个靶标病原真菌、真菌发酵液样品和放线菌发酵液样品在测试培养基中菌落的增长速度存在差异,如图1a、图1b所示。4个病原真菌和6个供试真菌在测试培养基中菌落增长速度相近,除西瓜猝倒病菌在培养2 d后就长满培养皿外,其余真菌菌落在培养6 d时达30 mm左右。而放线菌在测试培养基中菌落半径增长速度相对较慢,菌落半径在培养6 d时仅达1.62˜2.81 mm(图1c)。靶标菌、真菌样品和放线菌样品在测试培养基中菌落扩张速度相差近10倍,如此大的差异在平板对峙法中势必影响抑菌圈的形成和大小变化。
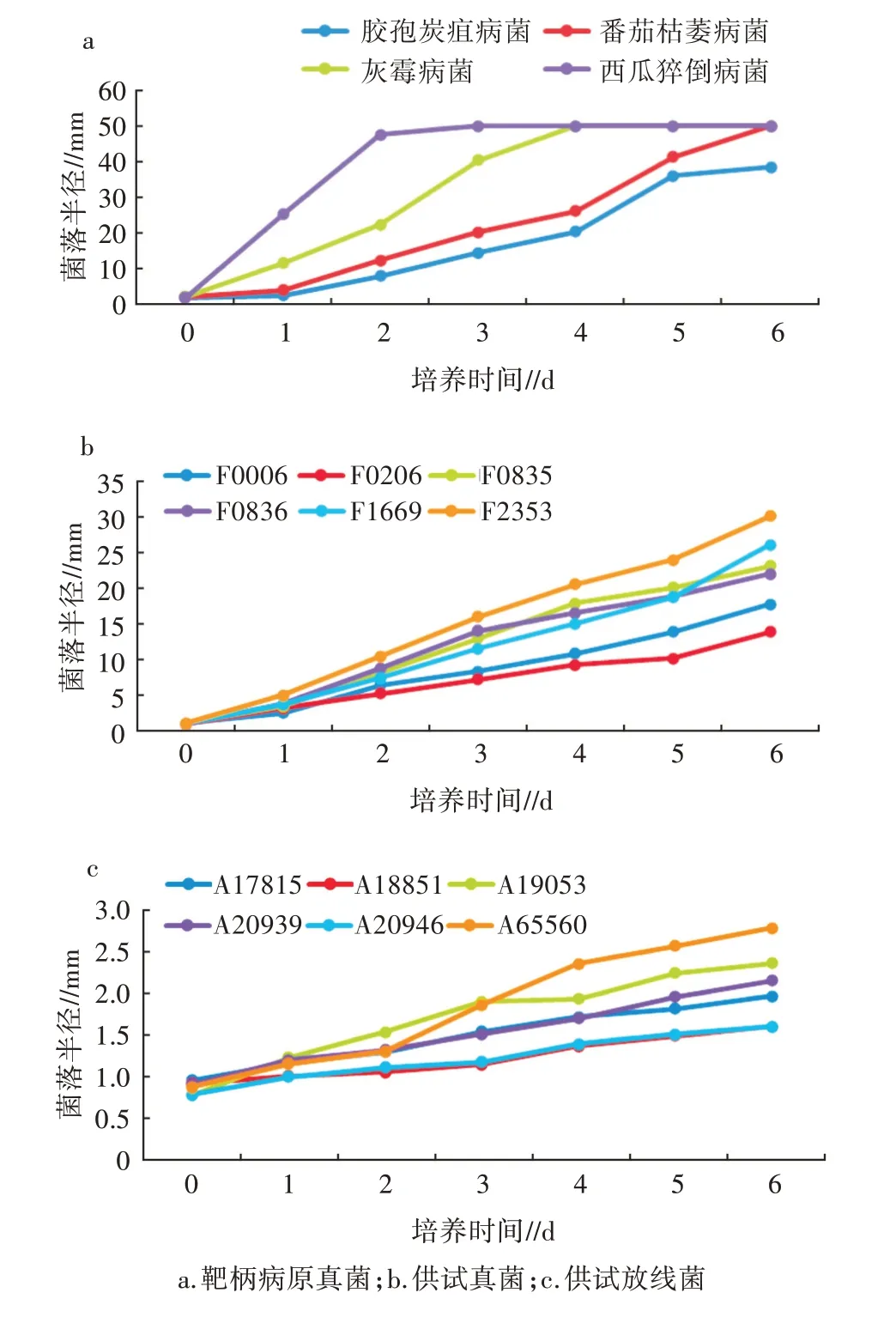
图1 真菌和放线菌在测试培养基中菌落半径的增长速率
2.2 平板对峙法中样品与靶标的距离及培养时间与活性反应的关系
发酵液接种到培养基表面后,一方面样品中的杀菌活性化合物会向四周扩散,当抑菌化合物接触到靶标菌时,靶标菌的菌丝生长受到抑制,菌落因此形成缺损。同时,样品中菌丝和靶标菌的菌丝也在持续扩张生长。从表1可以看出,平板对峙法中样品与靶标的距离越近,样品的活性越强;除了靶标菌完全被抑制(梯度分级为9)的情况,随着培养时间的延长,样品引起的靶标菌落缺损率递减;由于真菌样品中活菌随培养时间延长扩张生长,真菌样品的菌丝和靶标菌丝出现重叠交叉,最后抑菌圈分界区域被完全覆盖。而放线菌样品的菌落扩张速度慢,因此,抑菌圈的分界区域在6 d内一直存在,且该区域面积相对稳定,样品和靶标菌丝也无重叠交叉。
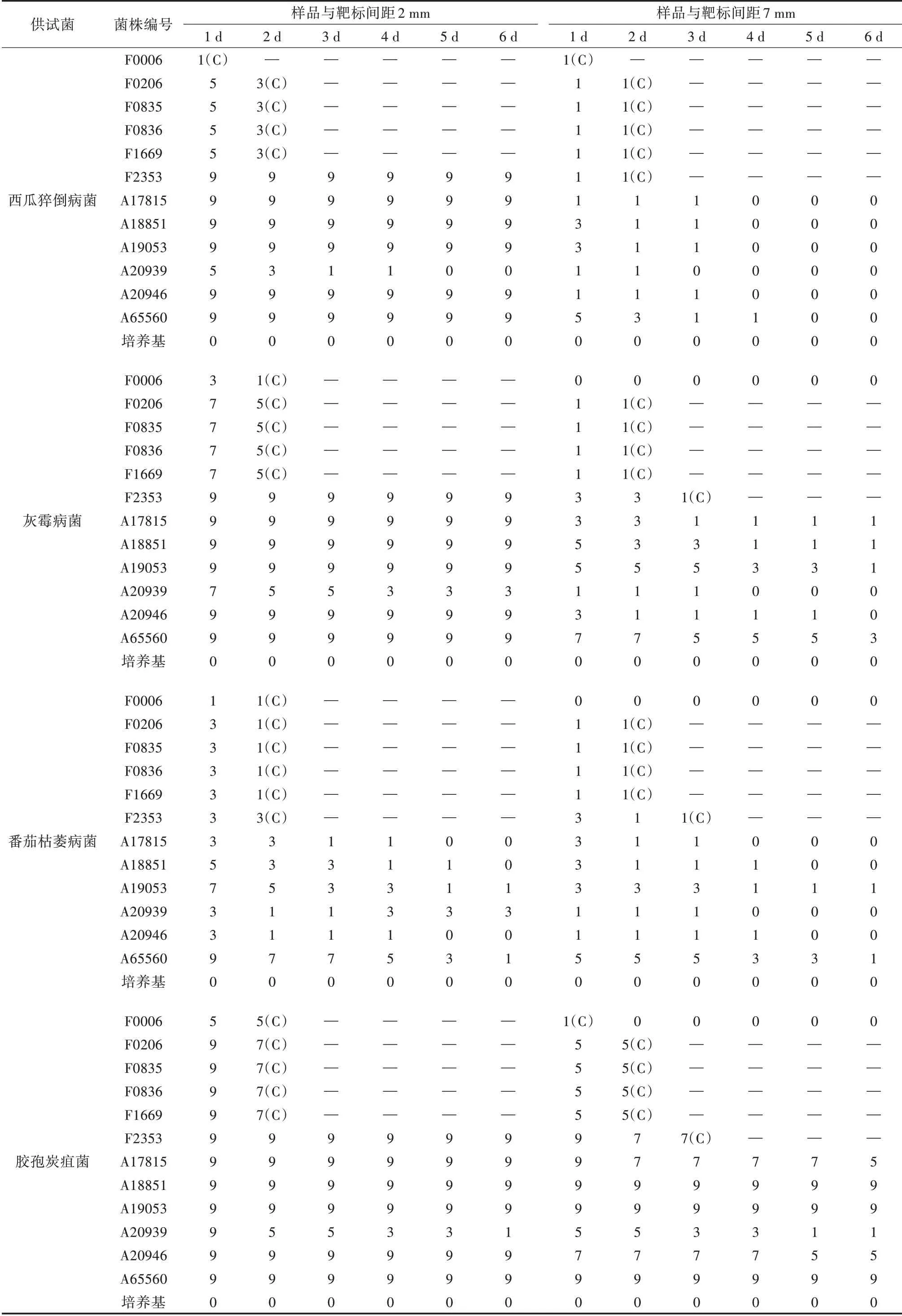
表1 不同接种距离和不同培养时间4个靶标菌菌落平均缺损率梯度分级
2.3 不同类型样品在平板对峙法和半固体培养基法中对西瓜猝倒病的敏感性
通过对4种样品的含菌量计数发现,发酵液和菌丝样品中含有大量活菌(100万˜300万个菌丝或孢子/mL),离心上清液中含有少量活菌(500˜1 000个菌丝/mL),无菌上清液中无活菌存在。结果(表2)表明,在平板对峙法中,发酵液活性反应最强,无菌上清液和离心上清液活性反应次之,菌丝样品活性反应最弱。当培养时间延长到3 d后,所有样品的无菌上清液活性全部消失,而其他含有活菌的样品中有部分还保持活性。可见,在平板对峙法中活菌存在对保持样品的活性反应有一定作用。在半固体培养基法中,无菌上清液样品表现出最强活性,离心上清液活性反应次之,含有大量菌丝的2类样品由于样品菌丝和靶标菌丝的同时生长,不能进行正常活性分级评价。可见,在半固体培养基法中,非靶标菌的活菌存在会引起类似杂菌污染的假阴性结果。

表2 不同类型样品在平板对峙法和半固体培养基法中对西瓜猝倒病菌的活性

续表
3 小结与讨论
生防菌在防治过程中,存在着2种主要的抑菌方式:其一是源于样品中抑制病原菌的化合物,这类化合物随着时间的延长,因被环境稀释或分解而活性降低;其二是随着培养时间的延长,样品菌在环境中不仅会持续扩大生存空间,同时也会持续产生抑制病原菌生长的活性化合物。这是生防菌应用的优势,在生防菌的筛选中可利用起来。半固体培养基法是一种比较成熟的化合物或提取物的杀菌活性筛选方法。平板对峙法由于操作比较复杂,而且测试需要的空间也比较大,在化合物或提取物的杀菌活性高通量筛选中应用较少。在生防菌活性测试样品中,单纯测试生防菌中化合物的活性不能完全反映防治环境条件下生防菌的真实防效。如果能让活菌与靶标菌同时生长,就与生防菌在实际应用环境中的情况相似,可以更准确地反映生防菌在实际应用中的真实防效。因此,在生防菌的活性测试中应该综合考虑抑菌活性化合物及活菌的单一和协作效果。
