鸭嘴海豆芽MyD88基因克隆和鉴定
2022-10-29毛旭娜
毛旭娜,李 军
(聊城大学 药学院,山东 聊城252059)
Toll样受体(Toll-like-receptors,TLRs)是一个重要的天然免疫受体家族,能够感知多种病原相关的分子模式(patho-associated molecular patterns,PAMPs),如未甲基化双链DNA(CpG)、单链RNA(ssRNA)、脂蛋白、脂多糖(LPS)和鞭毛蛋白[1]。当TLRs特异性识别了PAMPs后,通过多种接头分子启动先天免疫反应,产生促炎细胞因子,以抵抗病原体入侵。最早发现的Toll样受体是黑腹果蝇Toll-1,发现于1985年[2],在之后的研究中发现该基因及其信号通路在进化上高度保守。髓样分化因子88(Myeloid Differentiation Factor 88,MyD88)在TLR信号转导通路中发挥重要作用[3]。TLR信号通路包括MyD88依赖和MyD88非依赖信号通路[4]。在众多toll样受体中,只有少数TLR(如TLR3)不参与MyD88依赖的信号通路[5]。
MyD88通常由一个死亡结构域(Death Domian,DD)、一个中间结构域和一个TIR(Toll/白介素-l受体)结构域组成[3]。MyD88通过TIR结构域与多种受体的TIR结构域结合,对上游信号进行转导;通过DD结构域之间的相互作用招募并激活IL-1R相关激酶(IRAK),进而导致下游免疫信号级联放大[3]。目前的研究显示,MyD88是多种恶性肿瘤[6]、自身免疫性疾病[7,8]和感染性疾病[8]的潜在治疗靶点,在炎症反应和免疫细胞调控与增殖的研究中发挥着重要作用,在果蝇和文昌鱼中MyD88与TLRs的直接相互作用表明,该途径在进化过程中功能极为保守[9]。鉴于MyD88作为NF-κB信号转导通路的关键接头蛋白,在天然免疫中的重要作用,已有多个物种的MyD88基因被鉴别,如脊索动物门中的文昌鱼[10]、人[11]、小鼠[11]、斑马鱼[12],节肢动物门中的大腹园蛛[13]、果蝇[14],软体动物门中的海蜗牛、栉孔扇贝[15]、太平洋牡蛎[16],棘皮动物门中的海星以及刺胞动物门中的水螅[17]等物种,但迄今为止,后口生物和原口生物之间的过渡类群——腕足类动物MyD88基因还未鉴别。
鸭嘴海豆芽(Lingulaanatina),俗称海豆芽[18],外形呈壳舌形或长卵形,具大小不等两瓣壳体,腹壳后端茎孔伸出一粗大可伸缩肉茎,借肉茎肌肉收缩挖掘泥沙,穴居于潮汐带细砂质或泥沙质浅滩。海豆芽属于的冠轮动物超门(Lophotrochozoa),腕足动物门(Brachiopod),舌形贝亚门(Linguliformea)。寒武纪的化石证据证明舌形贝亚门是最为原始的腕足动物[18],现存舌形贝亚门仍然保留了祖先的形态和生活方式。目前已有研究人员完成了鸭嘴海豆芽基因组测序[19]。海豆芽基因组的解析为研究免疫系统的起源和演化提供了新的参考。
本研究成功克隆鸭嘴海豆芽MyD88基因(后均称laMyD88)全长序列,并成功构建表达载体进行定位及功能分析,同时进行革兰氏阳性菌(金黄色葡萄球菌)和革兰氏阴性菌(鳗弧菌)细菌挑战实验,利用实时荧光定量PCR技术进行半定量分析,发现在被细菌挑战后,laMyD88基因表达水平发生了变化,说明laMyD88参与鸭嘴海豆芽的天然免疫调控过程。我们的研究对于研究MyD88基因的系统进化具有重要意义。
1 实验材料
1.1 样本采集
鸭嘴海豆芽采自中国日照刘家湾海滩,选取长度约为40 mm,宽度约为20 mm的成年海豆芽,用于分离组织以及进行细菌挑战实验。
1.2 菌株和细胞
细菌挑战实验所用的菌株为金黄色葡萄球菌(革兰氏阳性菌)和鳗弧菌(革兰氏阴性菌)[20];克隆载体转化所用感受态菌株为Transl-T1 Phage Resistant Chemically Competent Cell,表达载体所用感受态菌株为大肠杆菌DH5α。实验所用细胞为人胚肾HEK293T细胞系和HeLa细胞系。
1.3 克隆载体及表达载体
克隆载体构建试剂盒pEAZY-Blunt Zero Cloning Kit,载体为pEAZY-Blunt Zero Cloning Vector,(Transgen,北京全式金生物技术有限公司产品)。表达载体构建所用的质粒为pDesRed2-N1、pcDNA3.1来自中山大学医药分子生物学实验室,荧光素酶报告基因质粒pNF-κB-Luc和pRL购自Promega公司。
1.4 主要试剂

表1 实验所用主要试剂
2 实验方法
2.1 laMyD88预测基因序列的获取和分析
通过NCBI数据库获得牡蛎MyD88氨基酸序列,在海豆芽转录组数据库 (https://marinegenomics.oist.jp/lingula/gallery)进行序列比对,获得该数据库中预测laMyD88基因的cDNA序列。蛋白质结构域使用SMART(https://smart.embl.de/)进行分析。
2.2 引物的设计与合成
根据基因组预测的laMyD88基因的3′和5′UTR区序列设计引物,扩增laMyD88基因全长CDS。在上下游引物前加入XhoI、KpnI酶切位点,设计构建表达载体引物[21]。根据鸭嘴海豆芽的转录组序列和基因组序列,设计内参基因及laMyD88基因的qPCR引物,所有引物(表2)均由苏州金唯智生物科技有限公司合成。
2.3 鸭嘴海豆芽总RNA的提取和cDNA合成
参照RNAiso(Takara,日本)试剂说明书进行总RNA提取。约25 mg的鸭嘴海豆芽组织经液氮研磨后加入到1 mL RNAiso试剂中剧烈摇晃15 s,静置后离心,取上清至新的离心管中加入氯仿,剧烈摇晃15 s,静置后离心,取上层水相至新的离心管中,加入等体积氯仿,剧烈摇晃15 s后静置,离心后取上层水相至新的离心管中,加入等水相体积异丙醇,轻柔颠倒混匀,-20 ℃静置1 h,离心,预冷乙醇轻柔洗涤沉淀。离心后去上清,待沉淀完全干燥至透明状后,加入DEPC水溶解,用紫外分光光度计测量OD值,并用1.0%琼脂糖凝胶电泳检测RNA纯度及浓度。RNA提取后及时逆转录,构建cDNA文库备用,剩余RNA保存在-80 ℃,尽量避免反复冻融。
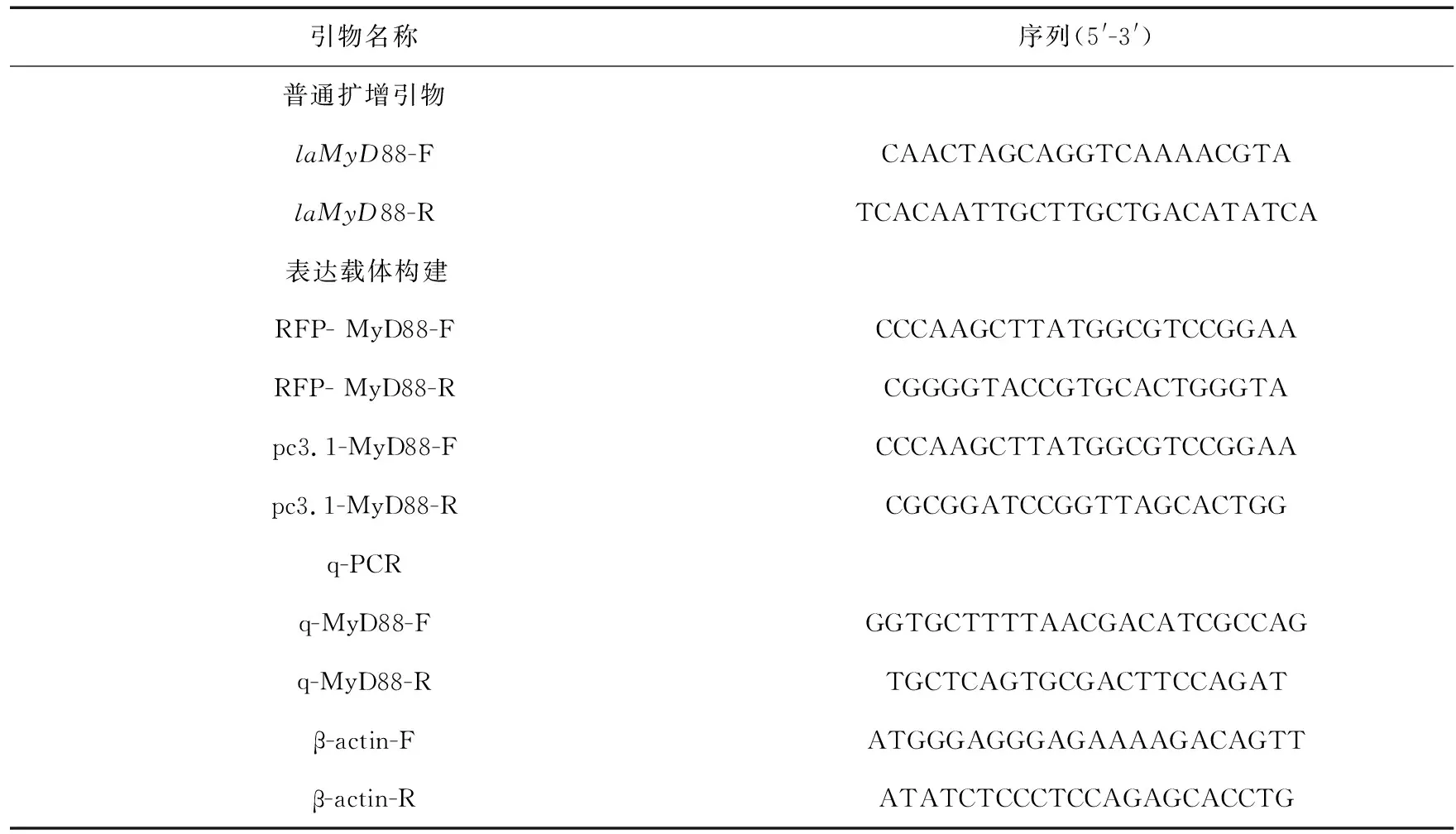
表2 实验所用引物
2.4 laMyD88基因的克隆及鉴定
以鸭嘴海豆芽cDNA为模板,利用扩增引物,进行laMyD88基因的全长序列扩增,扩增产物经琼脂糖凝胶电泳检测,挑选大小符合的条带用胶回收试剂盒进行纯化后备用,进行克隆载体与表达载体的构建。
利用pEAZY-Blunt Zero Cloning 试剂盒,将纯化的PCR产物与pEAZY-Blunt Zero Cloning Vector连接,并转化至Transl-T1 Phage Resistant Chemically Competent Cell感受态细胞中,培养后涂在含有氨苄抗性的琼脂平板上,该质粒含有自杀基因,不需要蓝白斑筛选,所有长出的菌斑均为含有目的基因的菌落。挑取10个单菌落,扩大培养进行质粒小提,进行菌落PCR进行初步验证,并将扩增片段大小与目的基因相同的质粒由苏州金唯智生物科技有限公司进行测序,用seqman软件拼接测序结果,用ClustalX软件比对。
2.5 表达载体的构建及鉴定
用限制性内切酶Xho I、Kpn I分别酶切PCR产物及pDesRed2-N1、pcDNA3.1质粒,连接后转化至大肠杆菌感受态细胞中进行扩大培养,待菌浓度合适后提取质粒,并命名为RFP-MyD88、pc3.1-MyD88,单酶切后经琼脂糖凝胶电泳检测,挑取片段大小正确的质粒,进行测序鉴定。
2.6 细菌、细胞培养
HEK293T、HeLa细胞在添加10% FCS(Gibco)和抗生素的DMEM培养基中,5%CO2,37 ℃培养。革兰氏阴性鳗弧菌和革兰氏阳性金黄色葡萄球菌,37 ℃过夜培养。离心收集细菌,PBS洗涤2次,重悬后计数,浓度调至5×106C/mL。
2.7 实时荧光定量PCR分析
实时定量PCR(qPCR)在以下条件下进行:98 ℃、3 min,98 ℃、10 s,50 ℃、5 s,72 ℃、3 min,运行40个循环。用SYBR Green I Master Mix在LightCycle 480Ⅱ Real-time PCR系统中进行qPCR。检测laMyD88和鸭嘴海豆芽β-肌动蛋白的Ct值。应用比较Ct值法(2-ΔΔCt)进行相对定量,ΔΔCt=处理组(目的基因Ct-内参Ct)-未处理组(Ct靶基因-Ct内参)。
2.7.1laMyD88在不同组织的分布差异。利用RNAiso从血液、消化腺、消化道、性腺、触手围、肉茎、肌肉、外套膜8个组织或器官中提取总RNA,构建cDNA文库。
2.7.2 细菌挑战实验。对鸭嘴海豆芽进行体腔注射,分别于注射后1、4、12、36 h采集不同时间点的实验动物,提取鸭嘴海豆芽总RNA,构建cDNA文库。
2.8 细胞亚细胞定位和及荧光素酶双报告基因分析
细胞在孔板培养24 h后,根据产品说明书,用lipofectine2000 (Invitrogen公司) 转染细胞。RFP-MyD88在HeLa细胞中表达,进行亚细胞定位研究,转染24 h后,PBS清洗盖层Hela细胞2次,4%多聚甲醛固定,激光扫描共聚焦显微镜共聚焦成像;将构建好的pc3.1-MyD88和空载体pcDNA3.1分别与报告基因质粒pNF-κB-Luc和海肾荧光素酶对照质粒pRL共转染到HEK293T细胞中,对照产品说明书进行双报告基因实验。根据公式计算样品住(sample)相对于对照组(control)报告基因活性的上调倍数:ΔFA=(F/R)sample/(F/R)control,F为报告质粒firefly荧光素酶读数值,R为内参质粒Renilla荧光素酶读数值。
2.9 统计分析
所有数据均采用均数和±SD。显著性分析采用One-way ANOVA检验。柱上的星号(*)表示试验数据与对照数据的显著差异(*,p<0.05;**,p<0.01;***,p<0.001;****,p<0.000 1)。
3 结果
3.1 laMyD88目的基因的克隆
利用所设计的克隆引物laMyD88-F及laMyD88-R,进行PCR扩增反应,对PCR产物进行凝胶电泳检测,发现扩增片段大小与预测片段一致,约为1 700 bp。测序分析表明,所获得克隆片段全长cDNA为1 695 bp,ORF为1 320 bp,编码439个氨基酸,如图1(a)所示。我们将所获得序列在NCBI genbank数据库中,利用BLASTX比对,结果显示,所获得序列与hsMyD88 (Homosapiens)、musMyD88(Musmusculus)、sjMyD88(Stichopusjaponicus)、bbtMyD88(Branchiostomabelcheri)同源,图1(a)表明我们成功克隆了鸭嘴海豆芽MyD88全长蛋白质编码区CDS(Coding sequence)。
3.2 laMyD88序列和进化分析
应用SMART数据库 (http://smart.embl.de/)对laMyD88的蛋白结构进行预测,laMyD88 蛋白序列第18~117 位氨基酸为死亡域 (DD),第172~306个氨基酸为TIR结构域,DD和TIRs的存在对其功能至关重要,结果如图1(a)所示。比较laMyD88与人、小鼠、斑马鱼、文昌鱼、刺参、果蝇、大腹园蛛、太平洋牡蛎、九孔螺、鹿角杯形珊瑚(Pocilloporadamicornis)等物种的已报道MyD88蛋白序列发现,后口动物MyD88只编码DD和TIR结构域以及一个中间结构域。而包括laMyD88在内的原口动物MyD88在蛋白序列的羧基端还编码了一段低复杂度区域,鹿角杯形珊瑚MyD88由三个DD+TIR的重复序列构成,结果如图1(b,c)所示。使用MEGA7软件的Neighbor-Joining算法以上述物种的MyD88基因的DD和TIR结构域分别构建进化树,结果如图1(d,e)所示。以DD构建的进化树表明,laMyD88与刺胞动物MyD88作为外群存在。以TIR构建的进化树表明,laMyD88与同属冠轮动物的软体动物MyD88 TIR结构域与后口动物亲缘关系更近。
3.3 laMyD88在不同器官或组织中的分布
采用qPCR方法检测laMyD88在鸭嘴海豆芽8个器官或组织中的特异性表达。如图2(a)所示,我们收集了8个器官或组织,包括血液(blood)、消化腺(digestive cecum)、消化道(gut)、性腺(gonad)、触手围(lophophore)、肉茎(pedicle)、肌肉(muscle)、外套膜(mantal)来研究不同器官或组织的差异。结果表明,laMyD88在不同器官或组织中的表达存在明显差异,与其他组织或器官相比,laMyD88在消化腺和消化道中表达量较高;其在肉茎和肌肉中的表达极低。
3.4 细菌挑战后laMyD88在鸭嘴海豆芽体内的表达情况
在细菌挑战实验中,注射革兰氏阳性金黄色葡萄球菌(S.aureus)和革兰氏阴性鳗弧菌(V.anguillarum)后,laMyD88基因的转录本均发生了显著变化,结果如图2(b,c)。注射革兰氏阳性金黄色葡萄球菌后,laMyD88的相对表达量在1 h内升高,然后降低。在接下来的10 h中,出现了波动,在12 h,表达水平达到了顶峰,然后从第12 h开始下调。革兰氏阴性鳗弧菌与革兰氏阳性金黄色葡萄球菌的表达略有不同。1 h,laMyD88的相对表达量降低,7 h后逐渐升高。在8 h,表达水平上升到最高,然后下降。注射革兰氏阳性菌金黄色葡萄球菌和革兰氏阴性菌鳗弧菌36 h相对表达量均高于对照。
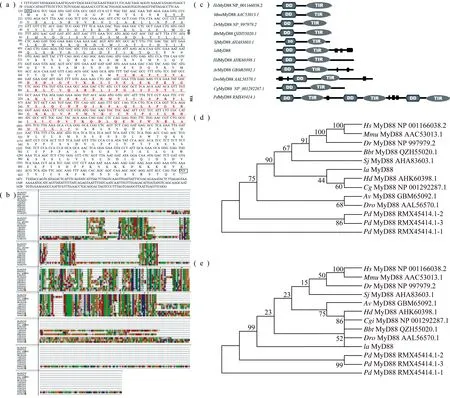
注:(a) laMyD88核酸和氨基酸序列;(b) 不同物种MyD88的蛋白序列比对; (c)鸭嘴海豆芽laMyD88与人hsMyD88、大腹园蛛avMyD88、文昌鱼bbtMyD88和刺参sjMyD88的结构域比较。(d) MyD88基因DD结构域系统发育树;(e)MyD88基因TIR结构域系统发育树。物种中英文名称比对:人(Homo sapiens,hsMyD88)、小鼠(Mus musculus,MmuMyD88)、斑马鱼(Danio rerio,DrMyD88)、文昌鱼(Branchiostoma belcheri,BbtMyD88)、刺参(Stichopus japonicus,SjMyD88)、果蝇(Drosophilid,DroMyD88)、大腹园蛛(Araneus ventricosus,ArMyD88)、太平洋牡蛎(Crassostrea gigas,CgMyD88)、九孔螺(Haliotis diversicolor,HdMyD88)、鸭嘴海豆芽(lingula anatina,laMyD88)、鹿角杯形珊瑚(Pocillopora damicornis,PdMyD88)。
3.5 laMyD88的蛋白表达及亚细胞分布
将表达RFP-MyD88融合蛋白的质粒转染Hela细胞,利用激光扫描共聚焦显微镜检测laMyD88蛋白的表达情况,结果如图3(a)所示,红色荧光点在细胞质中,与文献报道的文昌鱼bbtMyD88基因在细胞中的表达一致[22]。经查阅文献,发现各物种MyD88基因均位于细胞质内核小体中。
3.6 laMyD88参与核因子-κB信号通路
为了验证laMyD88是否能够激活NF-κB信号通路,参与天然免疫应答。我们将laMyD88的ORF重组到pcDNA3.1质粒中。荧光素酶双报告基因分析表明,laMyD88过表达能显著提高荧光素酶的表达,且具有转染剂量依赖效应,图3(b)。
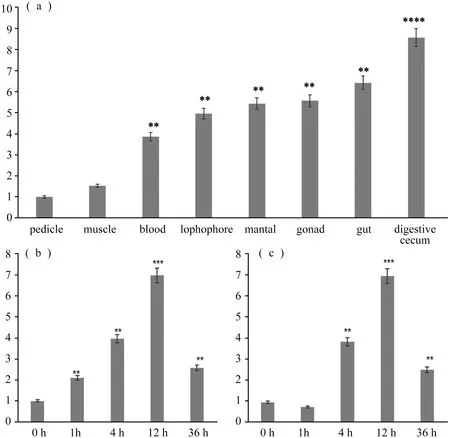
图2 (a) laMyD88的组织或器官分布;(b)金黄色葡萄球菌刺激后laMyD88在0、1、4、12、36 h的qPCR分析;(c)鳗弧菌刺激后laMyD88在0、1、4、12、36 h的qPCR分析(*,p<0.05;**,p<0.01;***,p<0.001;****,p<0.000 1)。
4 讨论
20世纪80年代以前,腕足动物门因为具有辐射卵裂和肠体腔等胚胎发育特征而被归于后口动物[23],现代分子生物学将腕足动物划归于原口动物[24]。尽管腕足动物在冠轮动物门的准确系统发育位置仍然不能确定,但海豆芽为代表的腕足动物在系统进化相关研究中具有重要地位。
本文成功克隆了鸭嘴海豆芽MyD88基因,命名为laMyD88,通过对laMyD88蛋白质结构域分析显示,laMyD88由氨基端的死亡结构域,羧基中间的TIR结构域以及羧基端的一段低复杂度区域构成,该结构特点在原口动物高度保守。而后口动物MyD88只编码DD和TIR结构域以及一个中间结构域,这说明MyD88基因在原口动物进化过程中的保守性。以DD结构域进行进化分析表明,海豆芽与其他原口和后口动物物种相比保留了较为原始的祖先特征,而以TIR构建的进化树表明,海豆芽与后口动物亲缘关系更近,而蜕皮动物则保留了较为原始的祖先特征。以上结果既符合现代分子生物学对腕足动物的系统分类,为确定腕足动物的系统进化地位提供了新的证据。
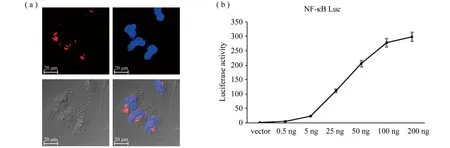
图3 (a)laMyD88在HeLa细胞中成功表达及laMyD88免疫荧光情况;(b)HEK293细胞过表达laMyD88后荧光素酶报告基因pNF-κB-Luc的相对荧光素酶活性
对于laMyD88在鸭嘴海豆芽组织中的表达情况研究发现,鸭嘴海豆芽消化腺和消化道的表达量最高,这与其他物种中的研究基本一致。众所周知,腕足动物仅存在先天免疫,而作为滤食性动物在富含微生物的泥土中生活,受环境的胁迫,消化腺和肠道是免疫系统中重要的器官,因此其表达量较高;查阅文献发现,软体动物的血细胞在先天免疫中有着至关重要的作用[25],而本研究中鸭嘴海豆芽的血细胞表达量较低,我们推测laMyD88在鸭嘴海豆芽应激状态下进行大量表达。肉茎主要是肌肉组织,为鸭嘴海豆芽的运动提供动力以及便于固着在泥中,表达量较低;触手围主要用于过滤砾石等杂质,处于胁迫环境中,在鸭嘴海豆芽中的表达量高于肌肉。
双荧光素酶报告基因检测结果显示,pc3.1-MyD88可激活荧光素酶报告基因pNF-κB-Luc的相对荧光素酶活性,说明laMyD88参与NF-κB信号通路,与后口动物相似[9,26]。无脊椎动物中NF-κB信号通路是重要的应激免疫通路[27],同时结合laMyD88经革兰氏阳性菌和革兰氏阴性菌刺激后的表达情况,表明laMyD88依赖的NF-κB信号通路在鸭嘴海豆芽的先天免疫中发挥重要作用。
本实验成功构建laMyD88的表达载体,但对laMyD88基因功能的研究还不够深入。TLR信号转导途径在天然免疫抗病毒、细菌及真菌过程中发挥着重要作用,而MyD88作为TLR信号转导通路中一个重要的接头蛋白,其在鸭嘴海豆芽免疫应答过程中可能起着更为关键作用。通过研究laMyD88基因的功能,进一步阐述MyD88在鸭嘴海豆芽免疫应答中的调控机制,进而有可能为人体中免疫应答的调控提供新的补充,为多种自身免疫病、感染性疾病以及恶性肿瘤等疾病的治疗提供新的见解。
