切花小菊“红昌”脱毒技术研究
2022-10-29陈天烺吴海峰张宾宾赫文韬
刘 丹,王 容,陈天烺,吴海峰,张宾宾,方 萍,陈 炜,赫文韬
(浙江海丰生物科技股份有限公司,浙江绍兴 312000)
菊花(),为菊科菊属多年生宿根草本花卉,是我国的传统名花,被誉为花卉“四君子”之一。目前切花菊栽培地域广泛,在花卉产业中占有重要地位,作为世界四大切花之一,在生产规模上居于世界各类切花之冠。切花菊又分为多头和单头两大类,多头切花菊又称切花小菊,小菊的一个茎秆上有多个花蕾,一般为5~7个,花朵直径6 cm以下,主蕾与侧蕾长势均衡,花期接近,呈伞形花序,观赏价值和经济价值极高,在国内和国际市场的需求量迅速增加。为了满足市场需求,近年来,菊花栽培面积不断扩大,但菊花的病毒病越来越严重。已报道侵染菊花的病毒有20余种,如番茄不孕病毒(Tomatoa spermy virus,TAV)是危害菊花的主要病毒之一。TAV 为黄瓜花叶病毒属的成员。侵染TAV病毒的菊花植株表现矮化、变形、碎花、花叶、皱缩、坏死等现象,严重影响菊花的品质和产量,阻碍菊花产业的发展。笔者以切花小菊“红昌”为试材,探究菊花脱毒技术,以期为脱除菊花病毒及解决品种退化提供技术和数据参考。
1 材料与方法
供试脱毒材料:经鉴定感染TAV病毒的小菊“红昌”(采自浙江海丰花卉有限公司种植基地),该小菊为扦插培养18 d后得到的小菊幼苗,处于营养生长时期。
病毒唑预脱毒。用一次性注射器在距离地面2 cm的小菊“红昌”植株茎秆上注射病毒唑溶液,溶液浓度分别为0(CK)、5、10、15、20 mg/L。培养条件:空气湿度为50%~75%,环境温度为15~30 ℃,光照时间为14 h/d,光照强度为50 000~100 000 lx。培养期间注意防虫防菌,培养30 d后得到预脱毒小菊。
外植体的无菌培养。选取获得的预脱毒小菊当年生嫩枝,剪去叶片,将其茎段剪成带4~5个芽的小段,在洗洁精水中浸泡10 min,取出将每个带芽茎段单独用自来水流水冲洗1 min;然后将清洗后的带芽茎段在多菌灵1 000倍液中浸泡30 min,取出单独用自来水流水冲洗1 min;在超净工作台上将清洗后的带芽茎段在75%乙醇溶液中浸泡30 s,取出用无菌水冲洗2次;最后将冲洗后的带芽茎段在有效氯为5%次氯酸钠溶液中浸泡10 min,取出用无菌水冲洗6次,每次冲洗1 min,得到消毒灭菌后的茎段。将获得的茎段切成长2~3 cm的小段,每个小段带有1~3个腋芽,同时切除茎段两端2~3 mm接触药品的部位,将其接种于含有不定芽诱导培养基MS(3/4大量元素)+6-BA 0.2 mg/L+蔗糖30 g/L的组培瓶内进行初代培养。25 d继代培养一次,继代培养基为MS+6-BA 0.5 mg/L+蔗糖30 g/L+活性炭0.5 g/L。培养条件:温度为(22±2) ℃,光照强度为2 000 lx,光照时间为14 h/d。
热处理结合茎尖培养脱毒。将继代培养基中培养6 d得到的无菌瓶苗在光照培养室中培养7 d后置于光照培养箱内,采用昼夜变温的方式进行热处理,进一步提高茎尖的脱毒率。设置2种热处理方式:处理T,热处理35 d;第1~5天:白天(8:00—20:00)高温28 ℃,晚上(20:00—次日8:00)低温25 ℃;第6~12天:白天(8:00—20:00)高温33 ℃,晚上(20:00—次日8:00)低温28 ℃;第13—35天:白天(8:00—20:00)高温39 ℃,晚上(20:00—次日8:00)低温33 ℃,湿度均为30%~50%。处理T,光照时间12 h/d,光照强度3 000 lx,按昼夜温度28~32、30~35、33~38 ℃的顺序,每2 d变换1档。然后在33~38 ℃下继续热处理脱毒培养30 d。热处理培养后进行茎尖剥离。
茎尖剥离、接种与培养。将经过热处理的无菌苗在超净工作台上用镊子和刀片切下菊苗顶端1~2 cm,接种于含有茎尖固定培养基MS+琼脂5 g/L的培养皿中,以防在茎尖剥离过程中由于脱水而影响成活率(以不使用茎尖固定培养基直接剥离作为对照)。在40倍解剖镜下,一手用镊子轻轻将材料固定于视野中,另一手用11号手术刀将菊花顶芽外的幼小叶片小心依次剥离,注意操作过程中不要过早折断茎,以免增加剥离难度,直至在解剖镜下能看清表面光滑、呈圆盘状轻微发亮的茎尖为止。用手术刀割取茎尖组织,大小分别为0.1~0.3、0.8、1.5、1.9 mm,然后迅速接种于茎尖诱导培养基中进行培养,pH 6.0,接种时轻轻放置于培养基表面,避免将茎尖深埋培养基中。培养条件:温度为(22±2) ℃,光照强度为2 000 lx,光照时间为14 h/d,30 d后统计茎尖成活率。
茎尖成活率=(茎尖成活数/接种茎尖总数)×100%
茎尖诱导培养基的不同配方:CHR-1,改良MS+6-BA 0.3 mg/L+NAA 0.1 mg/L+活性炭0.5 g/L+蔗糖30 g/L+琼脂5 g/L;CHR-2,MS+6-BA 0.3 mg/L+NAA 0.1 mg/L+活性炭0.5 g/L+蔗糖30 g/L+琼脂5 g/L;CHR-3,ZL+6-BA 0.3 mg/L+NAA 0.1 mg/L+活性炭0.5 g/L+蔗糖30 g/L+琼脂5 g/L;CHR-4,1/2B5+6-BA 0.3 mg/L+NAA 0.1 mg/L+活性炭0.5 g/L+蔗糖30 g/L+琼脂5 g/L(ZL为申请公布号为“CN109258460A”发明专利中的培养基组成成分)。
病毒检测。对所得的小菊植株(茎尖组织培养苗)进行TAV检测,统计脱毒率确定脱毒效果。
脱毒率=(脱毒植株数/热处理植株数)×100%
增殖培养。将获得的经鉴定确认不携带TAV病毒的小菊植株接种至增殖培养基中进行增殖培养,培养条件:温度为(22±2) ℃,光照强度为2 000 lx,光照时间为14 h/d。
生根培养。将增殖后的脱毒植株切成2 cm左右并带有1~3个叶芽的茎段,接种于生根培养基中进行生根培养。培养条件:温度为(22±2) ℃,光照强度为2 000 lx,光照时间为14 h/d。
2 结果与分析
经RT-PCR检测,小菊“红昌”脱毒前感染TAV的结果呈阳性(图1)。

注:M.Marker;1.阴性对照;2.供试脱毒材料TAV病毒的检测结果Note:M.Marker;1.Negative control;2.TAV test results of the tested virus-free material图1 TAV病毒检测结果Fig.1 Test result of TAV
由表1可知,采用不同浓度病毒唑对小菊进行预脱毒处理,小菊的脱毒率不同,以处理③的脱毒率最高,达92.50%;CK的脱毒率最低。部分茎尖组织培养苗的病毒检测结果呈阳性(图2),说明病毒唑预脱毒对菊花脱毒有重要作用。

表1 不同浓度病毒唑对脱毒率的影响
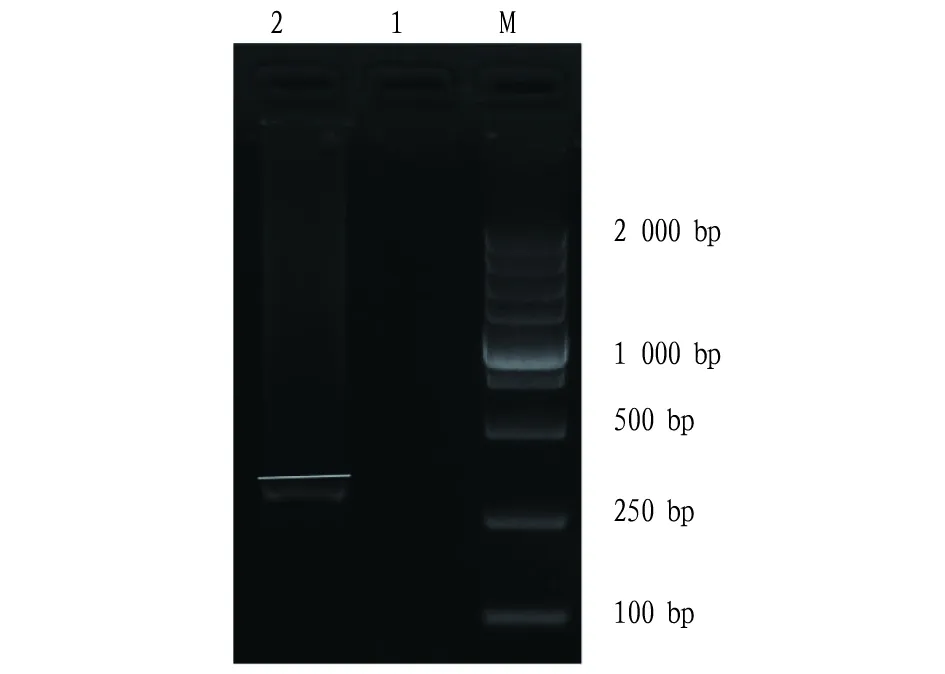
注:M.Marker;1.阴性对照;2.供试脱毒材料TAV病毒的检测结果Note:M.Marker;1.Negative control;2.TAV test results of the tested virus-free material图2 未经病毒唑预脱除TAV病毒检测结果Fig.2 Detection results of TAV virus without virazole pre removal
由表2可知,2种不同热处理方式对小菊脱毒率的影响呈极显著差异;处理T,病毒唑浓度及茎尖剥离大小均一致时,热处理温度采用25~39 ℃的方式,脱毒率极显著高于处理T,达92.50%。因此,热处理温度为25~39 ℃是热处理结合茎尖脱毒的最佳温度。无菌瓶苗在热处理前状态见图3,热处理后状态见图4。

表2 不同热处理温度对脱毒率的影响

图3 无菌苗热处理前Fig.3 Sterile seedlings before heat treatment

图4 无菌苗热处理后Fig.4 Sterile seedlings after heat treatment
由表3可知,剥离茎尖大小为0.1~0.3 mm,茎尖诱导培养基为CHR-1时,茎尖的存活率最高,达53.33%。因此,茎尖诱导培养基CHR-1时,即改良MS+6-BA 0.3 mg/L+NAA 0.1 mg/L+活性炭0.5 g/L+蔗糖30 g/L+琼脂5 g/L为最适合茎尖培养的培养基。茎尖培养30 d的状态见图5,茎尖培养60 d的状态见图6。
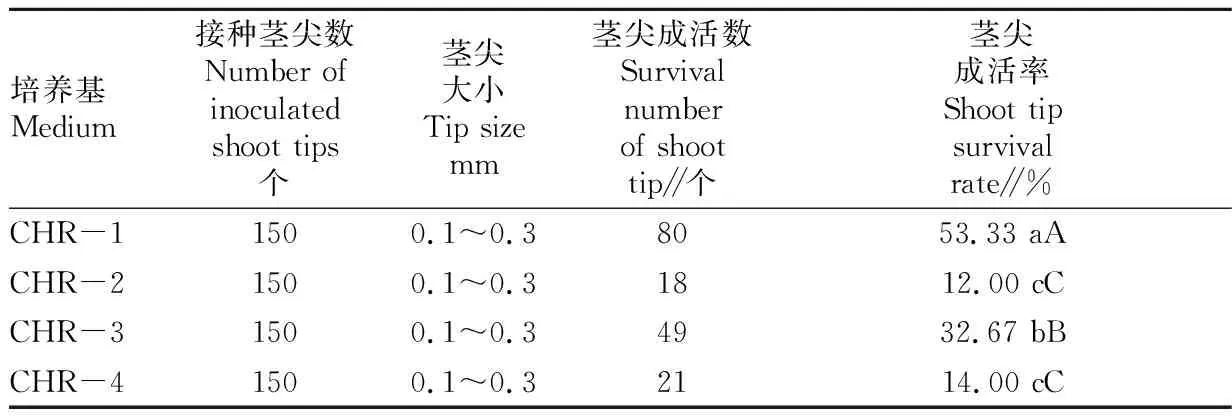
表3 不同茎尖诱导培养基对茎尖成活率的影响

图5 茎尖培养30 d的状态Fig.5 The state of shoot tip culture for 30 days

图6 茎尖培养60 d的状态Fig.6 The state of shoot tip culture for 60 days
由表4可知,茎尖大小为0.1~0.3 mm,茎尖诱导培养基为CHR-1时,小菊的脱毒率最高,达89.00%;且茎尖增大,小菊的脱毒率降低,说明茎尖越小,病毒的数量越少,越有利于小菊脱除病毒。因此,茎尖大小为0.1~0.3 mm(图7),有助于病毒的脱除,提高脱毒率。
由表5可知,茎尖大小相同时,剥离茎尖时采用茎尖固定培养基和不采用茎尖固定培养基的小菊茎尖存活率有着明显差异。处理①,采用茎尖固定培养基,茎尖大小为0.1~0.3 mm时,茎尖存活率最高,达60.00%。由此说明,剥离茎尖时,采用茎尖固定培养基能提高茎尖的存活率。

表4 不同大小茎尖对脱毒率的影响

图7 0.1~0.3 mm的茎尖Fig.7 0.1-0.3 mm stem tip

表5 茎尖固定培养基对茎尖成活率的影响
经病毒唑预脱毒,热处理结合茎尖剥离及茎尖培养得到脱毒无菌苗,通过RT-PCR检测无菌苗是否脱除TAV:首先提取待测无菌苗的RNA,反转录获得cDNA;以cDNA为模板,采用TAV-F1和TAV-R1进行第1轮PCR反应,得到第1轮PCR产物;以第1轮PCR产物为模板,采用TAV-F2和TAV-R2进行第2轮PCR,得到第2轮PCR产物(终产物)。引物序列如下:
TAV-F1:CCATCCCTTCAACATCCGAC
TAV-R1:GTTGAAGCGGAAGGAATACG
TAV-F2:TTATTGCTGGGAAGAAGTGTCG
TAV-R2:CGGTGGGAACGTGCTGAT
图8为脱毒后植株病毒检测结果,结果显示呈阴性。

注:M.Marker;1.阴性对照;2.茎尖组织培养苗TAV检测Note:M.Marker;1.Negative control;2.TAV test results of shoot tip tissue culture seedling图8 脱毒后TAV病毒检测结果Fig.8 Test results of TAV virus after virus removal
将获得的经鉴定后确认不携带TAV病毒的小菊植株接种至增殖培养基中进行增殖培养,在温度为(22±2) ℃,光照强度为2 000 lx,光照时间为14 h/d的条件下培养30 d后,得到增殖后的脱毒植株(图9),叶色浓绿,长势较好。

图9 增殖状态的脱毒苗Fig.9 Virus free seedling in proliferation
将增殖后的脱毒植株切成2 cm左右并带有1~3个叶芽的茎段,接种于生根培养基中进行生根培养,培养5~7 d后可明显观察到根系长出,在生根培养基中培养30 d后,得到脱毒生根苗(图10),植株健壮,根系发达。

图10 生根状态的脱毒苗Fig.10 Virus free seedlings in rooting state
3 讨论与结论
目前,有关菊花脱除病毒技术的研究已经有大量报道。国内外报道的侵染菊花的病毒种类多,特点不同,脱除难易程度也不同,因此不同的脱毒方法和病毒检测技术不断被研究和分析。何旭君等以“增城蜜菊”无菌瓶苗为材料,对脱除菊花B病毒(Chrysanthemum virus B,CVB)和番茄不孕病毒(TAV)进行了研究,得出最佳茎尖诱导培养基为MS+6-BA 0.1 mg/L+椰子汁100 ml/L+蔗糖30 g/L,诱导率为52.67%的结论,而该研究的最佳茎尖诱导培养基为改良MS+6-BA 0.3 mg/L+NAA 0.1 mg/L+活性炭0.5 g/L+蔗糖30 g/L+琼脂5 g/L,茎尖的成活率为53.33%,与何旭君等研究的诱导率相差不多。宋瑞琳等以切花菊为材料,采用热处理结合2次茎尖组织培养技术脱除TAV,茎尖取0.5~1.0 mm,热处理温度白天40 ℃,夜间30 ℃,脱毒率达83.3%~90.00%;而该研究的热处理温度为25~39 ℃,茎尖大小为0.1~0.3 mm,脱毒率略高于前者,为89.00%~92.50%。魏进莉研究结果表明,剥取的茎尖大小在0.1~0.3 mm时,病毒可100%被脱除,且与该研究中随着剥取茎尖大小的增大,脱毒效果降低结论一致。吴丹等以茎尖分生组织培养结合热处理或病毒唑处理脱除“滁菊”病毒效果明显,与该研究采用病毒唑10 mg/L进行预脱毒处理的结果类似。该试验的脱毒方法可为菊花的母本复壮和病毒脱除提供技术参考。
