西番莲顶枯病病原菌的分离与鉴定
2022-10-28黄艳花崔忠吉欧善生黄远光李杨秀
黄艳花,崔忠吉,欧善生,黄远光,蒙 成,李杨秀
(1.广西农业职业技术大学,南宁 530007;2.广西梧州市长洲区倒水镇农业技术推广站,广西 梧州 543006)
【研究意义】西番莲(Passifloraedulis)是西番莲科(Passiflo-raceae)西番莲属(PassifloraL.)草质藤本植物[1],原产于澳大利亚和南美洲的巴西,现广泛分布于热带和亚热带地区[2]。其果汁可散发出番桃、草莓、柠檬、芒果、菠萝、香蕉、石榴和酸梅等130多种水果的芳香物质,因此又名百香果,具有很高的营养价值和药用价值[3-4]。在我国南亚热带地区,西番莲被列为重点开发作物之一,西番莲饮料被我国多省区列为科技攻关项目及出口创汇发展项目[5]。近年来,广西、福建和贵州等地西番莲种植面积迅速增加[1],但各种病害发生也日益严重,目前报道较多的有病毒病、茎基腐病、疫病、炭疽病、灰霉病、根腐病、褐斑病、煤烟病、灰霉病和立枯病等[6-7]。2021年9月,本研究团队在广西南宁市西番莲试验基地发现1种新型顶枯病,严重时植株整株枯死,2021年12月对广西南宁市3个西番莲试验基地进行调查,发现其发病率达49.5%,已对西番莲生产造成严重危害。但该病害属于西番莲发生的新病害,尚未见相关研究报道。因此,准确鉴定该病害的病原菌,明确其分类地位,对西番莲顶枯病科学防控及西番莲产业的持续快速发展具有重要意义。【前人研究进展】目前报道的顶枯类病害主要由真菌性和细菌性病原菌引起,其中多数为真菌性病害,主要有灰毡毛忍冬顶枯病(Neofu-sicoccumparvum和Botryo-sphaeriadothidea)[8]、大麻顶枯病(Fusariumchlamydosporum)[9]、芒果顶枯病(Botryospbaeriaribis)[10]、杉木顶枯病[Pestalotiopsisapiculatus(Huang) Huang][11]、葡萄顶枯病(Eutypellavitis)[12]和茉莉顶枯病(Phomopsissp.)[13]。而细菌性病害主要为大豆顶枯病(Rickettsia-likebactenia)[14]和苦楝顶枯病(Bacteria—likeorganisms)[15]。上述顶枯类病害均有一个共同特征,即病部从枝条顶端开始发病,逐渐向下发展并产生死芽及枯枝。笔者将符合该症状的西番莲新病害称为西番莲顶枯病,其特征为发病初期在西番莲芽顶产生黑褐色湿腐状病斑,顶芽坏死,发病后病斑逐渐由顶端向下扩展,引起枝条由顶端向下枯萎,枝条节间及叶片不变形,发病部位叶片黄化枯死不脱落,病部有大量黑色小颗粒物,与徐平东等[16]报道西番莲死顶病病原菌为黄瓜花叶病毒(Cucumbermosaiccucumorirus,CMV),主要症状为死顶、叶片黄化和节间缩短等特征区别明显。【本研究切入点】目前,针对西番莲顶枯病病原菌鉴定的研究未见报道,对引起西番莲顶枯病的病原菌仍未明确。【拟解决的关键问题】通过西番莲顶枯病病原菌分离、致病性测定、形态特征观察及核糖体转录间隔区(ITS)、钙调蛋白(CAL)和交配型基因(ApMat)多基因序列分析,鉴定、明确引起西番莲顶枯病的病原菌,为今后开展该病害科学防控及促进西番莲产业的可持续发展提供理论依据。
1 材料与方法
1.1 试验材料
试验于2021年9—12月在广西南宁市广西农业职业技术大学植保实训基地百香果试验基地(108°21′E,22°49′N)进行。西番莲品种为台农1号,种植时间为2021年3月,前作为台农1号西番莲,顶棚架式种植,常规管理。
1.2 试验方法
1.2.1 病害症状观察及发病情况调查 在田间随机连片调查西番莲植株200株,观察其发病情况,统计发病率[发病率(%)=发病芽数/调查总芽数×100[18]],拍摄病害特征照片,采集病害样本并带回实验室徒手切片制作临时玻片,在光学显微镜下观察病原菌菌丝和孢子形态并拍照保存。
1.2.2 病原菌分离与纯化 采集症状典型、病斑新鲜的百香果顶枯病病株带回实验室,采用植物病原真菌组织分离法进行病原菌分离[17]。于百香果病株病健交界处切取规格为0.4 cm×0.5 cm的组织块,用75%乙醇消毒20~40 s,然后移入10%次氯酸钠溶液消毒3 min,最后用无菌水冲洗4次,用灭菌滤纸吸干组织表面水分后接种至马铃薯葡萄糖琼脂培养基(PDA培养基),培养皿倒置,于28 ℃恒温条件下培养2~3 d,长出菌丝后在菌落边缘用无菌镊子剪取形态单一的小菌丝块接种至PDA培养基进行纯化。培养6 d待菌落长出孢子后采用标记法进行单细孢纯化,在90 mm培养皿中倒入10 mL薄层PDA培养基,将浓度为1.00×103个/mL的孢子悬浮液布满在培养基上,用封口薄膜将培养皿密封,移入28 ℃培养箱培养8~10 h;用徕卡生物显微镜物镜10倍镜头从培养皿反面检查,挑选在视野内只有1个已经萌发但其附近没有其他孢子或菌丝存在的孢子,用记号笔对着孢子所在位置在培养皿反面画一个小点作记号,培养皿继续置于28 ℃培养箱培养1 d,标记处孢子长出的菌落即为该病菌单孢菌落。选取标记位置只有1个独立菌落的菌落转移到新的PDA试管斜面上培养5 d,再将长满菌丝的斜面试管放入4 ℃冰箱保存备用[18]。
1.2.3 病原菌致病性测定 菌丝块接种法。将单孢纯化保存的病原菌活化后接种至PDA培养基上28 ℃培养6 d,用直径5.00 mm的打孔器打取菌丝块。选取苗龄为4个月的健康西番莲扦插小杯苗,先用无菌水将小杯苗地上部清洗干净,待表面残留水分晾干后,在苗的芽顶用一次性医用针头轻扎3个距离小于5.00 mm的浅孔,然后挑取制备好的菌丝块置于刺伤部位,带菌丝的菌碟面接触枝条,用薄层医用脱脂棉浸湿无菌水后缠绕接种部位,外包保鲜膜保湿,接种后每天叶面喷雾、根部淋水保湿7 d。3次重复,每重复接种5株,以不带菌PDA培养基块为对照组。接种发病后从病斑上再次分离病原菌,进行柯赫氏法则验证。
孢子悬浮液接种法。将单孢纯化保存的病原菌活化后接种至PDA培养基上28 ℃培养7 d,用无菌水刷洗孢子,配制成浓度为1.00×106个/mL的孢子悬浮液备用。用无菌水将苗龄为4个月的健康西番莲扦插小杯苗地上部清洗干净,待表面残留水分晾干后,在苗的芽顶用一次性医用针头轻扎3个距离小于5.00 mm的浅孔,然后用小喷壶将配置好的孢子悬浮液喷雾到芽顶上,喷至顶芽全部湿润并刚好滴水后,用薄塑料袋将接种芽从上往下套住保湿。接种12 h后将塑料袋取出并每天叶面喷雾、根部淋水保湿7 d。3次重复,每重复接种5株,以喷雾无菌水为对照组。接种发病后从病斑上再次分离病原菌,进行柯赫氏法则验证。
1.2.4 病原菌形态学鉴定 将单细孢分离得到的病原菌在PDA培养基上活化,然后将菌块(d=5.0 mm)接至新的PDA培养基上,黑暗条件下于28 ℃恒温培养箱中培养,观察并记录PDA培养基上病原菌气生菌丝的生长状况和菌落正反面颜色。采用十字交叉法定时测量菌落直径,在光学显微镜下观察病原菌形态,用生物显微镜观察菌丝和分生孢子形态,随机选取100个分生孢子,测量其大小,参照李沛利等[19]的方法从形态上进行初步鉴定。
1.2.5 病原菌分子生物学鉴定 病原菌纯化菌丝体在PDA培养基上28 ℃培养5 d,进行DNA提取和PCR扩增。采用Biospin真菌基因组DNA提取试剂盒(杭州博日科技有限公司)提取病原菌DNA,引物送至北京擎科生物技术有限公司(南宁)合成;对病原真菌ITS[20]、CAL[21]和ApMat[20]基因序列进行扩增和测序,PCR扩增所用引物信息见表1;以1%琼脂糖凝胶电泳检测PCR产物纯度,测序及比对委托广西南宁国拓生物科技有限公司完成。PCR反应体系40 μL:上、下游引物各1 μL,DNA模板1 μL,2×TaqPCR MasterMix 20 μL,加ddH2O至40 μL。扩增程序:95 ℃预变性3 min;95 ℃ 15 s,56 ℃ 15 s,72 ℃ 30 s,根据各引物退火温度(表1)退火15 s,进行35个循环;72 ℃延伸5 min。完成上述步骤后,在Biometra EasyCycler Gradient中进行反应;PCR扩增产物送至广州擎科生物技术有限公司进行双向测序,将所得基因序列上传至GenBank数据库进行比对,下载相似性高且同时含有ITS、CAL和ApMat基因序列的模式菌株及参考菌株序列,按照ITS、CAL和ApMat顺序依次拼接,进行同源性比较,采用邻接法(Neighbor-joining,NJ)进行数据分析,bootstrap值设为1000,通过MEGA 6.0构建其系统发育进化树,确定病原菌的分类地位。
2 结果与分析
2.1 西番莲顶枯病病害症状及发病情况
从图1可看出,该病可危害顶芽和侧芽,发病初期在西番莲生长点附近产生湿腐状病斑,病部组织韧皮部和木质部同时坏死,导致顶芽坏死,病斑组织失水黄化枯死,叶片不易掉落;湿度大时病部表皮软化,病部组织易与木质部分离,剥开皮层后木质部也有湿腐现象,在病部表面看到明显的黑色小颗粒物即为病原菌分生孢子盘;病斑逐渐由顶端向下扩展,枝条由上向下枯萎,严重时整株枯死。2021年12月调查统计,西番莲顶枯病田间发病率达49.5%。
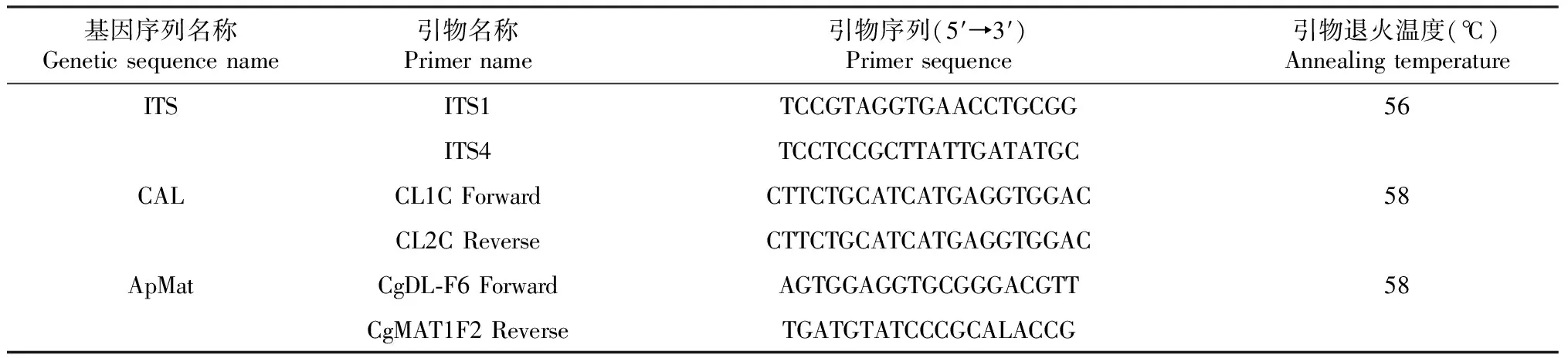
表1 PCR引物及扩增片段长度信息
2.2 西番莲顶枯病病原菌的致病性测定
从具有典型西番莲顶枯病症状植株病部均分离到同一形态真菌,命名为TK2A2CLA6菌株,菌株活化后分别以菌丝块和孢子悬浮液接种法接种到4月龄健康西番莲扦插小杯苗顶芽上,结果发现接种的顶芽发病率均为100.00%。其中,菌丝块接种法接种2 d后,接种部位开始出现水渍状腐烂,接种处易折弯,5 d后顶芽失水坏死易掉落;孢子悬浮液接种法接种5 d后顶芽失水坏死;2种方法接种15 d时植株由顶芽往下3~4个芽节均干枯黄化坏死(图2-A,2-B),而对照组植株健康,无感病症状(图2-C);菌丝块接种法接种容易引起芽顶断落,孢子悬浮液接种法接种的芽顶不断落,2种接种方法发病顶芽的其他症状与田间观察到的发病症状均相似,病斑处组织失水黄化枯死,由顶端逐渐向下扩散,枝条由上向下枯萎;植株发病后从发病部位再次分离获得的病原菌形态特征与接种病原菌完全一致。说明TK2A2CLA6菌株是西番莲顶枯病的致病菌株。
2.3 西番莲顶枯病病原菌的形态特征及分类地位
从图3可看出,将分离得到的TK2A2CLA6菌株单孢纯化后,菌落呈圆形或近圆形,正面产生灰白色气生菌丝,菌丝发达且较致密(图3-A),菌落背面初期为浅黄色(图3-B);继续培养到第7~8 d后菌落正面偶有橙色孢子堆产生(图3-C),菌落背面中央浅墨色、周围浅黄色(图3-D)。在PDA培养基上培养,菌丝平均生长速率为18.89 mm/d;分生孢子无色,近圆柱状,两端钝圆,或一端钝圆,另一端略细,一般具1~2个油球(图3-E,3-F),大小为(13.03~17.75) μm×(3.75~5.25) μm(平均为15.51 μm×4.70 μm,n=100);TK2A2CLA6菌株病原菌菌丝和分生孢子的形态学特征与野外采集样品徒手切片获得的结果相同。根据病原菌形态学特征,参考李沛利等[20]的研究结果,初步判定TK2A2CLA6菌株是真菌界半知菌类腔孢纲黑盘孢目黑盘孢科炭疽菌属真菌。
2.4 西番莲顶枯病病原菌的多基因分子鉴定
分别使用引物ITS1/ITS4、CL1C Forward/CL2C Reverse和CgDL-F6 Forward/CgMAT1F2 Reverse对TK2A2CLA6菌株的ITS、CAL和ApMat基因序列进行PCR扩增,得到的产物长度分别为750、773和875 bp。将测序得到的3条序列上传至GenBank,取得的登录号分为OM2833599(ITS V1~V4区)、OM302306(CAL)和 OM302307(ApMat)。将TK2A2CLA6菌株的3个基因序列在NCBI中进行BLAST比对,发现其与Colletotrichumsiamense多个序列的同源性达100%。从NCBI中下载13个Colletotrichum种使用MEGA 6.0邻接法(NJ)构建多基因系统发育进化树(图4),发现TK2A2CLA6菌株与C.siamenseLF177(KJ955092/KJ954645/KJ954508)和C.siamenseJH-Coll001(MK784123/MK784119/MK784118)以100%的自展支持率聚为独立的1支,结合形态学鉴定结果,确定西番莲顶枯病的致病菌是暹罗炭疽菌(C.siamense)。
3 讨 论
炭疽属真菌引起西番莲病害已有不少报道。谢美华等[22]研究发现,刺盘孢属(Colletotrichumsp.)是紫果西番莲炭疽病的病原菌,危害紫果西番莲叶片;冉飞等[23]研究认为,喀斯特炭疽菌(C.karstii)引起西番莲果实炭疽病;Du等[24]研究表明,C.brevisporum引起西番莲茎、果实、叶和卷须疾病,典型症状包括椭圆形至不规则形状的病变,发病部位棕色至棕黑色,并有凹陷空腔;Power等[25]研究指出,C.gloeosporioides引起西番莲梢端节间伸长减少,导致梢枯萎和死亡。本研究结果表明,暹罗炭疽菌是引起西番莲顶枯病的病原菌,受该病原菌侵染后,西番莲芽顶产生湿腐状病斑,病部组织韧皮部和木质部同时坏死,导致顶芽坏死,病斑处组织失水黄化枯死,叶片不易掉落,湿度大时病部表皮软化,病部组织易与木质部分离,剥开皮层后木质部也有湿腐现象,在病部表面可见明显黑色小颗粒即为病原菌分生孢子盘,病斑逐渐由顶端向下扩展,从而引起枝条由顶端向下枯萎,严重时整株枯死。
2009年在泰国首次发现暹罗炭疽菌侵染咖啡引发咖啡炭疽病[26],其后发现其可与其他炭疽菌混合引发鹅掌柴炭疽病[19]、荔枝炭疽病[20]、油茶炭疽病[27]、台农芒果实采收后炭疽病[28]、南天竹炭疽病[29]、红瑞木炭疽病[30]、紫山药炭疽病[31]和洒金珊瑚炭疽病[32]等多种植物炭疽病,也可独立引发杨桃采后炭疽病[33]、菠萝蜜炭疽病[34]、多穗柯炭疽病[35]、棕竹炭疽病[36]、百日草炭疽病[37]、大叶黄杨炭疽病[38]和红肉苹果炭疽病[39]。暹罗炭疽菌侵染植物除引发炭疽类病害外,还能引起其他种类病害,如王芳等[40]研究发现,暹罗炭疽菌能独立引发多肉植物青星美人黑腐病。本研究结果表明,暹罗炭疽菌能独立引发西番莲顶枯病。
炭疽属真菌遗传多样性丰富,暹罗炭疽菌是胶孢炭疽菌(C.gloeosporioides)复合物的物种之一,由至少22个物种组成,仅凭病原菌菌落形态和分生孢子特征不能区分这些物种[37]。本研究中,TK2A2CLA6菌株形态学特征与胶孢炭疽菌复合物相似[20],因此将其初步判断为真菌炭疽属;单独使用ITS基因序列对TK2A2CLA6菌株进行鉴定,结果表明TK2A2CLA6菌株与C.siamense、C.gloeosporioides和C.cobbittiense相似度均达100%,因此无法明确其具体种类,与李少卡等[20]研究认为将ITS基因序列分析法用于炭疽菌属真菌研究存在一定局限性的观点一致。李少卡等[20]研究结果显示,ApMat基因序列能很好地揭示胶孢炭疽菌复合群内菌株的遗传分化情况,考虑到在多数炭疽病鉴定中均使用CAL基因序列,本研究选择ITS、CAL和ApMat基因序列对TK2A2CLA6菌株进行多基因序列鉴定并建立多基因系统发育进化树,成功将TK2A2CLA6菌株鉴定为C.siamense。
本研究中,从典型西番莲顶枯病症状植株中分离所得TK2A2CLA6菌株的孢子与自然发病西番莲枝条上切片观察到的病原菌孢子形态一致,顶芽接种能使西番莲发病,且发病症状与自然发病症状一致,再分离得到的病原菌与原接种病原菌一致,根据柯赫氏法则,确定TK2A2CLA6菌株是西番莲顶枯病的病原菌,结合菌株形态学特征及多基因序列(ITS、CAL和ApMat)鉴定方法可确定西番莲顶枯病的病原菌是暹罗炭疽菌。后续可进一步探讨西番莲顶枯病病原菌暹罗炭疽菌的生物学特性和发生规律,开展西番莲顶枯病病原菌对杀菌剂的敏感性试验,筛选出安全、高效的防治药剂,结合农业栽培和生物防控措施,构建完整的西番莲顶枯病综合防控技术体系,以有效防控该病害的发生和蔓延。
4 结 论
本研究使用形态学方法结合多基因系统进化树分析,明确危害广西南宁西番莲顶枯病的病原菌为暹罗炭疽菌,可用于指导西番莲顶枯病诊断与防治。
