猫传染性腹膜炎病毒PL1蛋白抑制宿主细胞IFN-β产生机制的研究
2022-10-28蔡冬冬王正义刘伽均胡晓亮田志革
蔡冬冬,张 辉,王正义,罗 毅,刘伽均,李 春,胡晓亮,田志革*
(1.四川省动物疫病预防控制中心,四川 成都 610041;2.宜宾学院农林与食品工程学部,动物多样性与生态保育宜宾市重点实验室,四川 宜宾 644000)
1 材料与方法
1.1 细胞、毒株和质粒 FIPV DF2株、仙台病毒(Sendai virus,SeV)、萤火虫荧光素酶报告质粒、转录因子PRDⅢ/Ⅰ、NF-κB 和AP-1 报告质粒、RIG-1、MAVS、STING和TBK-1,均由中国农科院哈尔滨兽医研究所提供;CRFK细胞、空载体质粒p3×flag和pUb由“动物多样性与生态保育宜宾市重点实验室”保存;大肠杆菌感受态Trans5α购自宝生物工程(大连)有限公司。
1.2 主要试剂 鼠抗flag 单抗、兔抗GAPDH 单抗、抗IRF3-S396、抗IRF3 抗体,均购于Sigma 公司;质粒提取试剂盒,购于AXYGEN公司;胶回收纯化试剂盒,购于OMEGA 公司;双荧光素酶报告系统试剂盒,购自Promega 公司;DMEM 细胞培养基,购于Hyclone 公司;胎牛血清,购自Hyclone公司;胰酶,购于Gibco BRL公司;脂质体Lipofectamine 2000 转染试剂,购于Invitrogen 公司;Tween-20、30%聚丙烯酰胺等试剂,购于索莱宝公司;PVDF 膜,购自Millipore 公司;RAPI 裂解液,购自碧云天公司。
1.3 FIPV PL1 基因的PCR 扩增 根据FIPV DF2 株(GenBank 登录号:JQ408981)的PL1 基因(3566-4355位点),使用Oligo软件设计1对引物,上游引物:5′-TTTAAGCTTTCCTTGACCCCATTCA AGACA-3′,下游引物:5′-TTTGAATTCTTAATCT TTAGGACTTTGACAGTC-3′,预期扩增产物长度为792 bp。
1.4 PL1 蛋白抑制宿主细胞产生IFN-β的机制研究 转染前一天,将CRFK 细胞均匀铺于24孔板中,待细胞长成单层且密度达到80%左右进行转染。转染体系中有1 μg PL1及其突变体质粒,300 μL DMEM 无血清培养液,3 μL 转染试剂,10 ng RL-TK 内参质粒。依据试验目的,分别另向体系中加入600 ng IFN-β-Luc、NF-κB-Luc、PRD Ⅲ/Ⅰ-Luc或AP-1-luc报告质粒,每个试验重复3次,同时设置空载体对照。转染24 h后,每孔加入100 HAU的SeV,12 h后弃去上清,用裂解液将细胞裂解10 min,8 000 r/min 离心5 min 后取20 μL裂解液进行荧光素酶活性测定。
1.5 激光共聚焦试验 将293T细胞接种到激光共聚焦小皿中培养过夜。将PL1 蛋白与空载体p-flag 共转染293T 细胞,转染24 h 后,弃培养基,PBS洗涤2次后,用4%多聚甲醛室温固定30 min,并用0.1% TritonX-100 透膜15 min,用5%脱脂乳封闭1 h 后,加入抗IRF3 和抗IRF3-S396 抗体(1∶1 000)稀释,37 ℃孵育1 h,用PBS洗涤3次,分别加入抗兔和抗人抗体作为二抗,在37℃孵育1h,随后用PBS 洗涤3 次,DAPI 染色15 min,洗涤3次,最后置于激光共聚焦显微镜下观察。
1.6 免疫印迹试验 将PL1 蛋白与p-flag 载体分别与pUb 载体共转染293T 细胞后,接种SeV(100 HAU)12 h 后,收集细胞裂解液,经过13 000 r/min离心5 min后取上清,进行SDS-PAGE电泳,转膜,37 ℃封闭2 h,分别加入抗IRF3、抗IRF3-S396 抗体(1∶1 000)和HA 抗体(1∶3 000)后,加入抗兔和抗人抗体作为二抗,进行免疫印迹检测。
2 结果
2.1 PL1 蛋白抑制IFN-β启动子活性 为验证PL1 蛋白能否抑制IFN-β启动子的激活,将PL1与IFN-β启动子共转染CRFK 细胞,结果显示PL1 能够抑制SeV 诱导的INF-β启动子的激活(图1-A)。但是INF-β启动子含有3种转录因子PRDⅢ/Ⅰ、NF-κB 和AP-1,为进一步确定PL1 蛋白抑制哪一种转录因子,将PL1 蛋白与3 种转录因子启动子载体共转染,转染24 h后加入SeV,采用上述方法处理细胞后,检测荧光素酶强度。结果表明PL1蛋白能够抑制全部3种转录因子并且呈剂量依赖性(图1-B、C、D)。说明PL1 蛋白具有抑制IFN-β启动子的能力,并且能够抑制3 种转录因子启动子的活性。

图1 PL1蛋白抑制IFN-β启动子活性
2.2 PL1 蛋白抑制IRF3 磷酸化 为了验证PL1是否影响IRF3的磷酸化,将PL1转染293T后,分别接种SeV(HA=100),24 h 后分别进行Western blotting实验检测,结果与SeV诱导后相比,PL1蛋白能够明显下调IRF3的磷酸化(图2)。

图2 PL1抑制IRF3磷酸化
2.3 PL1 依赖催化活性抑制IFN-β的表达 为了确定PL1介导的抑制IFN-β表达是否依赖其催化活性,将PL1 突变体(C32A、H183A 和D196A)与RIG-1、MAVS、STING和TBK-1、IFN-β-Luc和pRL-TK 共转染293T 后,接种SeV,24 h 后检测Luciferase值。结果表明:与PL1相比,PL1的突变体(C32A 和H183A)几乎完全丧失对抗IFN-β启动子活性的能力,而D196A 仅仅有部分抑制活性。基于此,我们确认PL1蛋白抑制IFN-β启动子的活性需要被催化。PL1 能够分别抑制RIG-1、MAVS、STING 和TBK-1 诱导的IFN-β 的激活(图3)。
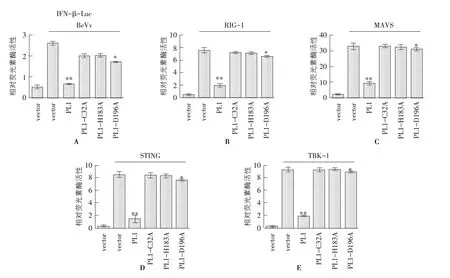
图3 FIPV PL1突变体与IFN-β-Luc的关系
2.4 PL1 利用DUB 活性降低Ub 的泛素化 上述试验证明PL1 蛋白能抑制IFN-β启动子活性,而PL1 突变体不具有其活性,PL1 的催化活性区域负责蛋白的去泛素化,这说明PL1 蛋白可能依赖于其蛋白酶活性。我们通过Western blotting实验证明PL1 蛋白具有去泛素化活性,而PL1 的突变体并不存在去泛素化活性(图4)。

图4 PL1蛋白的去泛素化活性
3 讨论
CoV-NL63 的PL 和SARS-CoV 的PL 既能通过抑制IRF-3 的磷酸化和核转移阻断IFN 的合成,又能抑制STING 介导的IFN-3 的核转移[1]。细胞中表达野生型和催化突变PL2-TM能够降低STING、RIG-1、TBK-1和IRF-3的泛素化水平,这些都可能影响IFN诱导的信号转导。MHV的PL2明显抑制CARDIF、TBK-1和IRF-3介导的IFN-β启动子激活,还能与IRF-3 结合抑制其核转移利用其去泛素化活性[2]。PEDV 的PL2 和TGEV 的PL1作为病毒的去泛素化酶干扰RIG-1和STING介导的信号转导[3]。冠状病毒利用PL 的酶活性逃避宿主固有免疫抗病毒反应。FIPV PL1 具有与TGEV PL1 相似的结构,后者具有去泛素化酶活性,因此推测FIPV PL1 也可能有此活性和功能。本研究发现FIPV PL1 抑制IFN-β启动子的表达和IRF-3的移核通过其催化活性区。
泛素化和去泛素化是病毒诱导的Ⅰ型IFN信号通路的重要调节方式[4]。RIG-1 通过E3 泛素化连接酶(TRIM25),引起下游Ⅰ型IFNs 的信号表达盒[5]。很多病毒具有去泛素化酶活性,比如口蹄疫病毒的Lpro[6],人巨细胞病毒的UL48[7],单纯疱疹病毒的UL36[8]和猪繁殖与呼吸合征病毒的nsp2 蛋白[9]。所有的冠状病毒都编码去泛素化酶,这可能会调节固有免疫应答。本研究发现FIPV PL1 的3 个催化活性中心的突变能够使去泛素化作用失活,不能抑制病毒诱导的IFN-β的激活,说明FIPV PL1 的去泛素化作用直接涉及Ⅰ型干扰素的抑制作用。
