液相色谱串联质谱法测定水中的亚硝胺类物质
2022-10-27郭茜楠王升昊
郭茜楠, 张 蕊, 王升昊
(天津水务集团水质监测中心, 天津 300241)
饮用水消毒副产物(disinfection byproducts,DBPs)是饮用水消毒过程中消毒剂与水中有机物反应产生的一系列副产物,其种类繁多,常见的有三卤甲烷 (THMs)、卤代乙酸 (HAAs)、卤酸盐 (氯酸盐、次氯酸盐和溴酸盐)等[1]。亚硝胺类消毒副产物(N-DBPs )作为一种新型的消毒副产物,具有致癌、致畸、致突变的危害,广泛存在于大气、水、土壤、食品、橡胶制品、烟草等环境介质中[2],尽管其浓度相对较低但毒性却高于常见的卤代消毒副产物。很多国家或地区已确定了亚硝胺类物质的检出限,例如美国加利福尼亚州已规定亚硝基二甲胺(NDMA)、N-二乙基亚硝胺(NDEA)和N-二丙基亚硝胺(NDPA)在饮用水中的浓度限值均为10 ng/L;德国也规定饮用水中亚硝基二甲胺(NDMA)和N-亚硝基吗啉(NMOR)的健康标准不得超过10 ng/L;而加拿大安大略省环境部则更为严格,规定 NDMA 的饮用水水质标准为 9 ng/L[3]。因此,检测饮用水中痕量亚硝胺类物质,对评价饮用水水质、保证水源安全具有重要意义。
笔者建立了超高效液相色谱-三重四极杆质谱联用法快速测定饮用水中亚硝胺类物质的方法,以更好地助力进一步研究去除和控制饮用水中亚硝胺类物质含量,保证饮用水安全。
1 实验试剂与仪器
1.1 8种亚硝胺物质的基本信息
研究中涉及检测的亚硝胺类组分见表1。

表1 8种亚硝胺类物质的基本信息
1.2 仪器和试剂
液相色谱/质谱联用仪(LC-MS /MS)Waters Xevo TQ-XS 超高效液相色谱-串联质谱仪,包含自动进样系统、超高效液相色谱仪、三重四极杆串联质谱仪并配有大气压化学电离源(atmospheric pressure chemical ionization,APCI)。
仪器软件:Masslynx 4.1软件(Waters)用于仪器控制、数据采集和结果分析。
液相色谱柱:ACQUITY UPLC HSS T3 100 mm,内径 2.1 mm,粒径 1.8 μm。
固相萃取装置:全自动或手动的固相萃取装置均可,本文使用手动固相萃取仪。
浓缩蒸发装置:TTL-DC II氮吹仪。
固相萃取小柱:CNWBOND Cocount Charocal(椰子壳活性炭)2 g,6 mL。
9种N-亚硝胺混标,2 000 mg/L 甲醇溶液;二氯甲烷、甲醇、甲酸,均为色谱纯; Milli-Q 超纯水,15 MΩ·cm;高纯氮气,纯度>99.9%。
1.3 仪器参数设置
液相色谱条件:流动相由甲醇(流动相A)和0.1%的甲酸溶液(流动相B)组成,流速为0.3 mL/min,进样量为10 μL,色谱柱温度为45℃。流动相梯度:2.5% A保持2 min,随后1 min内提高A的比例至50%并保持1 min,然后在0.5 min内升至80%,接着在2.5 min内升至97.5%,最后在0.1 min内降至2.5%,整个程序共6.5 min。
质谱条件:大气压化学电离源正离子模式(APCI),毛细管电压3.1 kV;离子源温度,150℃;脱溶剂气流量,500 L/h;锥孔气(氮气)流量,180 L/h;碰撞气流量,0.15 mL/min。
1.4 实验步骤
1.4.1样品采集
采用硬质棕色磨口玻璃瓶采集水样,预先按每升水 80~100 mg 的比例加入固体过硫酸钠,脱去水样中活性氯。水样应充满样品瓶并加盖密封,4℃以下冷藏,避光保存,尽快检测[4]。
1.4.2N-亚硝胺标准溶液的配制
采用外标法绘制标准曲线,以二氯甲烷为溶剂,采用购买的标品梯度稀释得到 9 种 N-亚硝胺标准溶液,配制浓度依次为 5,10,20,50,100和200 μg/L。
1.4.3样品前处理
准确量取1 L水样,采用固相萃取的方法对样品进行处理,在使用固相萃取小柱萃取之前,依次用 6 mL二氯甲烷、12 mL甲醇和15 mL超纯水活化椰壳柱。水样以3~5 mL/min 的速率通过活化后的椰壳柱。水样上样完毕后,进行真空抽干120 min。随后,使用二氯甲烷进行洗脱,每次4 mL,共洗脱3次。洗脱过程中,洗脱液应自然滴落。收集洗脱液,使用氮吹仪在35℃下对洗脱液进行浓缩,最后用二氯甲烷定容至0.5 mL,上机进样。
2 结果与讨论
2.1 质谱采集条件的确认
在实验初期,选用电喷雾电离源(ESI)与大气压化学电离源(APCI)进行质谱参数摸索对比。NDMA、NMEA等分子量较小、挥发性强的物质,在ESI下的响应不及APCI。因此,最终确定用APCI进行检测。通过质谱方法优化,最终确定8种物质的锥孔电压、碰撞能级以及定量离子见表2。

表2 8种亚硝胺类物质的质谱采集条件
注:*为定量子离子。
2.2 方法检出限与精密度
实验条件下,8种亚硝胺类化合物的线性范围为 5.0~200 μg/L。结果表明,8种N-亚硝胺有良好的线性关系且3次数据的平行性较好,其线性回归方程、线性相关系数、最低检出限如表3所示。
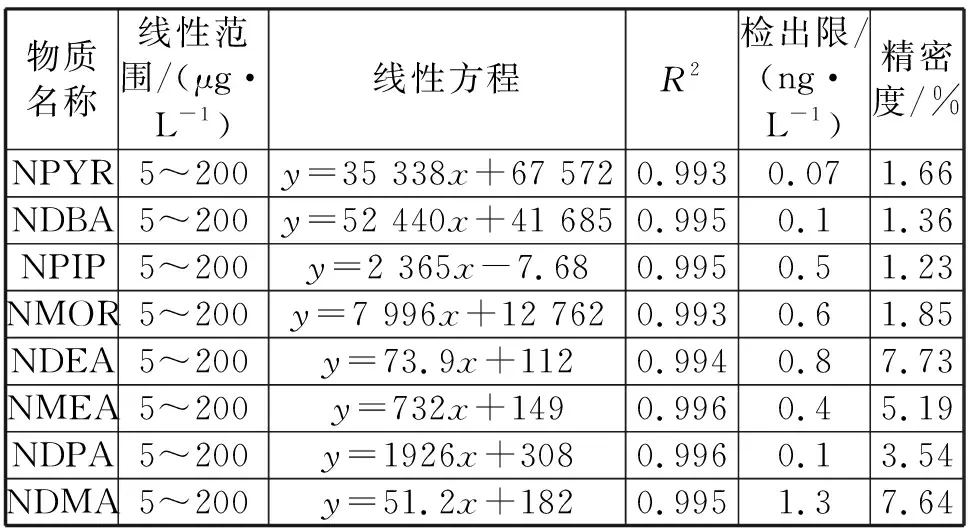
表3 8种亚硝胺类物质的线性方程和检出限
8种N-亚硝胺线性相关系数R2为0.993~0.996,最低检出限为 0.07~1.3 ng/L,仪器精密度均在10%以内。
2.3 样品前处理优化
2.3.1萃取柱克数的选择
经试验证明,8种亚硝胺在椰壳柱上都能被保留,使用1 mg固相萃取柱与2 mg固相萃取柱的回收率(n=6)见表4。结果表明,在进行25 和50 ng/L的水样回收时,绝大多数物质使用2 mg固相萃取柱的回收率优于1 mg固相萃取柱,因此最终确定使用2 mg固相萃取柱。
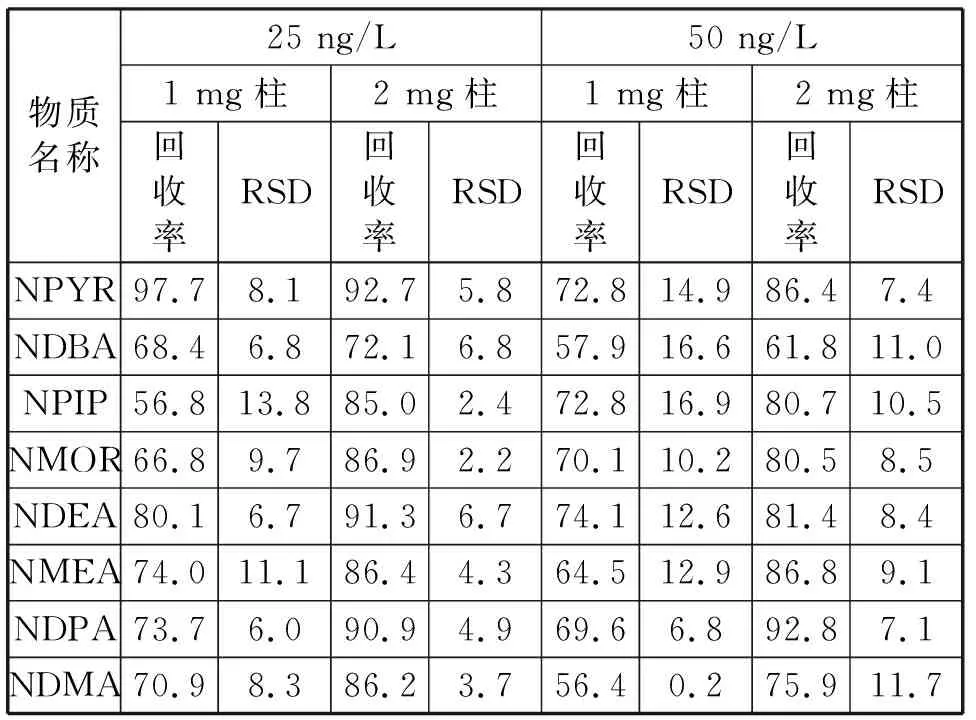
表4 纯水中8种亚硝胺类物质在不同质量椰壳柱下的回收率 %
2.3.2样品 pH 条件的确定
为了确定水样pH对回收率的影响,试验分别用盐酸溶液和碳酸钠溶液调节水样的pH值。在酸性(pH=3) 、近中性(pH=6)和碱性(pH=8)水样条件下,对浓度为 20.0 μg/L的6份加标水样使用固相萃取方法萃取,萃取液经浓缩后测定。结果表明,3种pH下8种物质的回收率均在80%~110%之间,所以最终选择不调节水样pH直接进行固相萃取。
2.3.3曲线配制及定容试剂的选择
选择二氯甲烷、水、甲醇作为基质配制曲线进行对比,发现采用水作为基质时,NDPA在低浓度点的响应不好;采用甲醇作为基质时,甲醇对NDMA、NDEA两种物质响应有影响,NDMA在甲醇基质下不能出峰;采用二氯甲烷配线时,各种物质在曲线浓度最低点响应相对较好。因此选择二氯甲烷作为配制曲线的试剂。
分别用二氯甲烷和纯水作为定容溶剂进行试验,结果相差不大。考虑到配制溶剂与前处理洗脱、定容溶剂的一致性,最终选择二氯甲烷作为定容试剂。
2.3.4吸附流速、抽干时间及浓缩倍数的选择
在真空泵压力为400 mbar时,选择0.5,1 和1.5 h作为固定的抽干时间进行回收率对比,发现0.5 及1 h停止抽干后洗脱,洗脱后得到的液体依然混有水份,不利于定容与检测。1.5 h停止抽干后洗脱得到的回收率较好,因此将抽干时间定为1.5 h。
水样流速会影响亚硝胺在椰壳柱上的保留,流速太快会导致吸附保留效果不佳。笔者根据有机检测固相萃取的富集经验与相关文献报道,选择样品上柱流速在3~5 mL/min[5]。
根据已有研究,将水样体积定为1 L,选择将水样浓缩1 000,2 000和5 000倍进行对比,即定容体积分别为 1,0.5和0.2 mL,结果发现对实验影响不大。为了提高灵敏度,更好地分析水中痕量的亚硝胺类物质,结合定容体积对回收率平行性的影响,最终选择浓缩倍数为2 000倍,即1 L水样应浓缩定容至0.5 mL。
2.3.5浓缩条件的选择
对比了水浴氮吹不同温度下的回收率,发现在 40℃ 水浴下的回收率低于35℃。由于8种亚硝胺类物质中NDMA、NDEA等具有挥发性,不宜选择过高的温度进行氮吹,以免造成损失,因此最终确定35℃进行氮吹。
2.4 不同浓度下的回收率及精密度的测定
对8种N-亚硝胺类物质进行10.0,50.0和100 μg/L 的加标回收实验(n=6),其回收率结果见表5。除NDBA的回收率在70%以下,其余回收率均在 70%~110%内。RSD不大于15%,精密度良好。说明本方法的适用性较好,可以满足实际水体中N-亚硝胺的检测要求。

表5 8种亚硝胺类物质在不同添加水平下的回收率和精密度 %
2.5 其余亚硝胺类物质的摸索性研究
在进行8种亚硝胺类物质检测方法开发的同时,对N-亚硝基二苯胺(NDPhA)进行了仪器检测方法摸索。该物质的质谱响应较好,仪器检出限能达到2.65 μg/L,但在进行前处理方法摸索时发现其不能通过本文提及的固相萃取方式进行回收。因此,该物质不能运用本文的前处理富集方式进行固相萃取回收,可以考虑直接水样上机进行检测。
3 结论
通过优化前处理条件,利用APCI源,建立了水中常见的8种亚硝胺类物质的固相萃取-超高效液相色谱-串联质谱检测法,该方法具有灵敏度高、适用性好等优点。下一步,应考虑采用此方法对实际样品中亚硝胺类消毒副产物进行检测,讨论饮用水中亚硝胺消毒副产物含量与消毒方式之间的相关性,为降低水中亚硝胺的含量的研究提供支持。
