马尾松人工林土壤有机层和矿质土壤层酶活性随雨旱季的变化
2022-10-27杨万勤
曹 瑞, 杨万勤,*,袁 吉, 李 晗, 谭 波
1 台州学院生命科学学院,台州 318000 2 四川农业大学生态林业研究所,成都 611130
土壤酶是土壤生物化学过程的积极参与者,既能将大分子物质降解为小分子物质,又能参与腐殖质的形成,在植物残体分解、土壤有机质形成和养分转化等方面发挥着重要的作用[1],是土壤生产力维持与提高的关键。同时,土壤酶能敏感地响应生物与非生物环境因子的轻微变化,其活性变化能综合反映土壤生物化学过程对气候变化、土壤理化性质和土壤生物群落的响应[2—3]。然而,已有的相关研究更多地集中在矿质土壤层,而土壤有机层酶活性动态的研究相对较少[4—5]。土壤有机层是指累积在土壤表面未分解到完全分解的有机残余物质,是土壤与植被之间进行物质转换和能量交换最为活跃的生态界面之一,在土壤有机碳固定、物质循环和养分有效性等方面具有十分重要的作用[6]。有研究表明,土壤有机层酶活性显著高于矿质土壤层[7—9],由于土壤有机层直接暴露在地表,其受到环境因子波动的直接影响更强烈。因此,土壤有机层酶活性对周期性环境变化的响应可能更敏感,其响应机制也可能不同于矿质土壤层,但相关机制尚待深入研究。
迄今,土壤酶活性的季节性变化已有大量研究报道[10—13],并认为土壤温度和湿度是驱动土壤酶活性季节性变化的关键因子[12,14—15]。例如,Puissant等[16]研究表明,降雨减少和增温降低了土壤含水量,抑制土壤微生物生物量,导致夏季土壤酶活性的降低。Kang等[17]研究发现,春季较高的土壤脱氢酶和脲酶活性以及秋季较高的磷酸酶和芳基硫酸酯酶活性是由林地土壤温度和养分有效性决定的。但近期的一些研究则表明,驱动土壤酶活性变化的关键因素是土壤基质质量和pH[18—21]。这些不确定性可能是因为性质迥异的土层(例如土壤有机层和矿质土壤层)对环境因子的响应存在较大差异,也可能是土壤酶活性对降水等环境因子的响应很敏感,仅仅关注土壤酶活性的季节或者月动态不能反映酶活性的环境敏感性。理论上,土壤有机层和矿质土壤层可能具有明显不同的微生物、水热和养分有效性动态,从而使土壤酶活性对季节性环境因子变化的响应存在分异,进而影响土壤生物地球化学循环。因此,深入研究土壤有机层和矿质土壤层酶活性随关键时期的变化,有助于识别主导酶活性动态的关键因子,有利于理解土壤生物化学循环对环境变化的潜在响应。
长江上游低山丘陵区属于典型的亚热带季风气候,降雨季节和干旱季节明显,全年降水主要集中在夏秋两季,具有极为明显的雨热同期现象[22]。马尾松(Pinusmassoniana)是本区的主要造林树种,在林业生产和生态建设中具有举足轻重的地位[23]。因此,深入研究马尾松人工林土壤酶活性随关键时期的变化特征及其主要驱动因子,可为马尾松人工林可持续经营与管理提供科学依据。然而,已有的土壤酶活性研究更多关注矿质土壤层,有关土壤有机层和矿质土壤层的酶活性随不同关键时期环境因子变化的变化尚缺乏深入研究。为此,本文以长江上游低山丘陵区的宜宾高县马尾松人工林为研究对象,采用原位土柱培养法,同步研究了土壤有机层和矿质土壤层中与碳氮磷循环密切相关的转化酶、脲酶和酸性磷酸酶活性随关键时期的变化特征,揭示驱动土壤有机层和矿质土壤层酶活性动态的关键因子。
1 材料与方法
1.1 样地设置
研究区域位于宜宾市高县境内(104°32′—104°33′E,28°34′—28°35′N),地处长江上游低山丘陵区,地貌以低山丘陵为主,海拔高度400—500 m。气候类型属亚热带湿润季风气候,雨热同期特征明显,年平均温度约为18℃,最高月均温(7月)为36.8℃,最低月均温(1月)为7.8℃,年降水量850—1200 mm,相对集中于5—10月[24]。
研究样地布设于来复镇毛巅坳林区的马尾松人工林,其主要伴生树种为香樟(Cinnamomumcamphora),林下灌木主要是梨叶悬钩子(Rubuspirifolius)、枹栎(Quercusserrate)、油樟(Cinnamomumlongepaniculatum)等。林下草本植物主要包括金星蕨(Parathelypterisglanduligera)、芒(Miscanthussinensis)、芒萁(Dicranopterisdichotoma)等。土壤为黄壤,基本特性详见表1。
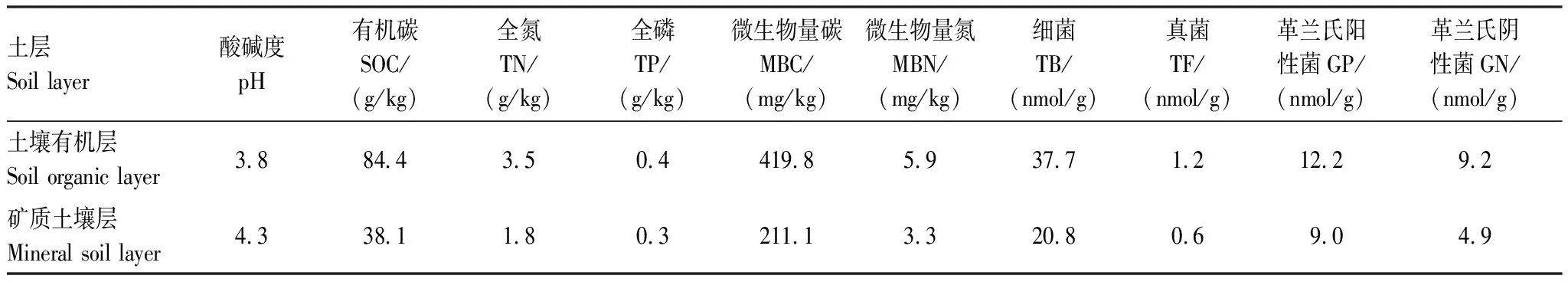
表1 土壤有机层和矿质土壤层土壤基本特性
1.2 实验设计
在研究样地内选择3个间距约为100 m、长宽为10 m、面积为100 m2,且坡度、坡向和地表植被类型相似的平行样方。在去除地表新鲜凋落物和地表植被后,采用直径11 cm、高30 cm的PVC管垂直打入土壤采集具有完整土壤有机层和矿质土壤层的土柱。在不破坏柱内土壤结构的情况下取出土柱,立即使用0.2 mm的尼龙网布封住土柱上下两端,随后将保持相对完好的土柱集中培养在同一样地中环境条件一致的地方,以避免森林环境异质性对土柱内土壤酶活性的影响。2013年9月样地布设完毕,待实验干扰降低后,于2014年6月开始采集样品,持续三年。实验期间,根据高县多年降水资料和研究团队前期研究结果为参考[22,25],并结合我国农历24节气,将采样时间确定为雨季早期(Early rainy season,ERS,6月6日)、雨季中期(Mid rainy season,MRS,10月8日)、雨季末期(Late rainy season,LRS,12月6日)、旱季早期(Early dry season,EDS,3月5日)和旱季末期(Late dry season,LDS,4 月5日)等5个关键时期。
1.3 土壤采集与测定
依照实验设计,确保采样时间误差不超过正负一周的前提下,在每个样方随机采集3根土柱并按土壤有机层和矿质土壤层分别混合,每次采集6份土壤样品(2土层×3样方)。土壤样品通过低温保存箱迅速带回实验室,过2 mm分样筛后,一部分风干密封保存,一部分用自封袋密封保存于4℃冰箱测定土壤酶活性。
土壤酶活性测定参照关松荫的研究方法进行改进[26]。转化酶活性采用3,5-二硝基水杨酸比色法测定,用1g干土在37℃下24h水解产生葡萄糖的毫克数表示;脲酶活性采用靛酚蓝比色法测定,用1g干土在37℃下24h水解产生铵氮的毫克数表示;酸性磷酸酶活性采用比色法测定,用1g干土在37℃恒温培养条件下,24h释放的苯酚量来计算。
土壤微生物生物量碳和氮采用改进的氯仿熏蒸-K2SO4浸提方法测定[27];土壤微生物磷脂脂肪酸含量通过对总脂质进行单相萃取后测定[28]。土壤pH(土水比为1∶2. 5)采用pH计测定。土壤有机碳含量采用重铬酸钾加热法测定,全氮含量采用凯氏定氮法测定,全磷含量采用钼锑抗比色法测定[29]。此外,土壤含水量通过称取10g新鲜土样烘干至恒重,用水分重量占1g干土的百分比来表示;土壤温度采用埋设纽扣式温度记录器(DS1923-F5 iButton,Maxim Integrated Products, Inc., Sunnyvale, CA, USA)每2h记录一次。
1.4 数据处理与统计分析
通过SPSS 20.0软件,采用重复测量方差分析(Repeated Measures ANOVA)检验关键时期、年际、土层及其相互作用对土壤酶活性影响的显著性。基于R(4.0.2),通过ggpubr软件包,采用单因素方差分析(One-way ANOVA)对土壤酶活性不同关键时期的差异显著性进行检验(P=0.05)。通过 SIMCA 14.1软件,采用偏最小二乘法(PLS)评估环境因子对土壤有机层和矿质土壤层酶活性的影响程度和相对重要性。采用ggpplot 2 软件包进行作图。
2 结果与分析
2.1 环境因子随关键时期和年份的变化特征
研究期间,三年的平均降雨量为944.36 mm,降雨主要集中在5—10月,最低的月降水量为7.6 mm,最高的月降水量为282.7 mm;年际间的降雨量无显著差异,但月份之间和季节之间的变化明显。三年的大气相对湿度平均值为81.57%,并无明显的季节差异(图1)。观测样地的土壤温度与大气温度变化相一致,夏季较高,冬季较低。同时,土壤有机层温度波动幅度明显高于矿质土壤层(图1)。土壤含水量均呈下降趋势,且土壤有机层下降幅度显著大于矿质土壤层(图1)。
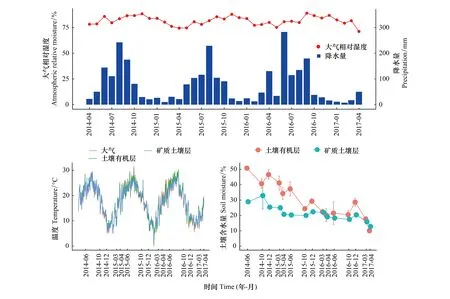
图1 马尾松人工林观测样地的土壤温湿度和大气温湿度动态Fig.1 Dynamics of temperature and moisture in both air and soil in the observational plots of Masson pine plantation
2.2 土壤转化酶活性动态
关键时期、年际、土层及其相互作用均对土壤转化酶活性产生了显著影响(表2)。除第一年外,土壤有机层和矿质土壤层的转化酶活性随关键时期发生了显著变化,其差异显著性取决于培养时间和土层(图2)。土壤有机层转化酶活性在雨季初期(ERS)显著最高,在旱季末期(LDS)显著最低;而矿质土壤层中,第二个培养年的转化酶活性在雨季初期(ERS)和旱季末期(LDS)显著高于其他关键时期,第三个培养年的转化酶活性在雨季初期(ERS)显著最低(图2)。土壤有机层的转化酶活性显著高于矿质土壤层,且随培养年际的增加表现出明显的降低趋势(图2)。
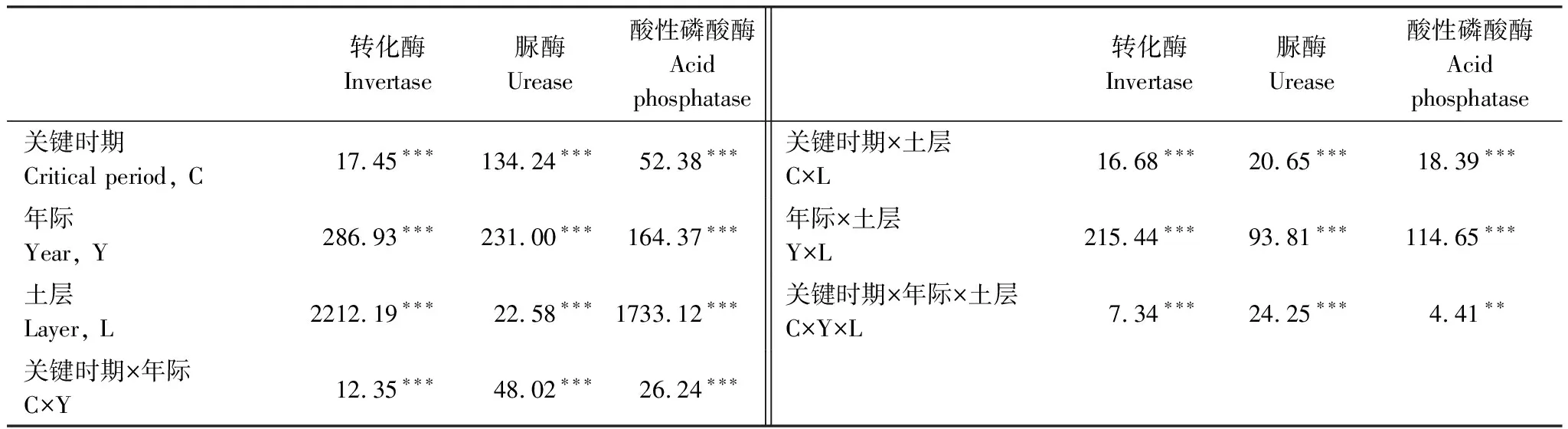
表2 关键时期、年际、土层及其相互作用对土壤酶活性影响的重复测量方差分析
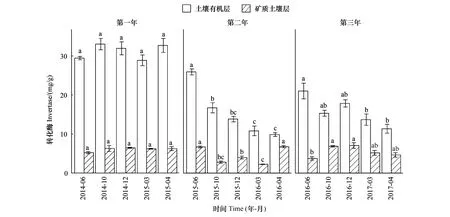
图2 土壤有机层和矿质土壤层转化酶活性随关键时期的变化Fig.2 Change of invertase activities in both soil organic layer and mineral soil layer with critical periods不同字母表示各关键时期在同一年际和土层的差异显著(P<0.05)
2.3 土壤脲酶活性动态
关键时期、年际、土层及其相互作用均对土壤脲酶活性产生了显著影响(表2)。土壤有机层和矿质土壤层的脲酶活性随关键时期均发生了显著的变化,其变化趋势也基本一致(图3)。第一个培养年中,土壤有机层和矿质土壤层脲酶活性在雨季初期(MRS)和雨季末期(LRS)显著高于其他关键时期;第二个培养年中,两层土壤脲酶活性在雨季末期(LRS)显著最高;第三个培养年中,土壤脲酶活性在旱季初期(EDS)显著最低(图3)。土壤有机层和矿质土壤层脲酶活性在第一年显著最高,随培养年际增加有显著降低的变化趋势(图3)。
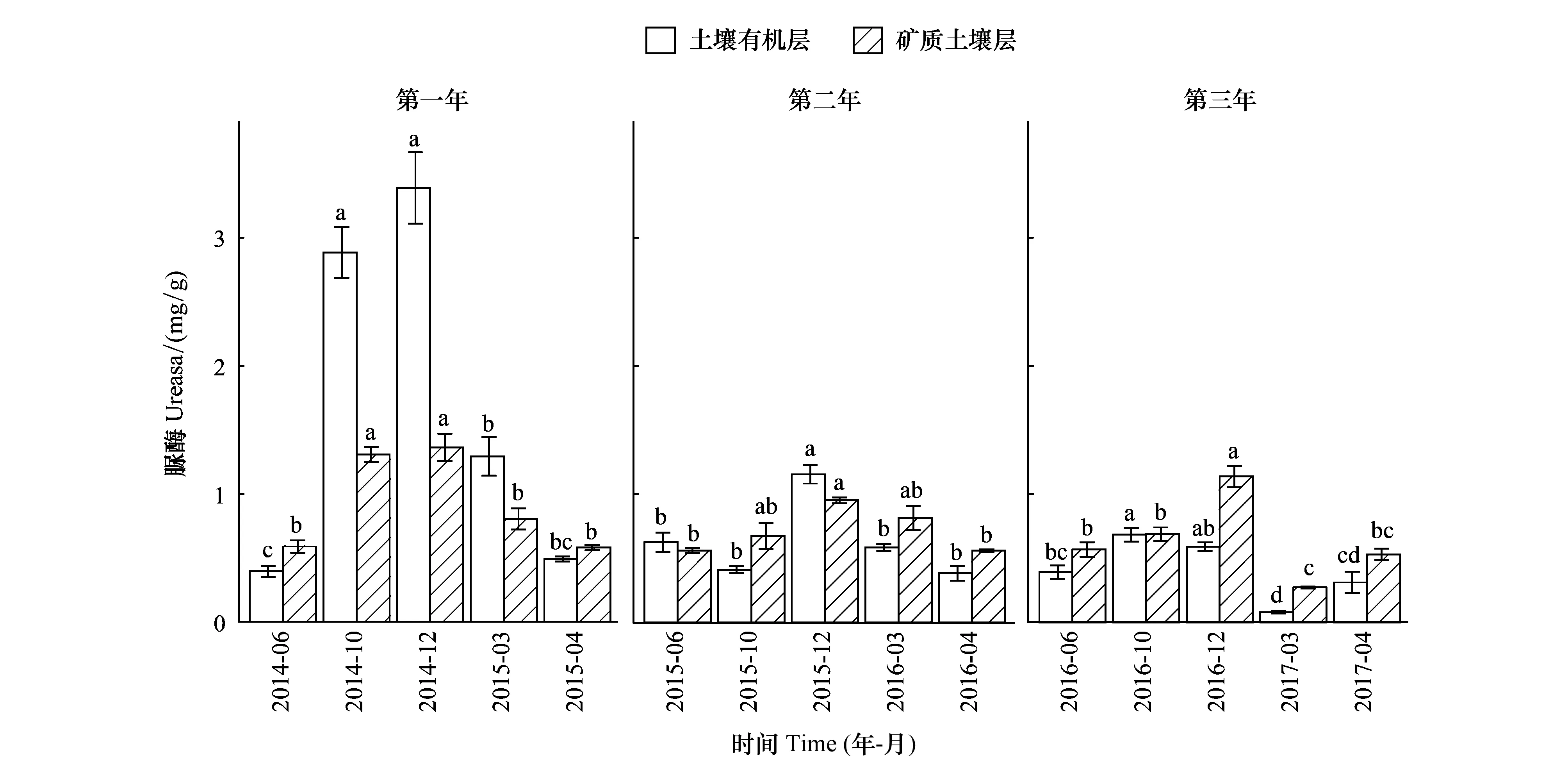
图3 土壤有机层和矿质土壤层脲酶活性随关键时期的变化Fig.3 Change of urease activities in both soil organic layer and mineral soil layer with critical periods
2.4 土壤酸性磷酸酶动态
关键时期、年际、土层及其相互作用均显著影响了土壤酸性磷酸酶活性(表2)。除第三年的矿质土壤层外,土壤酸性磷酸酶活性随关键时期均有显著变化(图4)。第一个培养年中,土壤有机层和矿质土壤层酸性磷酸酶活性均在雨季中期(MRS)显著最高;第二个培养年中,土壤有机层和矿质土壤层酸性磷酸酶活性的显著最低值分别出现在旱季末期(LDS)和雨季初期(ERS);第三个培养年中雨季中期(MRS)和雨季末期(LRS)的土壤有机层酸性磷酸酶活性显著高于其他时期(图4)。土壤有机层酸性磷酸酶活性随培养年际增加无显著变化,而矿质土壤层有显著增加的趋势(图4)。土壤有机层酸性磷酸酶活性总体上显著高于矿质土壤层,土壤有机层酸性磷酸酶活性的变化幅度也略大于矿质土壤层(图4)。
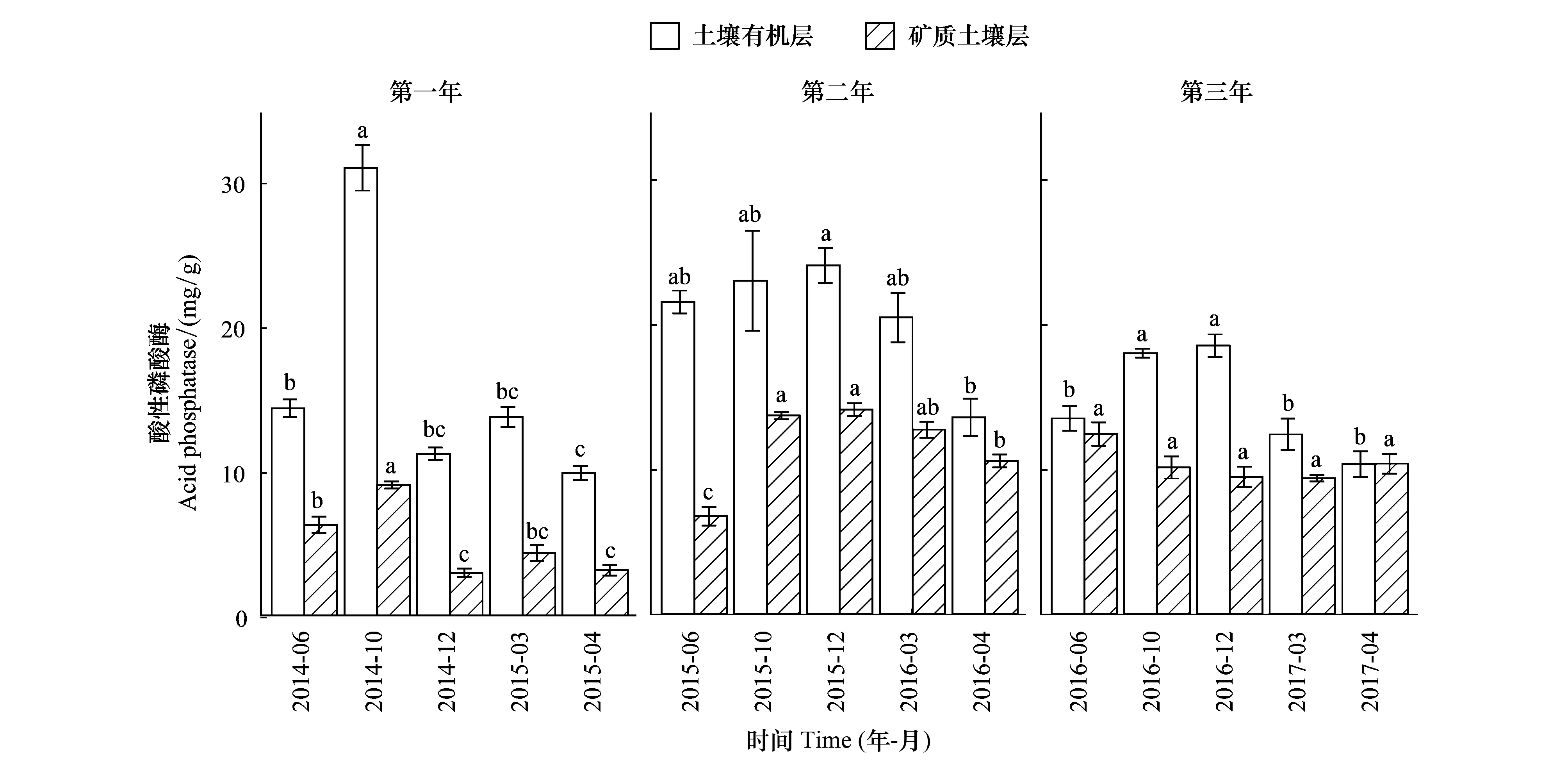
图4 土壤有机层和矿质土壤层酸性磷酸酶活性随关键时期的变化Fig.4 Change of acid phosphatase activities in both soil organic layer and mineral soil layer with critical periods
2.5 土壤酶活性动态的驱动因子
土壤含水量、有机碳和全氮对土壤有机层转化酶活性具有显著的积极影响,土壤全磷则具有显著的消极影响(P<0.05)(图5)。而在矿质土壤层中,土壤微生物量碳、真菌含量、革兰氏阴性菌含量、有机碳和革兰氏阳性菌含量对土壤转化酶具有显著的积极影响(P<0.01),土壤全磷则具有显著的消极影响(P<0.05)(图5)。土壤含水量、微生物量氮、真菌含量、微生物量碳和革兰氏阳性菌含量对土壤有机层脲酶活性具有显著的正向调节作用(P<0.05),土壤全磷则具有显著的负向调节作用(P<0.01)(图5)。土壤含水量、真菌含量、有机碳和微生物量氮对矿质土壤层脲酶活性具有显著的积极影响,土壤全磷则具有显著的负向调节作用(P<0.01)(图5)。土壤微生物量氮、降水量、土壤温度、大气温度和有机碳对土壤有机层酸性磷酸酶活性具有显著的正效应(P<0.01),而在矿质土壤层中,土壤全磷、酸碱度和微生物量氮对其具有显著的正效应(P<0.01)(图5)。此外,研究结果还表明,土壤含水量和土壤微生物量碳分别是土壤有机层和矿质土壤层转化酶活性最重要的影响因素;土壤有机层和矿质土壤层脲酶活性最重要的影响因素均为土壤含水量;土壤微生物量氮和全磷分别是土壤有机层和矿质土壤层酸性磷酸酶活性最重要的影响因素。
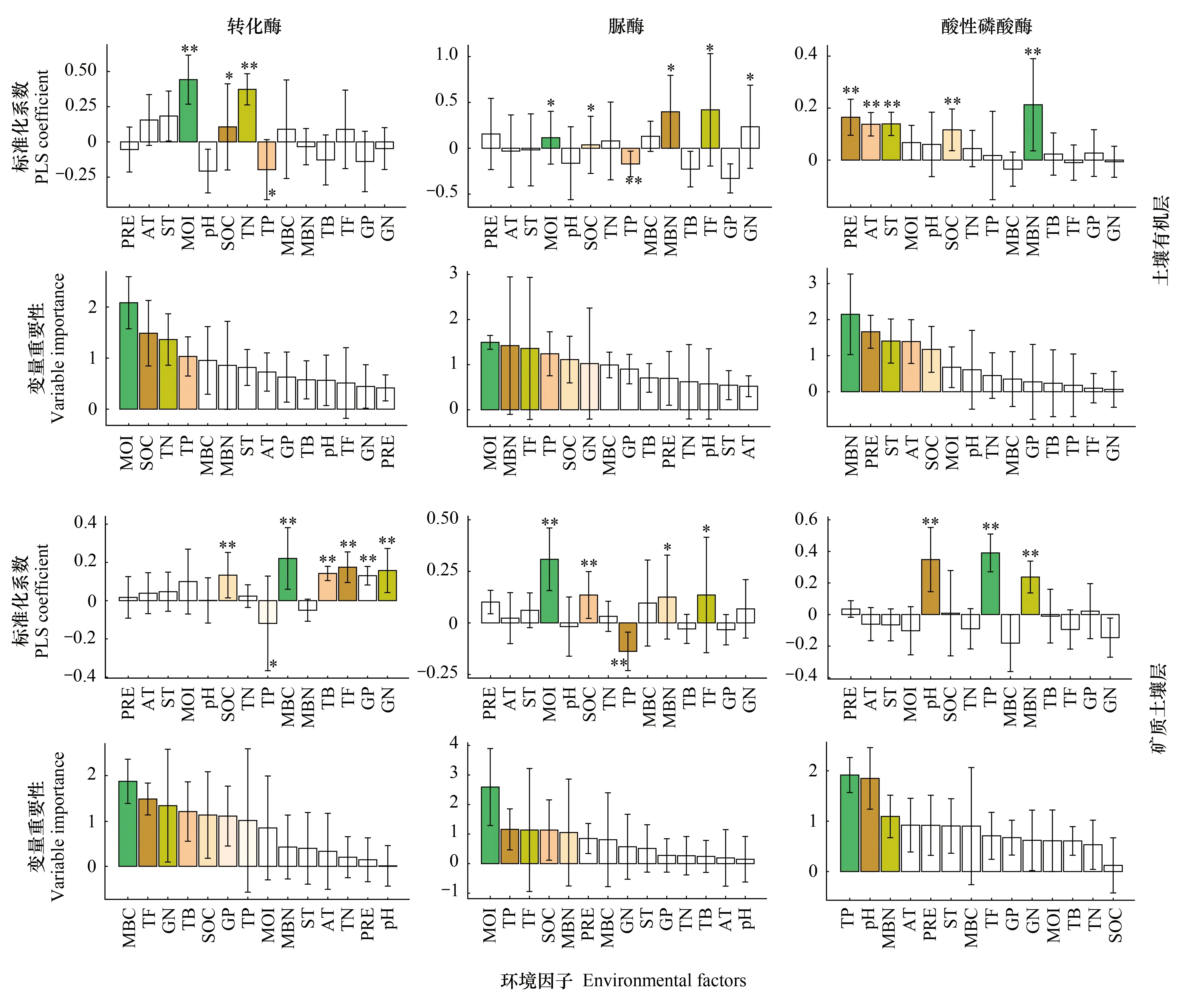
图5 环境因子对土壤有机层和矿质土壤层酶活性影响的偏最小二乘法(PLS)分析结果Fig.5 Results of partial least squares (PLS) analysis testing for the effects of environmental factors on the soil enzyme activity in soil organic layer and mineral soil layer偏最小二乘法标准化系数显示了每个环境因子对土壤酶活性的影响方向和大小,大于1的变量重要性表示其影响显著;PRE:降水量 Precipitation; AT:大气均温 Mean air temperature;ST:土壤均温 Mean soil temperature;MOI:土壤含水量 Soil moisture; SOC:土壤有机碳 Soil organic carbon;TN:全氮 Total nitrogen;TP:全磷 Total phosphorus;MBC:土壤微生物量碳 Microbial biomass carbon;MBN:土壤微生物量氮 Microbial biomass nitrogen;TB:细菌PLFAs含量 Bacteria PLFAs;TF:真菌PLFAs含量 Fungi PLFAs;GP:革兰氏阳性菌PLFAs含量 Gram-positive bacteria PLFAs;GN:革兰氏阴性菌PLFAs含量 Gram-negative bacteria PLFAs
3 讨论
土壤酶活性是环境变化的敏感生物学指标,受到环境因子的综合调控[2];因而环境因子的季节性差异通常会导致土壤酶活性的季节性变化[13,30—31]。本研究表明,土壤有机层和矿质土壤层酶活性均随关键时期显著变化,总体上表现为雨季大于旱季。这与Fan等[32]的研究结果基本一致,他们的研究发现除脲酶以外,转化酶、酸性磷酸酶和纤维素酶等五种酶在雨季活性高于旱季,并认为湿度的增加刺激了微生物和植物根部分泌土壤酶。同时,有研究表明,土壤含水量是主导季节性降水明显区域土壤酶活性动态的关键因子[33—34]。本研究中,多种环境因子对土壤酶活性具有显著影响,但土壤含水量和微生物生物量是驱动土壤酶活性随关键时期发生变化的最关键因素。这主要归因于潮湿的环境有利于微生物的生理活动[35—36],提高微生物同化的效率并延长微生物的活动周期[37],导致较高的微生物生物量分泌更多的酶[38—40];反之,干旱则会显著抑制土壤酶的活性[41—42]。本研究中,马尾松人工林位于亚热带季风区,具有较为明显的干湿季交替特征,易引起土壤含水量和微生物生物量的剧烈变化,最终导致不同关键时期土壤酶活性的剧烈变化。
与此同时,土壤有机层转化酶和脲酶活性随培养年限的增加均有显著降低的趋势。可能的原因是:土柱培养期间,去除新鲜凋落物减少了有机质输入,并改变了土壤水热条件、底物有效性和微生物量,从而降低了相关土壤酶活性[43—45]。一方面,去除新鲜凋落物增加了土壤有机层水分蒸发,显著降低了土壤含水量,从而强化了土壤含水量对土壤酶活性的正向调节作用。另一方面,去除新鲜凋落物阻断了土壤碳氮的主要来源,致使土壤转化酶和脲酶活性受底物限制而显著降低[46]。然而,不同于土壤有机层转化酶的变化特征,矿质土壤层转化酶活性随年际的变化幅度相对稳定。这主要是由于矿质土壤层土壤含水量、有机碳及养分含量显著低于土壤有机层,限制了土壤微生物分泌土壤酶[31,47],使土壤酶活性长期维持在较低水平。同时,矿质土壤层生化特性对环境变化的响应比土壤有机层更迟钝[6],使其具有较强的稳定性并导致土壤酶活性的变化幅度明显小于土壤有机层。此外,本研究表明,矿质土壤层酸性磷酸酶活性随培养年限的增加呈现出增加趋势,且土壤全磷是其变化最主要调控因素。这可能是因为酸性磷酸酶主要参与土壤磷的生物化学过程,而土壤磷元素主要受母岩和土壤淋溶过程的影响[24,48—49]。
总体而言,土壤酶活性随关键时期和年际的变化受到土壤层次和酶种类的控制,主要与环境因子对土壤酶活性的影响程度的显著差异有关。偏最小二乘分析结果表明,土壤含水量、微生物量和底物含量对土壤酶活性具有显著影响。其中,土壤含水量和土壤微生物量碳分别是土壤有机层和矿质土壤层转化酶活性最重要的影响因素;土壤有机层和矿质土壤层脲酶活性最重要的影响因素均为土壤含水量;土壤微生物量氮和全磷分别是土壤有机层和矿质土壤层酸性磷酸酶活性最重要的影响因素。此外,土壤微生物各类群仅在矿质土壤层对土壤转化酶活性具有显著的正效应,这与土壤微生物各类群组成与多数土壤酶具有显著相关性的研究结果并不完全一致[50—51]。推测土壤微生物类群对土壤酶的调控作用可能被土壤水分或总生物量等因子限制,但相关机制有待进一步研究。同时,本研究没有发现温度对土壤酶活性的显著影响,也与温度显著影响土壤酶活性的研究结果不一致[52—53],这可能是因为亚热带地区土壤酶活性的温度敏感性较低[54]。值得注意的是,本研究只发现土壤pH与矿质土壤层酸性磷酸酶活性显著相关,这与土壤pH是影响土壤酶活性的重要因素的研究结果不一致[55—57]。这可能是因为微环境尺度上土壤pH季节和年际变化小,为土壤酶提供了相对稳定的酸碱环境,对土壤酶活性的影响被削弱;另一方面是因为土壤pH是土壤酶活性空间分异的主要驱动因子[4],其对土壤酶活性空间分布的影响要强于对时间动态的影响。
4 结论
马尾松人工林土壤酶活性随关键时期和年际的变化显著,其变化幅度和差异显著性受土壤层次和酶的种类的限制。土壤有机层转化酶和酸性磷酸酶活性显著高于矿质土壤层。土壤有机层三种酶活性随关键时期的变化幅度和随年际的变化幅度均高于矿质土壤层。土壤含水量、土壤微生物量和底物含量是马尾松人工林土壤酶活性的主要调控因子。其中,土壤含水量和土壤微生物量碳分别是土壤有机层和矿质土壤层转化酶活性最重要的影响因素;土壤有机层和矿质土壤层脲酶活性最重要的影响因素均为土壤含水量;土壤微生物量氮和全磷分别是土壤有机层和矿质土壤层酸性磷酸酶活性最重要的影响因素。
