自拟补肾祛瘀方对多囊卵巢综合征模型大鼠的作用及机制研究*
2022-10-27牛永莉王艳孔丽谢广妹
牛永莉,王艳,孔丽,谢广妹
(1.酒泉市人民医院 生殖医学科,甘肃 酒泉 735000;2.甘肃省妇幼保健院 生殖中心,甘肃 兰州 730050)
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)为育龄女性常见病,发病率约8%[1]。PCOS 是一种生殖功能障碍与糖代谢异常并存的内分泌紊乱综合征,目前认为与雄激素及促黄体生成素异常、胰岛素抵抗等多种因素有关[2]。PCOS 属中医“闭经”“不孕”范畴,以肾功能失调为本,痰浊、血淤为标,中医治疗宜补肾为主,祛瘀为辅[3]。以往研究表明[4],中医治疗PCOS 费用低廉、不良反应少且无绝对用药禁忌,在PCOS 的临床治疗中受到重视。研究认为[5],PCOS 的发生与肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)介导的核因子κB(nuclear factor κB, NF-κB)/核因子IκB(inhibitor of NF-κB,IκBα)信号通路激活有关。其中,NF-κB 有多项调控功能,调控TNF-α/NF-κB/IκBα 信号通路可成为PCOS 防治的新靶点,但目前相关的研究较少。本研究采用自拟补肾祛瘀方治疗PCOS 并分析其对TNF-α/NF-κB/IκBα 信号通路的影响,以期明确其治疗PCOS 的可能作用机制,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物80 只SPF 级SD 雌性大鼠,6 周龄,体重(180±10)g[由中国科学院上海药物研究所提供,实验动物生产许可证号:SCXK(沪)2020-0005]。喂养条件:温度20℃、湿度50%,每日喂新鲜水及饲料。
1.1.2 实验试剂和药物TNF-α 抗体、NF-κB(P65)抗体及IκBα 抗体(英国Abcam 公司),鼠抗人β-actin(生工生物工程上海股份有限公司),羊抗鼠二抗、DAB 显色试剂盒(武汉博士德生物工程有限公司),SYBP®Premix Ex TaqTM(日本TaKaRa 公司),PCR 引物(宝生物工程大连有限公司),TRIzol(美国英杰生命技术有限公司),TBST 试剂(上海科拉曼试剂有限公司)。补肾化瘀方(酒泉市人民医院中医药剂室配置),达英-35(拜耳医药保健有限公司),来曲唑(大连美仑生物技术有限公司),羧甲基纤维素钠、水合氯醛、0.9%氯化钠溶液(北京博尔迈生物技术有限公司)。
1.1.3 实验仪器台式高速离心机(美国Sigma 公司),电泳仪(美国BIO-RAD 公司),实时荧光定量PCR 仪、PCR 扩增仪、恒温箱(美国Thermo 公司),显微镜(日本奥林巴斯株式会社),酶标仪(美国Benchmark 公司),血糖仪(德国罗氏诊断有限公司)。
1.2 方法
1.2.1 模型复制80 只大鼠随机分为对照组20 只、模型复制组60 只。采用来曲唑法复制模型:来曲唑灌胃1 mg/(kg·d),连续28 d,模型复制组给予高脂高糖饲料和9%葡萄糖水。模型复制成功后分为模型组、西药组及联合组,每组20 只。
1.2.2 药物干预对照组和模型组根据大鼠体重给予1 mL/(kg·d)氯化钠溶液灌胃,参考《中药药理研究方法学》[6]换算用药剂量。自拟补肾祛瘀方组成:女贞子、墨旱莲各15 g,菟丝子、山茱萸、丹参、川芎、赤芍、桃仁、红花各10 g,由医院中医药剂室加水煎煮成汤剂,汤剂终浓度为1 g/mL。联合组每天根据体重给予补肾祛瘀汤剂11 g/kg 和4.5 mg/kg 二甲双胍灌胃,西药组仅给予4.5 mg/kg 二甲双胍灌胃,联合组与西药组均灌胃28 d。
1.2.3 大鼠体重检测药物干预前及药物干预28 d 后称量各组大鼠体重,比较药物干预前后大鼠体重变化。
1.2.4 大鼠性激素水平检测大鼠于16 周龄、动情间期当晚20 点开始禁食,至次日早晨8 点空腹取腹主动脉血5~8 mL,3 500 r/min离心15 min,取上清液,置入-20℃冰箱冷冻保存待测。参照放射免疫法试剂盒说明书测定睾酮(T)、促卵泡激素(FSH)、黄体生成素(LH)的水平。抽血称重后采用脊椎脱臼法处死所有大鼠,取大鼠卵巢组织待测。
1.2.5 Western blotting检测大鼠卵巢组织中TNF-α、NF-κB、IκBα 蛋白相对表达量剪碎30 mg 卵巢组织,加1 mL PBS,10 000 r/min、4℃下离心1 min,洗净组织上的血污及黏液等。加300 μL 蛋白裂解液,研磨后置于冰上20 min 至细胞裂解。12 000 r/min、4℃下离心15 min,所得上清液即为全蛋白提取液,置于-80℃冷冻保存备用。提取蛋白液,电泳、转膜、封闭,取出PVDF 膜放入TBST 中漂洗3 次,分别加入TNF-α 抗体、NF-κB(P65)抗体、IκBα 抗体及鼠抗人β-actin,震荡过夜。取出膜,放入TBST 中漂洗3 次后置于二抗中震荡2 h。放入TBST 中漂洗3 次,滴加显色液,紧密结合膜蛋白面与胶片,强曝光5 min 左右,用Image Quant 350 成像系统扫描并保存图像,分析TNF-α、NF-κB、IκBα 蛋白相对表达量。
1.2.6 实时荧光定量聚合酶链反应(qRT-PCR)检测大鼠卵巢组织中TNF-α、NF-κB、IκBα mRNA 相对表达量洗净研钵等器皿,用双蒸水和焦碳酸二乙酯水分别冲洗,于180℃下烘烤4 h 去除RNA 酶。切取50~100 mg 组织在研钵中研磨成粉,将粉末移至无RNA 酶的EP 管中,加1 mL TRIzol 后混匀。静置5 min 后加入氯仿200 μL,震荡15 s 混匀,静置5 min,4℃下离心15 min。待EP 管中液体分层后,用100 μL 移液枪将上层液体吸到新的无RNA酶的EP 管中,并加入等体积异丙醇,混匀后静置10 min 并再次离心10 min。EP 管底部白色物质即为RNA,倒掉管中液体后加入1 mL 75%乙醇,颠倒EP 管数次,离心5 min。倒掉上清液,用移液枪吸净管底液体,静置5 min 干燥。加入30~50 μL DEPC 水并用移液枪吹打使RNA 充分溶解。取2 μL总RNA,凝胶电泳检测完整性。各组大鼠总RNA 的电泳图中可见明显2 个条带,根据迁移率分别是18 S 和28 S,且电泳图中无明显杂带和向前拖尾的现象,说明RNA 提取成功,完整性较高,纯度满足后续PCR 扩增要求。参照TaKaRa试剂盒说明书配制逆转录体系20 μL(5×PrimeScriptTMBuffer 4 μL、Total RNA 4 μL、RNase Free dH2O 12 μL),37℃15 min,85℃5 s,4℃30 min 获取cDNA。qRT-PCR 反应条件:95℃预变性30 s,95℃变性5 s,95℃退火5 s、60℃延伸30 s,40 个循环,循环结束后95℃延伸15 s。引物序列:①TNF-α:正向5'-TCTCTTCAAGGGACAA GGCT-3',反 向5'-TCCTGGTATGAAATGGCAAA-3',引物长度78 bp;②NF-κB:正向5'-GCCTCATCCAC ATGAACTTG-3',反向5'-CGCTTCTTCACACACTGG AT-3',引物长度120 bp;③IκBα:正向5'-CTGTACG CCCCAGCATCT-3',反向5'-GCACCCAAAGTCACCAA G-3',引物长度144 bp;④β-actin:正向5'-CGGTCA GGTCATCACTATCG-3',反向5'-TTCCATACCCAGGA AGGAAG-3',引物长度79 bp。以β-actin 为内参,计算各组ΔΔCt,ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=ΔCt实验组-ΔCt对照组。目的基因相对表达量用2-ΔΔCt表示。
1.2.7 免疫组织化学检测大鼠卵巢组织中TNF-α、NF-κB、IκBα 蛋白阳性表达卵巢组织常规固定、石蜡包埋、切片(厚度4 μm),脱蜡止水,5%的牛血清白蛋白封闭10 min。滴加一抗后4℃下过夜;滴加二抗后37℃下孵育20 min。苏木精复染2 min,脱水后常规透明、封片,显微镜下拍照,取5 个不同高倍镜视野,IPP 6.0 软件分析图像,记录阳性细胞平均光密度(OD)值,取3 次平均值作为最终结果,OD 值越高表示阳性表达率越高。阳性判定:TNF-α、NF-κB、IκBα 以细胞核中可见棕黄或棕褐色颗粒为阳性表达。
1.3 统计学方法
数据分析采用SPSS 19.0 统计软件,计量资料以均数±标准差(±s)表示,比较采用方差分析,进一步两两比较采取LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠药物干预前后体重比较
各组大鼠药物干预前体重比较,差异无统计学意义(P>0.05)。各组大鼠药物干预28 d 后体重比较,差异有统计学意义(P<0.05);进一步两两比较,模型组的体重高于另外3 组(P<0.05),西药组高于联合组和对照组(P<0.05),联合组高于对照组(P<0.05)。见表1。
表1 各组大鼠药物干预前及药物干预28 d后的体重比较(n=20,g,±s)

表1 各组大鼠药物干预前及药物干预28 d后的体重比较(n=20,g,±s)
注:①与模型组比较,P <0.05;②与西药组比较,P <0.05;③与对照组比较,P <0.05。
药物干预28 d后210.78±10.33①②231.16±15.17 225.65±13.02①219.32±11.62①②③5.150 0.003组别对照组模型组西药组联合组F 值P 值药物干预前190.54±8.11 189.18±9.13 188.69±10.14 190.88±10.52 0.245 0.865
2.2 各组大鼠血清性激素水平比较
各组大鼠血清T、FSH、LH 水平比较,差异有统计学意义(P<0.05);进一步两两比较,模型组血清T、FSH、LH 水平高于另外3 组(P<0.05),西药组高于联合组与对照组(P<0.05),联合组高于对照组(P<0.05)。见表2。
表2 各组大鼠血清性激素水平比较 (n=20,±s)

表2 各组大鼠血清性激素水平比较 (n=20,±s)
注:①与模型组比较,P <0.05;②与西药组比较,P <0.05;③与对照组比较,P <0.05。
LH/(mIU/mL)34.51±6.78①②47.15±11.63 43.12±10.97①39.22±7.56①②③6.512 0.001组别对照组模型组西药组联合组F 值P 值T/(ng/dL)11.91±2.26①②17.5±5.76 15.87±4.98①13.66±4.21①②③5.999 0.001 FSH/(mIU/mL)9.94±2.82①②14.79±4.63 13.08±3.99①11.71±3.41①②③6.343 0.001
2.3 各组大鼠TNF-α、NF-κB、IκBα 蛋白相对表达量比较
各组大鼠卵巢组织TNF-α、NF-κB、IκBα 蛋白相对表达量比较,差异有统计学意义(P<0.05)。进一步两两比较,模型组大鼠卵巢组织TNF-α、NF-κB 蛋白相对表达量高于另外3 组,IκBα 蛋白相对表达量低于另外3 组(P<0.05);西药组大鼠卵巢组织TNF-α、NF-κB 蛋白相对表达量高于联合组与对照组(P<0.05),同时联合组高于对照组(P<0.05);西药组大鼠卵巢组织IκBα 蛋白相对表达量低于联合组与对照组(P<0.05),同时联合组低于对照组(P<0.05)。见图1 和表3。
表3 各组大鼠卵巢组织TNF-α、NF-κB、IκBα蛋白相对表达量的比较 (n=20,±s)

表3 各组大鼠卵巢组织TNF-α、NF-κB、IκBα蛋白相对表达量的比较 (n=20,±s)
注:①与模型组比较,P <0.05;②与西药组比较,P <0.05;③与对照组比较,P <0.05。
IκBα蛋白相对表达量0.71±0.22①②0.46±0.12 0.55±0.16①0.61±0.20①②③6.495 0.001组别对照组模型组西药组联合组F 值P 值TNF-α蛋白相对表达量0.38±0.07①②1.45±0.21 1.13±0.19①0.67±0.14①②③6.416 0.001 NF-κB蛋白相对表达量0.53±0.18①②0.81±0.26 0.73±0.24①0.64±0.20①②③5.867 0.001

图1 各组大鼠卵巢组织TNF-α、NF-κB、IκBα蛋白的表达
2.4 各组大鼠TNF-α、NF-κB、IκBα mRNA 相对表达量的比较
各组大鼠卵巢组织TNF-α、NF-κB、IκBα mRNA 相对表达量比较,差异有统计学意义(P<0.05)。进一步两两比较,模型组大鼠卵巢组织TNF-α、NF-κB mRNA 相对表达量高于另外3 组,IκBα mRNA 相对表达量低于另外3 组(P<0.05);西药组大鼠卵巢组织TNF-α、NF-κB mRNA 相对表达量高于联合组与对照组(P<0.05),联合组高于对照组(P<0.05);西药组大鼠卵巢组织IκBα mRNA 相对表达量低于联合组与对照组(P<0.05),联合组低于对照组(P<0.05)。见表4。
表4 各组大鼠TNF-α、NF-κB、IκBα mRNA相对表达量比较 (n=20,±s)

表4 各组大鼠TNF-α、NF-κB、IκBα mRNA相对表达量比较 (n=20,±s)
注:①与模型组比较,P <0.05;②与西药组比较,P <0.05;③与对照组比较,P <0.05。
TNF-α mRNA 0.67±0.21①②1.01±0.34 0.90±0.29①0.76±0.24①②③5.990 0.001组别对照组模型组西药组联合组F 值P 值NF-κB mRNA 0.53±0.18①②0.83±0.24 0.72±0.20①0.61±0.19①②③6.498 0.001 IκBα mRNA 0.58±0.20①②0.39±0.11 0.44±0.13①0.52±0.15①②③6.750 0.001
2.5 各组大鼠卵巢组织TNF-α、NF-κB、IκBα 的OD值比较
各组大鼠卵巢组织TNF-α、NF-κB、IκBα 的OD 值比较,差异有统计学意义(P<0.05)。进一步两两比较,模型组大鼠卵巢组织TNF-α、NF-κB 的OD 值高于另外3 组,IκBα 的OD 值低于另外3 组(P<0.05);西药组大鼠卵巢组织TNF-α、NF-κB 的OD 值高于联合组与对照组(P<0.05),联合组高于对照组(P<0.05);西药组大鼠卵巢组织IκBα 的OD 值低于联合组与对照组(P<0.05),联合组低于对照组(P<0.05)(见表5)。各组大鼠卵巢组织TNF-α、NF-κB、IκBα 阳性表达见图3~5。
表5 各组大鼠卵巢组织TNF-α、NF-κB、IκBα的OD值比较 (n=20,±s)

表5 各组大鼠卵巢组织TNF-α、NF-κB、IκBα的OD值比较 (n=20,±s)
注:①与模型组比较,P <0.05;②与西药组比较,P <0.05;③与对照组比较,P <0.05。
IκBα 0.78±0.24①②0.44±0.16 0.59±0.17①0.67±0.19①②③6.302 0.001组别对照组模型组西药组联合组F值P值TNF-α 0.40±0.14①②0.76±0.23 0.65±0.21①0.52±0.16①②③11.165 0.001 NF-κB 0.49±0.15①②0.74±0.23 0.66±0.21①0.58±0.17①②③6.195 0.001
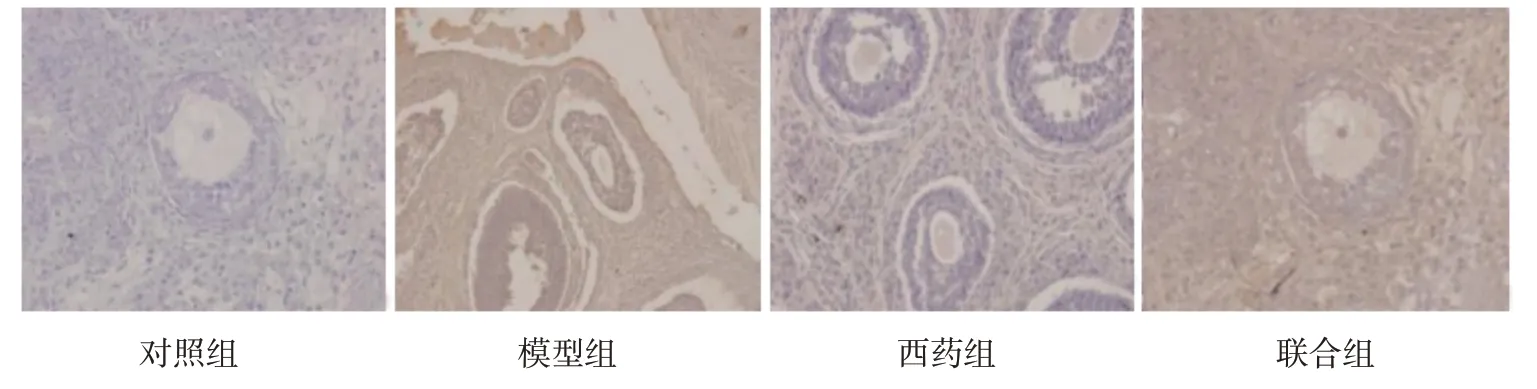
图3 各组大鼠卵巢组织TNF-α蛋白阳性表达 (免疫组织化学×200)

图4 各组大鼠卵巢组织NF-κB蛋白阳性表达 (免疫组织化学×200)

图5 各组大鼠卵巢组织IκBα蛋白阳性表达 (免疫组织化学×200)
3 讨论
研究发现[7],PCOS 易增加子宫内膜癌的发病风险,积极治疗PCOS 对女性月经失调、不孕症及各种远期并发症有较好的预防作用。由于对PCOS发病机制认识的局限性,目前国内外尚无统一的规范治疗方案,临床治疗多以促排卵等对症处理为主,但存在停药复发或治疗无效等问题。西药基础上联合中医药治疗PCOS 具有不良反应少,且能有效改善患者症状,受到临床欢迎。
3.1 自拟补肾祛瘀方对PCOS 大鼠性激素水平的影响
本研究通过来曲唑法复制大鼠PCOS 模型。来曲唑可促进促性腺激素持续分泌,刺激LH、FSH持续合成,使LH、FSH 无法达到排卵高峰,诱发排卵功能障碍,造成卵巢多囊样改变[8]。本研究结果显示,药物干预后,模型组大鼠体重增加最为显著,高于另外3 组;西药组高于联合组和对照组,联合组高于对照组。此外,模型组血清T、FSH、LH 高于对照组;且与模型组相比,血清T、FSH、LH 明显降低,其中联合组更低,但仍高于对照组。这提示PCOS 会造成血清T、FSH、LH 水平的升高,西药治疗可促进血清T、FSH、LH 降低,而联合自拟补肾化瘀方治疗后,血清T、FSH、LH 会进一步降低。中医认为[9],PCOS 病机主要为肾虚、瘀血阻致胞宫,两者互为因果,形成肾虚血瘀症,补肾化瘀是PCOS 的主要治疗思路。本研究所用自拟补肾化瘀方中,菟丝子、山茱萸补肾益精为君药,女贞子、墨旱莲共用为臣药,可养肝肾、益精血;丹参、赤芍、桃仁活血养血为佐药,补益而不留瘀;川芎、红花解郁通达、活血祛瘀,为使药。诸药合用精充血足、气血畅通则经自调,共奏补肾化瘀、活血调经之功[10-11]。现代药理学研究表明[12-13],菟丝子可以TNF-α 为靶点调控TNF-α/NF-κB,抑制PCOS 的炎症反应,从而治疗PCOS;墨旱莲具有抗炎、调节免疫等功效,可通过对卵巢炎症的抑制作用改善卵巢功能[14-15];山茱萸的抗炎抑菌作用可有效改善PCOS 大鼠的胰岛素抵抗,从而减轻炎症及氧化应激,降低血清TNF-α 水平,促进卵巢功能的恢复[16];丹参可通过对外周血单个核细胞NF-κB 活化及TNF-α 表达的影响来调控炎症反应,且与NF-κB/IκBα 炎症反应通路之间存在量效时效关系[17-18]。上述研究提示自拟补肾祛瘀方可能是通过对TNF-α/NF-κB/IκBα 炎症通路的调控来改善卵巢循环与病理状态,达到治疗目的。
3.2 自拟补肾祛瘀方对PCOS 大鼠TNF-α/NF-κB/IκBα 信号通路的调控作用
为探讨自拟补肾祛瘀方治疗PCOS 的机制,本研究检测大鼠卵巢组织的TNF-α、NF-κB、IκBα表达,结果显示模型组大鼠卵巢组织的TNF-α、NF-κB 蛋白表达,mRNA 表达,OD 值均高于对照组,IκBα 蛋白表达,mRNA 表达,OD 值均低于对照组。与模型组相比,西药组和联合组卵巢组织TNF-α、NF-κB 蛋白表达,mRNA 表达,OD 值均降低,其中联合组更低,但仍高于对照组;与模型组相比,西药组和联合组卵巢组织IκBα 蛋白表达,mRNA 表达,OD 值均升高,其中联合组更高,但仍低于对照组。上述结果表明自拟补肾化瘀方治疗PCOS 可上调卵巢组织TNF-α、NF-κB 表达,下调IκBα 表达,PCOS 发病与NF-κB/IκBα 信号通路有关。国外研究表明[19],细胞在正常生理情况下,NF-κB 与抑制蛋白IκBα 结合成无活性的三聚体并存在于细胞质中;TNF-α 升高会刺激IκBα 磷酸化后与NF-κB 解离,使NF-κB 进入细胞核并转录,诱发PCOS[20]。也有研究发现[21],炎症因子IκBα 是NF-κB/IκBα 信号通路的关键下游因子,抑制IκBα可阻断该通路,改善PCOS。自拟补肾化瘀方可补益肝肾,活血化瘀,切中病机,并通过影响TNF-α调控的IκBα/NF-κB 信号通路来改善卵巢功能,且可对TNF-α、IκBα、NF-κB 多个靶点进行干预,最终促进性激素水平的恢复。本研究不足之处:PCOS 的发病过程复杂,自拟补肾祛瘀方治疗PCOS可能不只对单一信号通路的调控发挥治疗作用,其可能涉及的其他信号通路及靶点仍有待进一步探究。
综上所述,自拟补肾化瘀方治疗PCOS 可有效促进LH、FSH、T 等的恢复,且这一作用考虑与TNF-α 介导的NF-κB/IκBα 信号通路的调控有关。
