基于Nrf2/ARE信号通路探讨硫氢化钠对溃疡性结肠炎大鼠肠黏膜损伤的影响*
2022-10-27陈泰宇唐学贵蒋小东唐诗宇陈思敏李敏
陈泰宇,唐学贵,蒋小东,唐诗宇,陈思敏,李敏
(1.川北医学院附属医院 中西医结合肛肠科,四川 南充 637001;2.川北医学院附属医院泌尿外科,四川 南充 637001;3. 川北医学院,四川 南充 637100)
溃疡性结肠炎(ulcerative colitis, UC)是一种炎症性慢性肠病,临床表现为腹痛、腹泻、黏液脓血便、里急后重等,具有长期迁延、反复发作的特点[1]。UC 发病机制复杂多样,研究表明,免疫功能紊乱及炎症反应是UC 发生发展关键因素之一。临床主要采取对症治疗缓解UC 症状,且需长期服药,目前临床尚缺乏特异性治疗措施[2]。硫氢化钠(NaHS)是外源性气体信号分子硫化氢(H2S)的供体,吸收入血后能迅速转化成H2S,研究表明NaHS、H2S 具有抗炎、抗氧化应激作用[3]。梁慧洁等[4]、赫曼等[5]研究显示,NaHS 可抑制UC 小鼠肠黏膜损伤,对肠组织有保护作用,但具体作用机制尚未明确。核因子E2 相关因子2/抗氧化反应元件(Nrf2/ARE)是一条与炎症反应有关的信号通路,陈力等[6]研究显示,促进Nrf2/ARE 信号通路活化能够抑制炎症反应,进而对UC 小鼠发挥保护作用。目前有关NaHS 对UC 的保护作用是否与调控Nrf2/ARE 信号通路有关少见报道,因此本研究基于Nrf2/ARE 信号通路探究NaHS 对UC 大鼠肠黏膜损伤的保护作用,以期为临床探寻治疗UC 的特异性方式提供一定理论依据。
1 材料与方法
1.1 实验动物
SPF 级SD 雄性大鼠45 只,9 周 龄,体重180~210 g,平均(195±15)g,购自北京唯尚立德生物科技有限公司,实验动物使用许可证号:SYXK(京)2021-0056,实验动物生产许可证号:SCXK(京)2021-0010。
1.2 主要试剂与仪器
NaHS(纯度≥98%)购自美国Sigma 公司,柳氮磺胺吡啶(SASP)(国药准字H31020450)购自上海中西三维药业有限公司,2,4,6-三硝基苯磺酸(TNBS)(纯度≥98%,规格20 mg)购自成都普菲德生物技术有限公司,苏木精-伊红(HE)染色试剂盒购自上海一研生物科技有限公司,白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)酶联免疫吸附试验(ELISA)试剂盒均购自滁州仕诺达生物科技有限公司,兔抗鼠Nrf2、ARE、β-肌动蛋白(β-actin)多克隆抗体及山羊抗兔HRP 二抗均购自北京百普赛斯生物科技股份有限公司。Optima™XPN 超速离心机购自美国贝克曼库尔特生物科技有限公司,TENLIN-A型组织匀浆机购自江苏天祥仪器有限公司。
1.3 方法
1.3.1 UC 大鼠模型复制随机选取10 只正常大鼠为对照组,另35 只大鼠进行模型复制[7]。TNBS 诱导的UC 大鼠模型复制方法:每日给予大鼠番泻叶、腺嘌呤分阶段灌胃,连续28 d,于第29 天禁食不禁水24 h,用5%水合氯醛(4 mL/kg)腹腔注射大鼠,麻醉后将其固定,在液状石蜡油润滑作用下用16 号灌胃针头从大鼠肛门经肠道逆行轻柔插入距肛门约8 cm 处,按体重100 mg/kg 的TNBS 加入等体积的50%乙醇制成混合液,充分混匀后注入大鼠结肠内,10 只对照组大鼠给予等量0.9%氯化钠溶液灌肠,后推入3 mL 空气;将大鼠提尾倒置3 min 后,使之平躺至自然清醒。模型复制期间观察大鼠一般情况,模型复制结束后从模型大鼠中随机选取5 只,从对照组大鼠中随机选取2 只麻醉处死,取结肠组织进行形态及病理学观察。模型复制成功大鼠可见皮毛稀疏无光泽,精神萎靡、慵懒,饮食减少,小便清长,大便溏泄且/或伴有黏液脓血便;结肠组织可见局部溃疡灶、糜烂、充血、水肿等;光学显微镜下可见结肠组织炎症细胞浸润、黏膜层缺损、腺体减少、排列紊乱等病理改变。
1.3.2 实验动物分组及处理模型复制过程中,3 只大鼠死亡,将剩余27 只模型复制成功的大鼠随机分为模型组、阳性对照组及硫氢化钠组,每组9 只。阳性对照组于模型复制成功后第3 天给予柳氮磺胺吡啶(SASP)混悬溶液0.5 g/(kg·d)灌胃给药[8];硫氢化钠组大鼠于同时间腹腔注射1 mL 硫氢化钠溶液(100 μmol/L,1 次/d,连续7 d)[9];模型组和对照组于同时间腹腔注射等量生理盐水。模型复制期间观察大鼠一般情况。
1.3.3 标本采集于末次给药结束后,大鼠禁食12 h,麻醉,腹主动脉取血,离心10 min(3 000 r/min,离心半径8 cm)取上清液,置入-20℃冰箱冷冻保存备用。取血结束后将大鼠麻醉处死,距肛门8 cm 处取结肠组织, 进行结肠黏膜损伤指数(colon macroscopic damage index, CMDI)评 分[10]:0 分(黏膜无损伤)、1 分(黏膜充血、水肿、无溃疡)、2 分(黏膜充血、水肿、轻度糜烂及无溃疡);3 分(黏膜充血、水肿、中度糜烂及有单个溃疡);4 分(黏膜充血、水肿、高度糜烂及有多处溃疡);5 分(黏膜充血、水肿、重度糜烂及有>1 cm 溃疡);沿肠系膜缘剪开肠腔,用冰生理盐水清洗肠内容物,滤纸吸干,剪成两部分,一部分于4%多聚甲醛中固定,乙醇脱水、透明、石蜡包埋过夜,连续切片(6 μm 厚),用于HE 染色,另一部分置于-80℃冰箱冷冻保存,用于Western blotting 检测。
1.3.4 ELISA 法检测各组大鼠血清炎症因子水平取各组大鼠血清,分别采用ELISA 试剂盒检测大鼠血清IL-8、TNF-α 水平。在酶标板上加入稀释后的标准品50 μL+待测样品50 μL+生物素标记的抗体50 μL。盖上模板,轻轻振荡混匀,37℃温育1 h。甩去酶标板孔内液体,每孔加满洗涤液,振荡30 s,甩去洗涤液,用吸水纸拍干(共洗涤3 次)。每孔加入80 μL 的链霉亲和素-HRP,轻轻振荡混匀,37℃温育30 min。甩去孔内液体,每孔加满洗涤液,振荡30 s,甩去洗涤液,用吸水纸拍干(共洗涤3 次)。每孔加入底物A、B 各50 μL,轻轻振荡混匀,37℃温育10 min(避光操作)。取出酶标板,迅速加入50 μL 终止液,立即在450 nm 波长处测定各孔的光密度值[11]。
1.3.5 HE 染色观察大鼠结肠组织病理学变化取各组大鼠结肠组织切片,二甲苯Ⅰ、Ⅱ各10 min 进行脱蜡处理,用梯度浓度乙醇100%、90%、80%、70%各处理5 min,自来水冲洗5 min,重复冲洗3 次。用苏木精染色5 min(根据染色情况可以适当延长或缩短染色时间),结束后用流水冲洗。用伊红染色1 min(根据染色情况可以适当延长或缩短染色时间),结束后用流水冲洗。用梯度浓度乙醇70%、80%、90%、100%各处理10 s,二甲苯处理1 min,自然晾干再封后滴上中性树胶封片(用吸管滴上1 滴即可,尽量少滴,但压片后要将组织全部覆盖完,避免中间有气泡)。光学显微镜观察并采集图片,使用Image-Pro Plus 6.0 软件观察大鼠结肠组织病理学变化[12]。
1.3.6 Western blotting 检测大鼠结肠组织中Nrf2/ARE 信号通路蛋白水平的变化取各组大鼠结肠组织并制备匀浆,裂解,孵育20 min,离心10 min(3 000 r/min,离心半径8 cm)取上清液,测定蛋白总量并取20 μg 与等量上样缓冲液混匀,沸水浴变性,电泳、转膜,以5%脱脂奶粉封闭2 h,TBST 清洗,加入Nrf2、ARE 及内参β-actin 作为一抗(1∶500),4℃孵育过夜,TBST 洗涤,加入山羊抗兔二抗(1∶1 000),37℃1.5 h,显影、定影,以蛋白条带灰度值计算目标基因蛋白相对表达量[13]。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,两两比较用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况比较
对照组大鼠饮食、活动正常,精神状态良好,皮毛光亮,大便成形,肛周未见异常分泌物;模型组大鼠饮食减少,出现神态萎靡、精神慵懒,皮毛暗黄,弓背蜷缩喜扎堆,小便清长,大便质软,甚者稀溏,肛周见黏液脓血分泌物,部分大鼠出现腹部胀满;与模型组大鼠比较,硫氢化钠组及阳性对照组大鼠上述症状、体征有所改善。
2.2 各组大鼠血清炎症因子水平比较
对照组、模型组、阳性对照组及硫氢化钠组大鼠血清IL-8、TNF-α 水平比较,经方差分析,差异有统计学意义(P<0.05),与对照组比较,模型组、阳性对照组及硫氢化钠组IL-8、TNF-α 水平均升高(P<0.05),与模型组比较,阳性对照组和硫氢化钠组大鼠血清IL-8、TNF-α 水平均降低(P<0.05)。见表1。
表1 各组大鼠血清炎症因子水平比较 (±s)
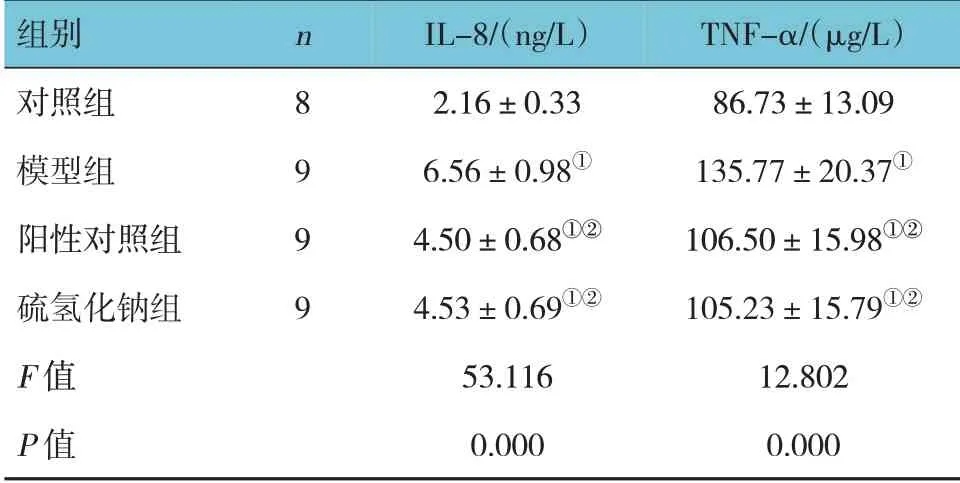
表1 各组大鼠血清炎症因子水平比较 (±s)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05。
组别对照组模型组阳性对照组硫氢化钠组F 值P 值TNF-α/(μg/L)86.73±13.09 135.77±20.37①106.50±15.98①②105.23±15.79①②12.802 0.000 n 8 9 9 9 IL-8/(ng/L)2.16±0.33 6.56±0.98①4.50±0.68①②4.53±0.69①②53.116 0.000
2.3 模型组、阳性对照组及硫氢化钠组大鼠结肠黏膜组织CMDI评分比较
模型组、阳性对照组及硫氢化钠组大鼠结肠组织CMDI 评分分别为(4.87±0.73)分、(2.15±0.32)分、(2.08±0.35)分,3 组比较,经方差分析,差异有统计学意义(F=90.186,P=0.000),与模型组比较,阳性对照组和硫氢化钠组大鼠结肠黏膜组织CMDI 评分降低(P<0.05)。
2.4 各组大鼠结肠组织病理学变化
对照组大鼠结肠组织结构完整,腺体排列整齐,无炎症细胞浸润,未见水肿、充血、糜烂、溃疡等情况;模型组大鼠结肠黏膜上皮缺损,腺体排列紊乱且减少,明显可见黏膜水肿、充血,有大量炎症细胞浸润,有溃疡灶形成;阳性对照组、硫氢化钠组大鼠结肠组织黏膜上皮部分缺损,腺体排列尚规则,充血、水肿较轻,伴有少量炎症细胞浸润。见图1。

图1 各组大鼠结肠组织病理学变化 (HE×200)
2.5 各组大鼠结肠组织Nrf2/ARE通路蛋白相对表达量比较
对照组、模型组、阳性对照组及硫氢化钠组大鼠结肠组织Nrf2、ARE 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05),与对照组比较,模型组、阳性对照组及硫氢化钠组Nrf2、ARE 蛋白相对表达量均降低(P<0.05),与模型组比较,阳性对照组和硫氢化钠组大鼠结肠组织Nrf2、ARE 蛋白相对表达量均升高(P<0.05)。见表2 和图2。
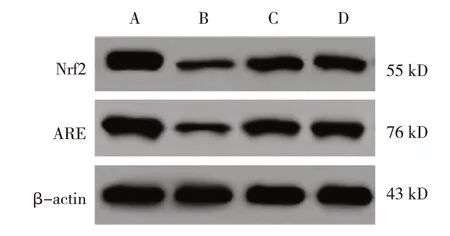
图2 各组大鼠结肠组织Nrf2/ARE信号通路蛋白表达
表2 各组大鼠结肠组织Nrf2/ARE信号通路蛋白相对表达量比较 (±s)

表2 各组大鼠结肠组织Nrf2/ARE信号通路蛋白相对表达量比较 (±s)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05。
组别对照组模型组阳性对照组硫氢化钠组F 值P 值ARE蛋白1.09±0.16 0.30±0.06①0.75±0.12①②0.73±0.11①②66.078 0.000 n 8 9 9 9 Nrf2蛋白1.15±0.18 0.23±0.03①0.66±0.09①②0.68±0.11①②93.695 0.000
3 讨论
UC 是一种病因不明的炎症性慢性肠病,具有慢性过程和反复发作的特征,发病机制尚未明确,目前临床仍缺乏特异性治疗手段。BERCIER 等[14]研究显示,NaHS 能够抑制炎症反应进而抑制慢性结肠炎肠壁纤维化进展。本文探究NaHS 对UC 结肠损伤的影响,并分析其可能的机制,以期为临床探寻有效治疗UC 的特异性方法提供一定依据。
IL-8、TNF-α 是炎症因子,参与机体的炎症反应,与UC 密切相关[15]。本研究成功复制UC 大鼠模型,结果显示,模型组大鼠饮食减少,出现神态萎靡、精神慵懒、皮毛暗黄、大便质软、肛周见黏液脓血分泌物等症状,部分大鼠出现腹部胀满等UC 典型症状。当以NaHS 干预后,上述症状有所改善,与对照组比较,模型组、阳性对照组及硫氢化钠组IL-8、TNF-α 水平均升高,与模型组比较,阳性对照组和硫氢化钠组大鼠血清IL-8、TNF-α 水平均降低,说明NaHS 可能减轻UC 大鼠炎症反应,对结肠黏膜组织损伤发挥保护作用。CMDI 评分可用于评价肠黏膜损伤程度,评分越高,肠黏膜损伤越严重[16]。本研究结果显示,NaHS 干预后,阳性对照组和硫氢化钠组大鼠结肠黏膜组织CMDI 评分较模型组降低,说明NaHS 可能减轻UC 大鼠炎症反应,进而对大鼠结肠黏膜损伤发挥保护作用。
Nrf2/ARE 是一条与炎症反应相关的信号通路,正常生理情况下,Nrf2 与受Kelch 样环氧氯丙烷相关蛋白1(Keap1)结合形成异源二聚体,Nrf2 表达处于基础水平,当受到氧化应激等各种刺激后,Nrf2 与Keap1 结合部位发生解离,进而使Nrf2 进入细胞核,与ARE 结合,抑制核内氧自由基的产生,最终抑制氧化应激炎症损伤[17-18]。马旭冉等[19]研究显示,促进Nrf2 通路活化能够有效抑制UC 大鼠结肠组织氧化应激反应进而抑制炎症反应,对UC 大鼠结肠组织损伤发挥保护作用。本研究结果显示,与对照组比较,模型组、阳性对照组及硫氢化钠组Nrf2、ARE 蛋白相对表达量均降低,与模型组比较,阳性对照组和硫氢化钠组大鼠结肠组织Nrf2、ARE 蛋白相对表达量均升高。说明NaHS 可能通过促进Nrf2/ARE 信号通路活化抑制炎症反应,进而对UC 大鼠结肠黏膜损伤发挥保护作用。
综上所述,NaHS 对UC 大鼠结肠黏膜损伤发挥保护作用,可能是通过促进Nrf2/ARE 信号通路活化抑制炎症反应实现的,可为临床探寻有效治疗UC 的特异性方法提供一定参考。本研究并未能明确NaHS 对Nrf2/ARE 信号通路的具体调控作用,后期应进行深入阐述。
