特发性肺纤维化急性加重期患者NLRP3炎症小体、炎症因子、蛋白酶表达水平及其临床价值
2022-10-27姜福富覃纲李嘉燕张波潘东旭韦柳青
姜福富 覃纲 李嘉燕 张波 潘东旭 韦柳青
(广西壮族自治区民族医院重症医学科,广西 南宁 530001)
特发性肺纤维化急性加重(AE-IPF)患者病情在短期内急剧恶化,气喘、呼吸困难等临床症状急剧加重,急速肺衰竭,影像学表现为弥漫性磨玻璃影或实变影〔1,2〕。特发性肺纤维化患者每人每年急性加重的发生率约为4%,若将疑似患者考虑在内时发病率增至20%〔3〕,则AE-IPF的病死率超过50%,预后极为凶险,给临床诊断与治疗带来严峻挑战〔2〕。因此,探寻可有效预测AE-IPF患者预后的生物标志物或手段对临床早期进行针对性干预以改善患者预后有着重要的临床意义。研究证实多种炎症因子如白细胞介素(IL)-1β及基质金属蛋白酶(MMP)-9通过多种途径参与肺纤维化的发生机制〔4,5〕,Lv等〔6〕通过实验发现肺纤维化与Nod样受体蛋白(NLRP)3炎症小体活化有关,然而上述指标与AE-IPF患者预后的相关研究未见提及。基于此,本研究旨在探讨AE-IPF患者NLRP3炎症小体、炎症因子、蛋白酶表达水平及其临床价值。
1 资料与方法
1.1一般资料 选取2016年3月至2019年5月在广西壮族自治区民族医院收治的AE-IPF患者88例为AE-IPF组。其中男50例,女38例;年龄48~72岁,平均(60.40±10.50)岁。参照患者基线资料,选取同时期健康体检者血液标本100例为对照组。本研究经医院理论委员会批准实施。纳入标准:①IPF诊断均符合《特发性肺纤维化诊断和治疗中国专家共识》〔7〕中的相关标准;②明确的IPF史;③1个月内发生典型的呼吸加重或急性恶化;④高分辨电子计算机断层扫描(CT)检查显示两肺在网状影或蜂窝状影等基础上可见新的磨玻璃影、实变影;⑤无明确的肺部感染;⑥血气分析等提示无机械通气指征;⑦所有患者自愿参与本研究,并签署知情同意书。排除标准:①严重的慢性阻塞性肺疾病、肺栓塞、支气管哮喘、肺动脉高压等其他肺部疾病者;②肺外病变者;③资料不完整;④伴有严重的内分泌疾病、血液系统疾病及恶性肿瘤者;⑤伴有严重的心、肝、肾等脏器疾病者;⑥不能完成随访者。
1.2检测方法 取AE-IPF患者入院时和对照组体检时空腹静脉血,乙二胺四乙酸(EDTA)抗凝血管和常规管各3 ml。采用聚蔗糖(Ficoll)密度梯度离心法分离单个核细胞并经磷酸盐缓冲液(PBS)冲洗,采用实时荧光定量PCR技术检测NLRP3、半胱氨酸蛋白酶(Caspase)-1,最后用2-△△Ct法计算NLRP3、Caspase-1的相对表达量。常规管内外周血离心(3 000 r/min,15 min)后取血清,采用酶联免疫吸附法检测IL-1β、MMP-9水平,所有操作严格按照试剂盒说明书(武汉赛默飞世尔科技公司)执行。
1.3随访及分组 对所有AE-IPF患者进行随访至2020年1月,中位随访时间为20个月,随访期间观察患者疾病进展情况、生存情况。剔除在随访期间筛查出结缔组织疾病、非IPF原因导致的死亡。AE-IPF诊断标准为IPF患者需同时满足以下条件:①1个月内发生典型的呼吸加重或急性恶化;②两肺影像学检查显示在网状影或蜂窝状影等基础上可见新的磨玻璃影、实变影;③无明确的肺部感染、肺栓塞或心力衰竭等;④低氧血症加重。随访期间患者仍为生存状态且未发生AE-IPF的归为预后良好组(n=50),反之为预后不良组(n=38)。
1.4统计学方法 采用SPSS22.0软件进行t检验和χ2检验;使用受试者工作特征(ROC)曲线分析相关指标对AE-IPF患者预后的预测效能。
2 结 果
2.1两组NLRP3、Caspase-1、IL-1β、MMP-9表达比较 AE-IPF组NLRP3、Caspase-1、IL-1β、MMP-9均显著高于对照组(P<0.001)。见表1。
2.2AE-IPF不同预后患者NLRP3、Caspase-1、IL-1β、MMP-9表达比较 预后不良组NLRP3、Caspase-1、IL-1β、MMP-9均显著高于预后良好组(P<0.001)。见表1。

表1 两组NLRP3、Caspase-1、IL-1β、MMP-9表达比较
2.3NLRP3、Caspase-1、IL-1β、MMP-9预测AE-IPF患者预后ROC曲线 4者联合预测的曲线下面积(AUC),可见明显优于各单独指标(P<0.001)。见表2、图1。
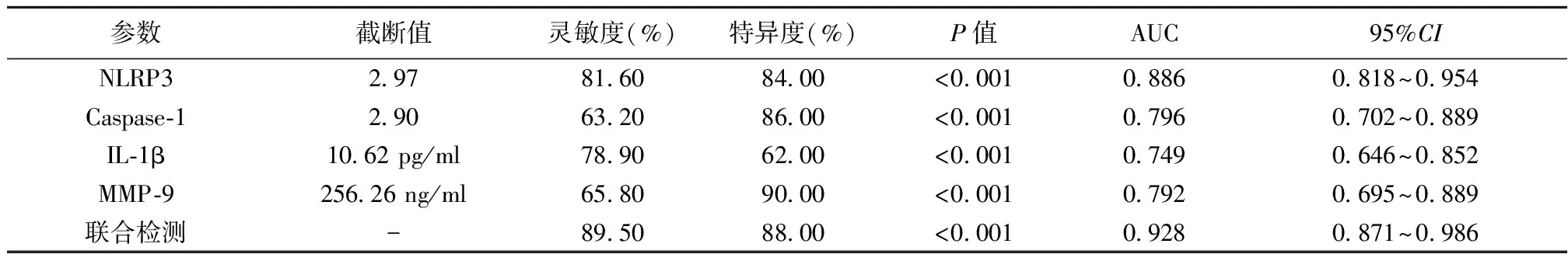
表2 NLRP3、Caspase-1、IL-1β、MMP-9预测AE-IPF预后的ROC曲线

图1 NLRP3、Caspase-1、IL-1β、MMP-9预测AE-IPF预后的ROC曲线
3 讨 论
目前已发现的部分IPF相关生物标志物,可能对疾病发展、患者预后有一定的风险预示作用,然而IPF生物标志物的研究仍为起步阶段,多数报道的生物标志物到临床应用仍需足够的循证医学证据〔8〕。对于AE-IPF这类高度异质性疾病,寻找有效手段评估疾病发展及判断预后是目前临床急需解决的问题。NLRP3来自NLR家族,能够特异性识别病原相关分子模式及损伤相关分子模式,被激活后作用于凋亡相关点状蛋白(ASC),诱导Caspase-1活化,形成蛋白复合物“炎症小体”,促进IL-1β的成熟与分泌。NLRP3炎症小体已被证实在心、肾、肝脏及皮肤等器官纤维化的发展过程中发挥重要作用。NLRP3炎症小体同样在肺纤维化的早期炎症反应、中晚期成纤维细胞活化及细胞外基质沉积过程中扮演着关键角色〔9〕。在IPF发生过程中,肺上皮细胞损伤引起中性粒细胞、嗜酸性粒细胞、巨噬细胞等参与炎症反应的细胞浸润,促使转化生长因子(TGF)-β、高迁移率族蛋白(HMG)B1、IL、MMP-9等因子的释放,增加α-平滑肌肌动蛋白(SMA)、胶原蛋白Ⅰ型的翻译表达,促进肺成纤维细胞转化为肌成纤维细胞,加快细胞外基质沉积,进而加速肺纤维化进程〔10,11〕。NLRP3炎症小体活化后,通过IL-1β调控TGF-β,诱导成纤维细胞活化为肌成纤维细胞,促使细胞外基质合成分泌,加速基质沉积,促进肺纤维化〔12〕。此外,有研究表示上皮间质转化(EMT)在成纤维细胞聚集及特发性肺纤维化的发生与进展中发挥关键作用,而NLRP3炎症小体可能通过TGF-β对EMT进行调节〔13〕。宋占帅等〔14〕通过动物模型发现,NLRP3及其下游因子Caspase-1、IL-1β、TGF-β1在肺纤维化肺组织中的表达均明显上调,认为NLRP3/IL-1β/TGF-β1信号轴的激活参与了肺纤维化的发生与进展。况菊等〔15〕发现,通过抑制NALP3炎症复合体活化,可起到对成纤维细胞活化的抑制作用,从而起到抗纤维化作用。
MMP-9属于MMPs家族成员之一,在健康肺组织中少量表达,当机体受外界刺激时肺泡上皮细胞、支气管上皮细胞、成纤维细胞及平滑肌细胞等均有表达,且在肺纤维化患者中MMP-9的活性及表达量均较正常人明显增加〔16〕。特发性肺纤维化破坏性极强,加速上皮细胞活化,使肺泡间隔、肺泡腔的成纤维细胞/肌成纤维细胞数量快速增加,进而引起细胞外基质的异常沉积。在肺纤维化发生发展过程中,MMP-9表达异常升高、活性显著增强,严重降解破坏肺泡-毛细血管基底膜,使肺泡上皮细胞、毛细血管内皮细胞受损,引起肺组织微环境发生改变,这种改变一方面刺激肌纤维膜母细胞、Ⅱ型上皮细胞等细胞外基质的沉积,另一方面使纤维细胞由受损基底膜及受损上皮细胞间隙进入肺泡,进而生成胶原,导致肺泡纤维化〔17,18〕。在肺纤维化发展过程中,肺泡炎为起始中心环节,而MMPs则为肺纤维化急性快速进展的中心环节,肺纤维化急性发作患者的肺组织MMP-9的过度表达使肺泡-毛细血管的基底膜完整性受到严重破坏,并且激活TGF-β,诱导成纤维细胞/肌成纤维细胞转化,加速基质沉积,促进肺纤维化。
结果提示,AE-IPF患者血液NLRP3≥2.97时,预后可能不利,有一定的灵敏度和特异度;Caspase-1在其临界值(2.90)时灵敏度较低,IL-1β取临界值时则特异度较低,但MMP-9在其临界值时的特异度较高。NLRP3、Caspase-1、IL-1β、MMP-9联合预测AE-IPF预后具有较高的灵敏度和特异度,有一定的临床意义。由于本研究样本量较小且随访时间较短,结果可能会产生一定偏倚,因此仍需扩大样本量进行更具前瞻性的研究并进一步证实。
