YM155对T24细胞生物学行为影响
2022-10-27肖建华游艳董自强
肖建华 游艳 董自强
(三峡大学 1第一临床医学院泌尿外科 三峡大学泌尿外科研究所,湖北 宜昌 443003;2附属仁和医院)
膀胱癌发病率居泌尿系统恶性肿瘤的首位,其发生机制同其他肿瘤一样,是机体在各种致癌因素作用下,膀胱组织的个别细胞在基因水平上失去对其生长的正常调控,导致其异常克隆性增生而形成的新生物。细胞凋亡是指生物体内细胞在特定内外源信号诱导下,死亡途径被激活,并在有关基因调控下发生的程序性死亡过程。生存素(Survivin)作为凋亡抑制蛋白家族(IAP)家族中的重要成员,能明显抑制Fas、天冬氨酸特异性半胱氨酸蛋白酶(Caspase)、B细胞淋巴瘤相关X蛋白(Bax)及多种经典化疗药物、白细胞介素(IL)-3、肿瘤坏死因子(TNF)-α、X-射线等诱导的细胞凋亡〔1〕,选择性表达于膀胱癌、胃癌、结直肠癌、非小细胞肺癌、皮肤癌等常见恶性肿瘤,而在癌旁正常组织和成人分化组织并不表达,可能与肿瘤细胞获得的某种异常抗凋亡能力相关。Du等〔2〕在研究 shRNA沉默survivin基因对人膀胱移行细胞癌T24细胞生物学行为影响的过程中发现pshRNA-survivin 2组细胞侵袭力与运动能力均有明显下降,证明了Survivin抑制措施用于膀胱肿瘤治疗的有效性和可行性。
YM155具有强大的抗肿瘤活性,并能增加多种肿瘤细胞对紫杉酚、顺铂、依托泊甙等化疗药物和γ辐照、免疫疗法的敏感性〔3〕。本研究旨在探讨YM155对T24细胞体外增殖作用的影响。
1 材料和方法
1.1T24细胞准备 T24细胞购于中国典型培养物保藏中心(武汉大学保藏中心),CCTCC编号为:GDC078。细胞经培养、传代、冻存后进行实验,所有过程确保为无菌操作。
1.2试剂 YM155,美国Selleck生命科学,货号:S1130,规格:5 mg/瓶。
1.3方法
1.3.1细胞毒性实验 将对数生长期的T24细胞用胰酶消化,加入培养液配成细胞悬液后接种到96孔培养板(每孔约2×104个细胞),放入培养箱中培养;待细胞贴壁后进行试验。每96孔培养板上的细胞加样分调零孔(等体积培养液)、阴性对照组、不同浓度(0、10、100、1 000 nmol/L)YM155药物组。
1.3.2噻唑蓝(MTT)法细胞增殖抑制实验 分别将不同浓度YM155(1、5、10、50、100、500、1 000 nmol/L)分别加入贴壁生长的T24细胞培养板中,每孔加入药液100 μl且每种药物的不同浓度分别设置4个复孔;调零孔加入等体积的培养液,分别处理24 h、48 h和72 h后吸出培养孔中的上清,加入先前配制的浓度为5%MTT溶液,培养4 h,吸弃MTT,再加入二甲基亚砜(DMSO,每孔150 μl),震荡5~10 min,在酶联免疫检测仪上570 nm波长测吸光值(OD值),将所有实验组培养孔的测值减去调零孔组平均值,然后将目标孔中同一浓度组的4孔取平均值,计算细胞增殖抑制率(IR)和存活率并进行统计分析:(实验组OD值/阴性对照组OD值)×100%=生存率,1-生存率=抑制率。
1.3.3流式细胞术 对数生长期状态良好的T 24细胞,胰酶消化后用培养液制成细胞悬液,调整细胞数为3.0×105个/ml,均匀接种于无菌6孔培养板中,每孔2 ml,待其贴壁后进行换液,分别加入提前配好不同浓度的YM155药液(0、10、100、1 000 nmol/L),置入培养箱培养48 h后1 000 r/min离心5 min,弃去药液,再次胰酶消化,移液器吹打,转入不同的离心管,离心后弃上清液收集细胞,分别用冷的缓冲液洗涤后各加入1.25 ml膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC,0.5 mg/ml),室温黑暗环境中孵育15 min,磷酸盐缓冲液(PBS)洗涤细胞后各加入10 ml碘化丙啶(PI)染料(0.3 mg/ml)并借助流式细胞仪(美国Accuri Cytometers公司,型号:accuri C6)进行观察,以上所有操作按试剂盒(Beijing 4A Biotech Co.,Ltd)说明书进行。
1.3.4RT-PCR法检测不同浓度YM155对T24细胞的抑制作用 将生长状态良好的细胞用胰酶消化并配成细胞悬液,均匀种植到①,②,③,④号培养瓶中;待其贴壁后进行换液,分别加入临用前配好不同浓度的YM155药液(0、10、100、1 000 nmol/L),培养48 h后弃药液,用胰酶消化细胞,Trizol(赛默飞公司,上海,中国)提取总mRNA,并经核酸测定仪测定样品RNA含量和纯度,OD260/OD280值在1.8~2.0提示RNA纯度高。根据RT-PCR试剂盒(宝生物工程(大连)有限公司)说明书将RNA样品拍照并采用SIM BIO-1D EXPRESS凝胶成像分析软件进行灰度分析,以β-actin作为内参,将目的基因扩增条带的灰度值与内参β-actin扩增条带的灰度值比值作为目的基因mRNA的半定量指标。
1.3.5免疫印迹法检测不同浓度YM155对T24细胞的抑制作用 将生长状态良好的细胞用胰酶消化并配成细胞悬液,待其生长贴壁后加入提前配好不同浓度的YM155药液置入细胞培养箱培养48 h后按照BCA试剂盒提取蛋白,并测定蛋白浓度;进行免疫印迹试验。ECL法显色后扫描成像,分析相应的光密度值,用各目的蛋白条带和内参条带光密度值之比表示各蛋白表达水平。
1.4统计学分析 采用SPSS20.0软件进行方差分析。
2 结 果
2.1细胞形态改变 未经药物处理的细胞生长良好,呈多角形或梭形,贴壁生长,增长速度快,一般1∶3传代分瓶,2 d后可以长满,培养液清亮。用不同浓度的YM155处理后细胞生长受到不同程度的抑制,随着药物浓度的上升,其抑制程度不断增加,主要形态学改变为细胞体积变小、变形,细胞膜完整但出现发泡现象,可见凋亡小体,贴壁细胞出现皱缩、变圆、脱落。见图1。
2.2YM155抑制体外培养的人膀胱癌T24细胞生长 同批次的T24细胞经不同浓度的YM155处理24 h,48 h和72 h后呈现出不同的生长抑制状态。当YM155浓度<5 nmol/L时,其对T24细胞生长影响不明显,但当其浓度>5 nmol/L后则不同程度抑制细胞生长,最佳作用浓度为5~100 nmol/L,当药物浓度一定即5、10、50、100、500 nmol/L时,随着药物作用时间的延长,T24细胞的生存率逐渐下降,其差异有统计学意义(F=26.26,19.102,19.866,14.526,15.251,P<0.01),当作用时间一定时,随着YM155药物浓度的不断增加,T24生存率也呈明显下降趋势(F=127.279,204.653,243.229,P<0.01)。见图2。
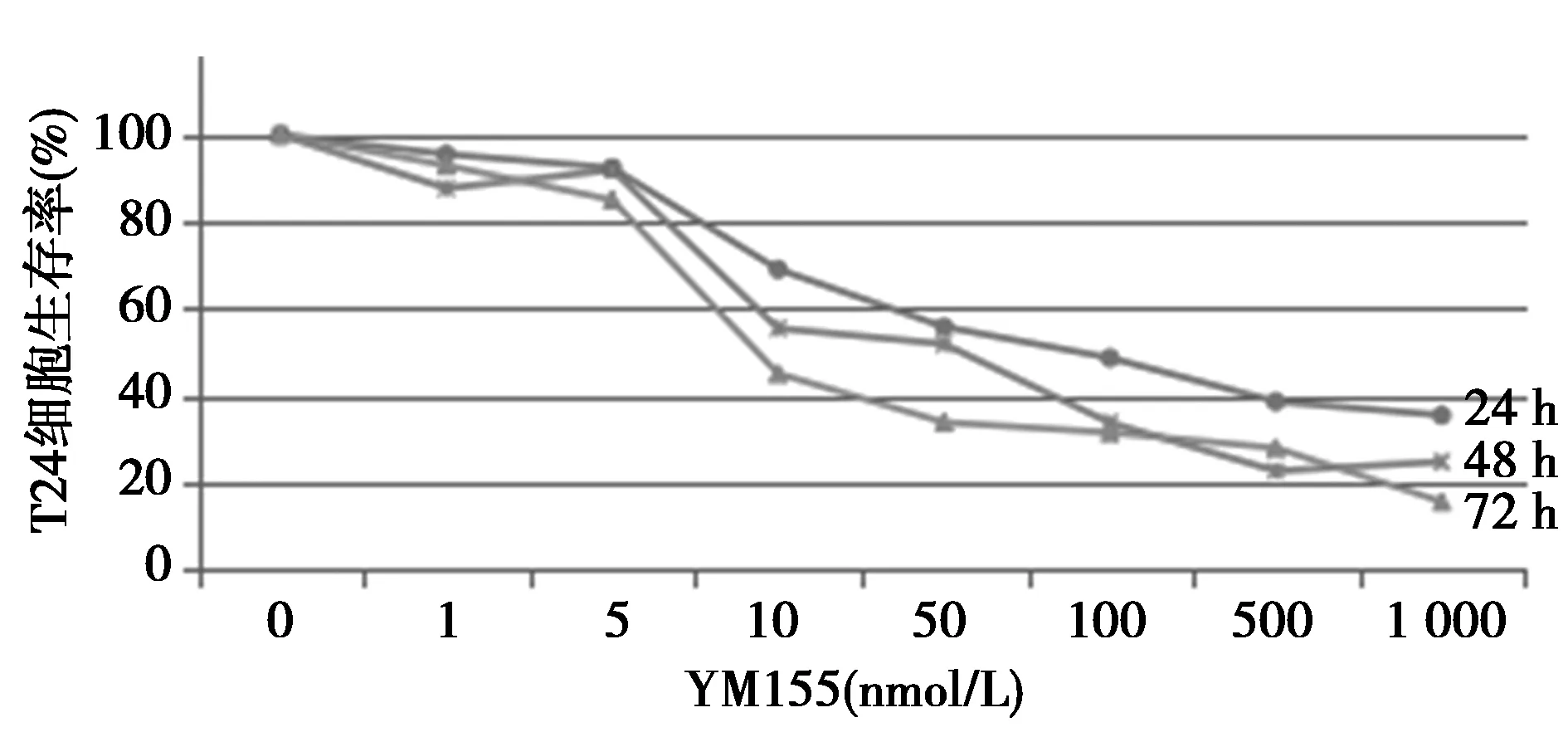
图2 不同浓度YM155作用T24细胞不同时间后对生存率的影响
2.3YM155诱导体外培养T24细胞凋亡 分别用0、10、100、1 000 nmol/L 4种浓度的YM155处理T24细胞24 h后用流式细胞术Annexin V-FITC双染法检测细胞凋亡情况,重复检测3次后0、10、100、1 000 nmol/L YM155处理后的细胞平均凋亡率分别为(3.56±0.44)%、(19.76±1.42)%、(32.18±4.72)%、(47.81±3.57)%。10 nmol/L,100 nmol/L,1 000 nmol/L组细胞凋亡率明显高于0 nmol/L组,且随着YM155药物浓度升高,T24细胞凋亡率逐渐升高(F=132.131,P<0.01)。见图3。可见随YM155药物浓度的不断升高,细胞凋亡比率逐渐上升。
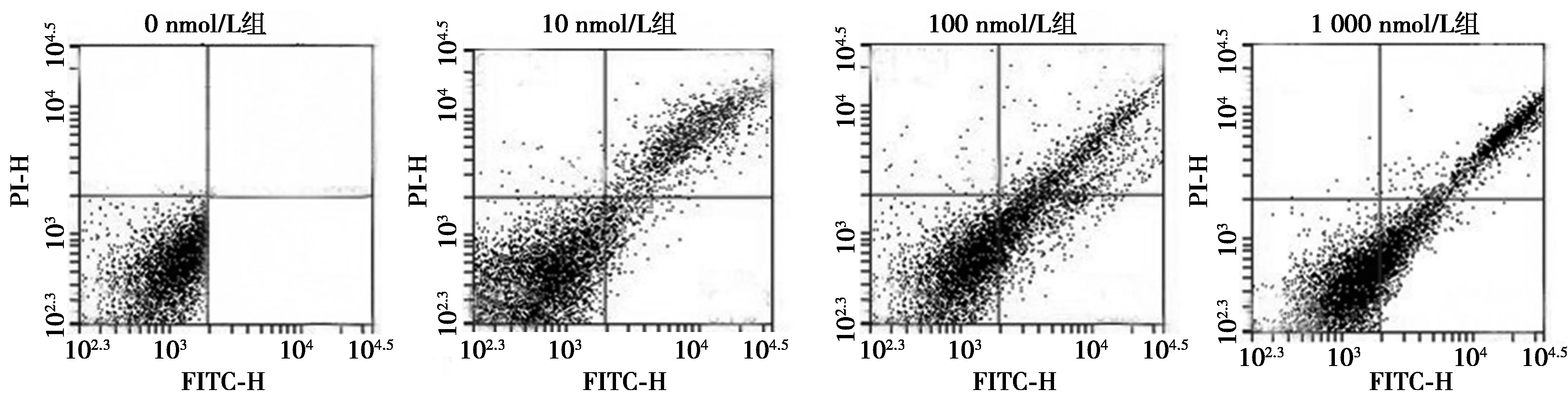
图3 T24细胞经不同浓度YM155处理后的凋亡发生情况
2.4YM155可抑制T24细胞中Survivin mRNA水平的表达 随药物浓度升高,细胞内Survivin mRNA含量不断降低,与0 nmol/L组(0.84±0.02)相比,10 nmol/L、100 nmol/L和1 000 nmol/L药物处理组Survivin mRNA表达显著降低(0.60±0.01,0.39±0.01,0.01±0.00,P<0.05);且不同浓度药物处理组间Survivin mRNA表达也有明显的差异(P<0.05)。见图4。
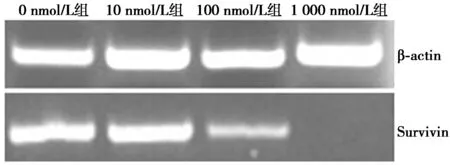
图4 T24细胞经不同浓度YM155处理后survivin mRNA水平
2.5YM155抑制T 24细胞中Survivin蛋白表达水平 与0 nmol/L组(Survivin蛋白表达为0.95±0.13、Cleaved Caspase-3表达为0.52±0.07)相比,10 nmol/L、100 nmol/L和1 000 nmol/L组Survivin蛋白水平均显著降低(0.75±0.11、0.78±0.09、0.74±0.12,F=88.450,P<0.01),Cleaved Caspase-3蛋白水平则显著上升(0.70±0.09、0.69±0.08、0.78±0.11,F=94.870,P<0.01);且不同浓度药物处理组间差异显著(P<0.05)。见图5。
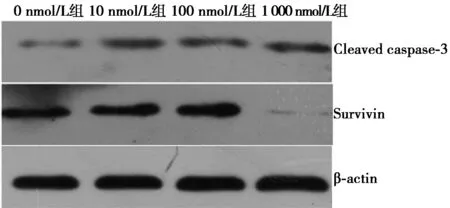
图5 Western印迹检测各组Survivin、Cleaved Caspase-3蛋白表达水平
3 讨 论
膀胱癌是泌尿外科最常见,严重影响患者生活质量甚至威胁患者生命的肿瘤之一,其发病率和死亡率在国内有明显的上升趋势〔4~7〕。目前膀胱癌的治疗多以手术为主,再辅以膀胱灌注化疗,但其复发率高,化疗副反应多,且术后多需行尿流改道,尿路感染发生率高,患者生活质量普遍较低,期待新型高效、低毒的抗肿瘤药物或药物联合方案诞生。
YM155作为新型凋亡抑制因子Survivin的靶向抑制剂表现出了尤为强大的抗瘤潜能:在体外细胞水平,研究发现其可抑制超过119种人类肿瘤细胞株,其中包括非霍奇金淋巴瘤、激素治疗不敏感前列腺癌、非小细胞肺癌、白血病和黑素瘤等预后不良的恶性肿瘤〔8〕。本研究结果表明,YM155单独作用可以显著抑制膀胱癌T24细胞的生长,最佳作用浓度范围为5~100 nmol/L,且该抑制作用在一定程度上呈现出浓度依赖性和时间依赖性,作用机制可能与YM155特异性抑制Survivin的表达,从而促进肿瘤细胞的凋亡发生相关。
此外,有研究表明,YM155同顺铂和喜树碱等化疗药物没有交叉耐药性,对肿瘤细胞株的作用不受p53基因状态限制〔8〕,在同顺铂、碳铂、伊马替尼、γ射线等抗瘤措施联合应用时可协同增加抗瘤活性〔9,10〕。在不同肿瘤动物模型试验研究水平,YM155作为抗肿瘤制剂的有效性和安全性均超过了紫杉醇、顺铂等传统化疗药物,其给药途径灵活方便,静脉注射、皮下注射、瘤内注射均可达到理想的抗瘤效果而无明显毒副作用出现〔11〕。动物肿瘤模型体内联合用药时YM155同样可以增强常用化疗药物及放疗的抗瘤性能,对H460细胞和Calu6细胞肿瘤模型放疗敏感性的增强系数分别达3.3和3.5〔10〕,且在接受YM155治疗的动物中并没有发现组织损伤或体重显著丢失等副作用〔12〕。临床研究发现,Ⅰ期临床试验证实4.8 mg/(m2·d)剂量水平的YM155对化疗耐药的非霍奇金淋巴瘤患者产生治疗作用;多耐药弥漫性大B细胞淋巴瘤在接受YM155治疗2个周期后开始出现反应,6个周期后所有症状和体征均转为阴性,达到完全反应状态,无病生存期达4年以上;多药化疗和肝细胞移植后复发的滤泡状大B细胞淋巴瘤患者接受YM155治疗8个周期后出现部分反应,无病生存期维持到2年以上〔13〕。Ⅱ期临床试验中37例肿瘤患者有2例(5.4%)呈现出部分治疗效果,14例(37.8%)达到病情稳定状态,病情控制率达43.2%,中位无进展期时间为1.7个月,中位生存时间为6.6个月,1年生存率为35.1%〔14〕,且严重的并发症罕见。
综上,作为新型凋亡抑制因子survivin的靶向抑制剂,YM155在纳摩尔浓度级方可抑制众多肿瘤细胞株生长,减轻荷瘤动物模型的肿瘤负担,改善多药耐药或复发晚期肿瘤患者的预后。另有药理学分析表明YM155能选择性高分布于肿瘤组织中而很少有系统毒性反应出现,其抗瘤活性呈时间依赖性,在施药途径上以持续静脉注射时活性最高〔12〕,这些数据均为其进入临床来改善肿瘤患者预后奠定了坚实的基础。
