2型糖尿病患者血清熊脱氧胆酸、石胆酸水平与糖尿病肾脏病的相关性研究
2022-10-26徐亚南温洪华骆宴施郭茂君张少坤祝群
徐亚南 温洪华 骆宴施 郭茂君 张少坤 祝群
近年来糖尿病发病率不断升高,有流行病学资料显示,中国成年人糖尿病的总体患病率约为11.2%[1]。糖尿病肾脏病(DKD)是最常见的糖尿病微血管并发症之一[2],也是导致慢性肾脏病及终末期肾病的首要原因。DKD早期主要表现为微量白蛋白尿,如不及时干预,会逐步发展为大量白蛋白尿,进而引起慢性肾衰竭,严重影响患者的生活质量及生存期[3]。胆汁酸是胆固醇在肝脏分解及肠肝循环中的代谢产物。已有研究发现,胆汁酸在糖尿病患者糖脂代谢中扮演重要角色。初次诊断的2型糖尿病(T2DM)患者胆汁酸水平与胰岛功能呈正相关,与血脂水平呈负相关[4]。此外血清总胆汁酸水平增高是老年DKD的保护因素[5]。然而,胆汁酸种类繁多,本研究主要观察T2DM患者血清胆汁酸谱与DKD的相关性,并探讨可能的机制,为DKD的防治探索新的作用靶点。
对象与方法
1.对象:2019年1月~2020年12月在我科就诊的T2DM患者383例,根据DKD的临床诊断标准[1],将其分为DKD组[估算的肾小球滤过率(eGFR)≥60 ml·min-1·(1.73 m2)-1伴尿白蛋白/肌酐比值(ACR)≥30 mg/g,132例]和无DKD(NDKD)组[eGFR≥60 ml·min-1·(1.73 m2)-1伴ACR<30 mg/g,251例]。排除标准:(1)1型糖尿病、其他妊娠期糖尿病及特殊类型糖尿病;(2)原发性或其他原因引起的肾脏病变;(3)严重心、肺、脑损害及明显肝功能异常;(4)恶性肿瘤或其他重要器官严重疾病;(5)影响胆红素代谢的肝脏或血液系统等疾病。本研究经我院伦理委员会审核批准。
2.方法
(1)一般资料收集:收集所有患者的一般资料,包括性别、年龄、BMI、血压[收缩压(SBP)、舒张压(DBP)]及糖尿病病程。
(2)实验室检查指标:包括患者入院时的空腹血糖(FPG)、糖化血红蛋白(HbA1c)、血尿素氮(BUN)、血肌酐(SCr)、血尿酸(SUA)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)、ALT、AST、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、ACR、胆汁酸谱[胆酸(CA)、脱氧胆酸(DCA)、鹅脱氧胆酸(CDCA)、熊脱氧胆酸(UDCA)、石胆酸(LCA)、牛磺熊脱氧胆酸(TUDCA)]。

结 果
1.两组患者间一般资料及实验室检查指标比较:与NDKD组比较,DKD组患者年龄、SBP、糖尿病病程、BUN、SCr、SUA水平均升高,TBIL、DBIL、IBIL、UDCA、LCA水平均降低,差异有统计学意义(P<0.05)。两组患者BMI、DBP、FPG、HbA1c、ALT、AST、TC、TG、HDL-C、LDL-C、CA、DCA、CDCA、TUDCA比较差异均无统计学意义(P>0.05)。见表1。
2.T2DM患者ACR与临床及实验室检查指标的相关分析:Pearson相关分析结果显示,T2DM患者ACR与年龄(r=0.11,P=0.04)、糖尿病病程(r=0.13,P=0.01)、BUN(r=0.27,P<0.01)、SCr(r=0.35,P<0.01)、SUA(r=0.11,P=0.03)均呈正相关。Spearman相关分析显示,T2DM患者ACR与TBIL(r=-0.11,P=0.03)、IBIL(r=-0.12,P=0.02)、UDCA(r=-0.10,P=0.04)、LCA(r=-0.11,P=0.04)均呈负相关。
3.发生DKD的logistic回归分析:以是否发生DKD为因变量,以与ACR有相关性的临床指标为自变量,行二元logistic回归分析结果显示,年龄、糖尿病病程、SCr、UDCA、LCA为发生DKD的独立影响因素(P<0.05)。其中年龄、糖尿病病程、SCr为发生DKD的危险因素,而UDCA、LCA为发生DKD的保护因素。见表2。
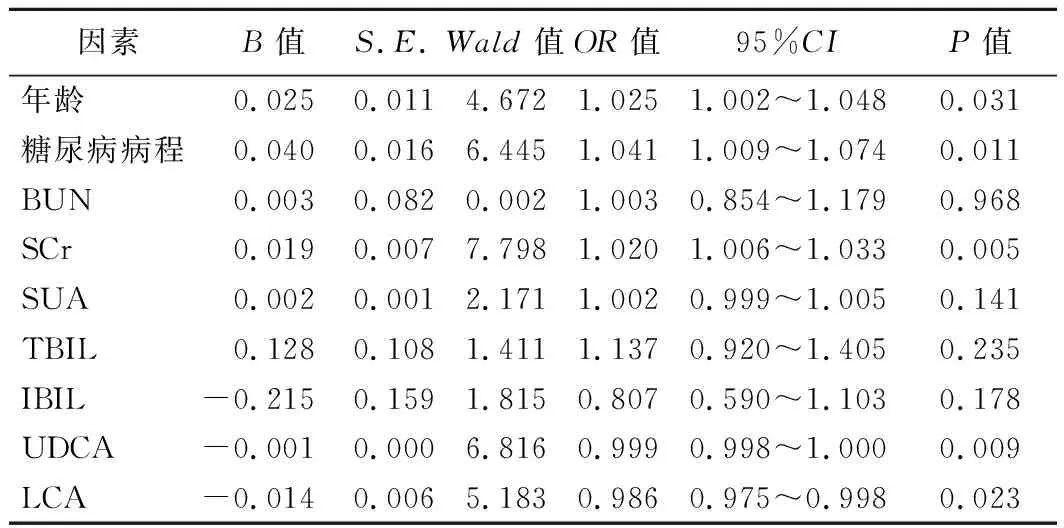
表2 发生DKD的logistic回归分析
讨 论
DKD约占糖尿病的40%,是全球慢性肾脏病及终末期肾病的主要原因[6]。DKD的主要特征为持续性白蛋白尿和(或)肾小球滤过率进行性下降[7]。DKD发生的危险因素包括年龄、糖尿病病程、血糖血压血脂异常、尿酸增高、肥胖(尤其是腹型肥胖)、不良生活习惯等[1,8]。本研究发现,年龄、糖尿病病程及SCr为发生DKD的危险因素,与既往研究结果一致[4,9];而未发现HbA1c与DKD的相关性,可能与本研究纳入住院患者普遍血糖水平较高有关。近年研究发现,胆汁酸与DKD防治密切相关,并成为糖尿病领域研究热点之一。相关临床研究结果表明,血清总胆汁酸水平增高是老年DKD的保护因素[5,9],多项基础研究也发现UDCA、TUDCA可减轻糖尿病小鼠模型的肾脏损害[10-11]。本研究进一步测定eGFR≥60 ml·min-1·(1.73 m2)-1伴ACR≥30 mg/g DKD患者的胆汁酸谱,发现胆汁酸谱中的UDCA、LCA水平降低与DKD发生有关,且是其独立保护因素。于家伟等[12]的研究也发现应用UDCA治疗DKDⅢ期患者可显著减少其尿白蛋白排泄水平。而本研究结果也为使用胆汁酸临床干预DKD提供一定依据。胆汁酸是胆固醇的代谢产物,在糖尿病患者糖脂代谢中起重要作用。本研究中两组患者TC、TG、HDL-C、LDL-C、CA、DCA、CDCA、TUDCA比较差异均无统计学意义,可能是本研究患者糖尿病病程均较长,均存在较明显的糖脂代谢紊乱,且胆汁酸谱中主要是UDCA、LCA发挥与DKD相关的作用。另外,本研究中两组患者TBIL、DBIL、IBIL比较差异均有统计学意义,其中Spearman相关分析显示TBIL、IBIL与ACR存在相关性,但logistic回归分析结果显示其并非DKD的独立影响因素,可能与本研究样本量偏少,未完全排除其他混杂因素影响有关。
近年来研究结果显示,内质网应激是糖尿病微血管并发症及DKD的重要发病机制之一,而降低内质网应激可能会阻碍肾脏疾病的进展[13]。本课题组的既往研究结果证实TUDCA可通过减轻内质网应激缓解棕榈酸诱导的胰岛β细胞凋亡,从而发挥细胞保护作用[14]。UDCA是由肠道菌群转化DCA形成的次级胆汁酸,也是TUDCA的水解产物,主要参与脂质代谢。一项关于糖尿病db/db小鼠的动物试验研究表明,UDCA可预防内质网应激诱导的糖尿病肾病足细胞凋亡,降低尿白蛋白排泄水平[15]。氧化应激增高也是DKD的另一关键发病途径[6]。相关研究结果发现UDCA除了可降低内质网应激外,还能通过缓解氧化应激改善糖脂代谢紊乱诱导的细胞及组织损伤[16]。LCA是一种由CDCA和UDCA通过肠道菌群转化形成的次级胆汁酸。相关研究结果表明,LCA可通过抑制氧化应激促进肠道Ca2+吸收[17],其是否通过改善氧化应激影响DKD尚需进一步的研究证实。此外,一项动物试验结果发现,用UDCA和LCA的混合物进行管饲可减轻由高脂饮食喂养小鼠的肥胖、高血糖和肝脂肪变性[18]。因此,UDCA和LCA可通过其抗氧化、抗凋亡和抗自噬特性来降低氧化应激损害,为肥胖、糖尿病及其并发症的防治提供可能[19]。
综上所述,本研究纳入尚处于疾病早期的DKD患者,发现其血清胆汁酸谱中UDCA、LCA水平明显降低,且为发生DKD的独立保护因素。在DKD早期阶段进行干预通常可获得较好的治疗效果,而一旦进展至肾功能衰竭阶段则治疗效果欠佳。因此,本研究结果可能为DKD的早期治疗提供新的作用靶点和手段。但本研究为回顾性、单中心研究,且样本量偏少,未进一步统计分析非糖尿病对照组中胆汁酸谱与肾病发生的相关性,无法完全排除其他混杂因素影响。因此后续仍需开展较大样本研究进一步验证,以阐明UDCA、LCA保护DKD的具体机制。
