直肠神经内分泌肿瘤淋巴结转移的危险因素分析及内镜切除方式比较
2022-10-26郑秀丽姚志原吴明利尔丽绵李胜棉
郑秀丽,姚志原,吴明利,尔丽绵,李胜棉
1.河北医科大学第四医院内镜科,河北 石家庄 050035;
2.河北医科大学第四医院消化内科,河北 石家庄 050035
随着结肠镜检查的普及,直肠神经内分泌肿瘤(rectal neuroendocrine neoplasm,R-NEN)的检出率越来越高[1]。据报道,R-NEN的发病率在所有NEN中增长最快,占所有NEN的29.6%,成为中国第二大常见NEN[2]。淋巴结转移是恶性肿瘤的重要标志,是否有淋巴结转移对治疗的选择至关重要。因此,研究淋巴结转移及其相关因素对R-NEN的临床诊治具有重要意义。
目前临床上对于局限于黏膜层或黏膜下层的、小的、无淋巴结转移的R-NEN,可以选择内镜下切除[3],但是还没有确切的内镜治疗适应证。本文通过回顾性分析R-NEN的临床病理学特征,探讨其淋巴结转移的危险因素,并比较不同内镜治疗方法的安全性和有效性,探索内镜治疗R-NEN的适应证,希望能为R-NEN的临床诊治提供依据。
1 资料和方法
1.1 临床数据收集
本研究纳入2007年2月—2020年12月在河北医科大学第四医院确诊并手术治疗的R-NEN患者。排除标准:①R-NEN合并直肠其他类型恶性肿瘤的病例;②R-NEN合并其他部位恶性肿瘤的病例;③临床资料不全的病例。本研究已获得河北医科大学第四医院伦理委员会的批准(2021KS002)。
1.2 转移性淋巴结的判断标准
对于进行根治性手术切除和淋巴结清扫的患者,淋巴结转移情况由术后病理学检查确定。对于进行过局部切除而未行淋巴结清扫的患者,采用计算机体层成像(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)对淋巴结转移情况进行评估。影像学对转移性淋巴结的诊断参考直肠腺癌的诊断标准:①淋巴结大小标准,圆形淋巴结短轴直径大于8 mm,卵形淋巴结短轴直径大于10 mm;②形态异常,轮廓和边缘不规则,边界不清,内部回声或信号强度不均匀[4]。
1.3 病理学诊断
根据2019年世界卫生组织消化系统肿瘤分类第5版[5]确定肿瘤的病理学分类情况。NEN分为分化好的神经内分泌瘤(neuroendocrine tumor,NET)(G1、G2、G3)、分化差的神经内分泌癌(neuroendocrine carcinoma,NEC)(包括大细胞NEC、小细胞NEC)和混合性神经内分泌-非神经内分泌肿瘤(mixed neuroendocrine-nonneuroendocrine neoplasm,MiNEN)。
对于内镜下切除的组织标本,还需要评估侧切缘、基底切缘及浸润深度等。内镜整块切除定义为在内镜下将整个肿瘤切除成1块。病理学完全切除定义为显微镜下侧切缘或基底边缘无肿瘤残留。不完全切除是指未达到病理学完全切除。
1.4 肿瘤大小的判断标准
对于手术前行超声内镜(endoscopic ultrasonography,EUS)检查的患者,肿瘤大小根据EUS结果记录。对于未行EUS检查的患者,肿瘤大小根据术后病理学检查结果记录。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析肿瘤大小与淋巴结转移的关系。
1.5 内镜下套帽辅助黏膜切除术(endoscopic mucosal resection with cap,EMR-c)和内镜下黏膜下剥离术(endoscopic submucosal dissection,ESD)过程
EMR-c和ESD均由工作7年以上的专业内镜医师完成。术前签署内镜手术治疗知情同意书。
1.6 统计学处理
使用SPSS 25.0软件对数据进行统计学分析。定量资料以或区间中位数表示,采用t检验进行分析。分类资料以n(%)表示,采用χ2检验或Fisher确切概率法进行分析。淋巴结转移的相关因素采用二元logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 患者的一般临床资料
本研究共收集220例R-NEN患者,根据排除标准排除30例,最终共纳入190例R-NEN患者,年龄20~78岁,中位年龄52岁。其中,152例(80%)患者行内镜下肿瘤切除术(包括钳除2例、常规EMR 28例、EMR-c 70例、ESD 58例),14例(7.4%)患者行经肛门肿瘤切除术,19例(10%)患者行根治性手术,5例(2.6%)患者因发生远处转移而行姑息性手术。肿瘤大小为(8.83±8.20)mm。
2.2 肿瘤大小与淋巴结转移的分析
根据ROC曲线,将肿瘤大小12.5 mm定义为预测淋巴结转移的截断值,其灵敏度为88.2%,特异度为95.4%,曲线下面积(area under curve,AUC)为0.974(图1)。以肿瘤大小12.5 mm为界线对肿瘤进行分层,比较淋巴结转移的风险。

图1 淋巴结转移与肿瘤大小关系的ROC曲线分析Fig.1 ROC curve analysis on the relationship between lymph node metastasis and tumor size
2.3 术后病理学检查结果
190例R-NEN患者中,152例(80%)为NET G1,23例(12.2%)为NET G2,2例(1%)为NET G3,11例(5.8%)为NEC,2例(1%)为MiNEN。
2.4 淋巴结转移的危险因素分析
190例R-NEN患者中,有17例发生淋巴结转移,总体转移率为8.9%(17/190),且均行外科手术治疗。
单因素分析结果显示,淋巴结转移率在肿瘤大小(P<0.001)、淋巴管血管侵犯(P<0.001)及Ki-67增殖指数(P<0.001)方面,组间差异有统计学意义,这些因素是淋巴结转移的危险因素(表1)。多因素分析结果显示,肿瘤大小≥12.5 mm(OR=69.081,95%CI:11.385~419.155,P<0.001)和淋巴管血管侵犯(OR=11.732,95% CI:1.028~84.567,P=0.015)是淋巴结转移的独立危险因素(表 2)。
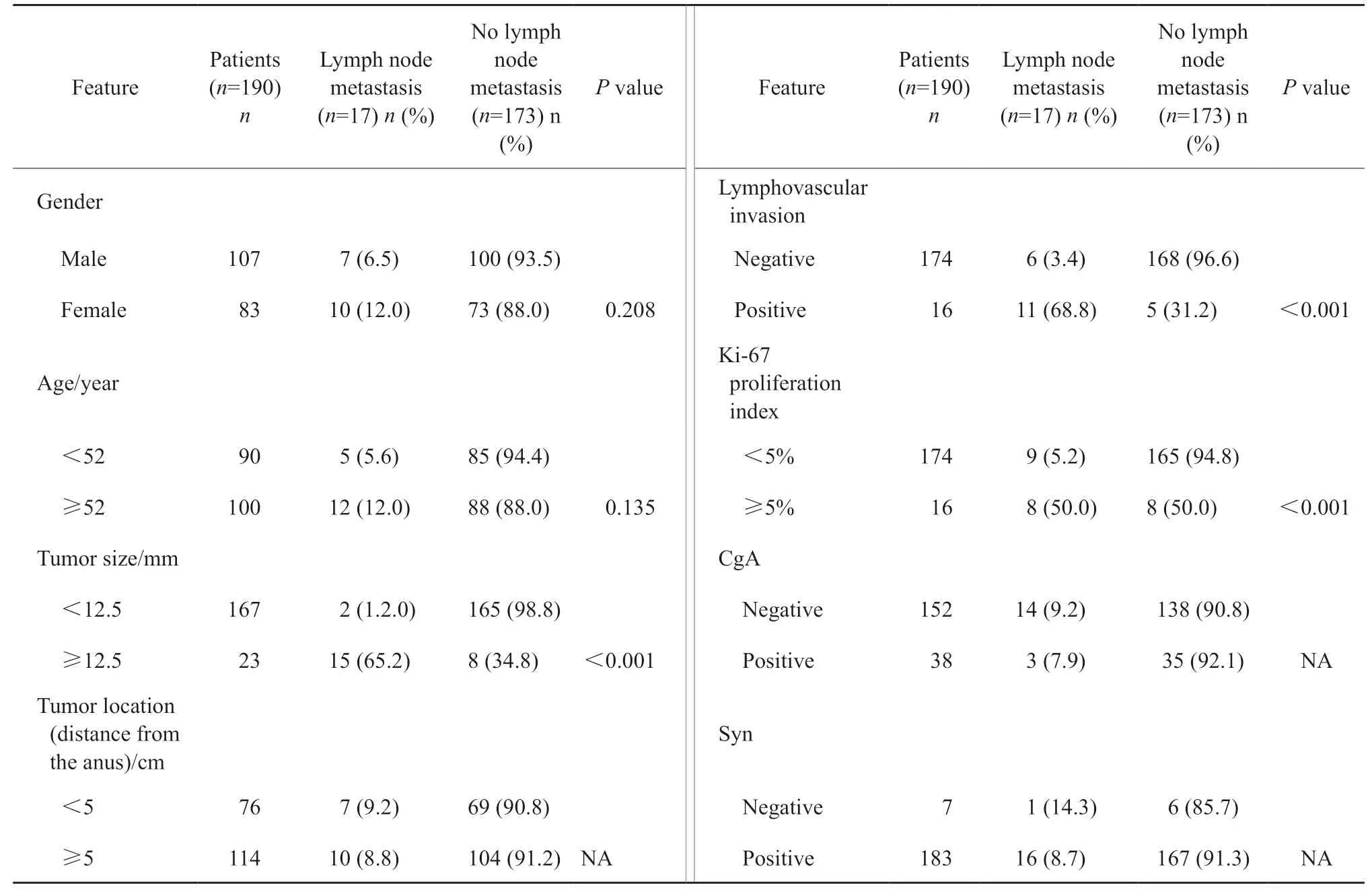
表1 R-NEN淋巴结转移的临床病理学特征Tab.1 Clinicopathological features of lymph node metastasis in R-NEN
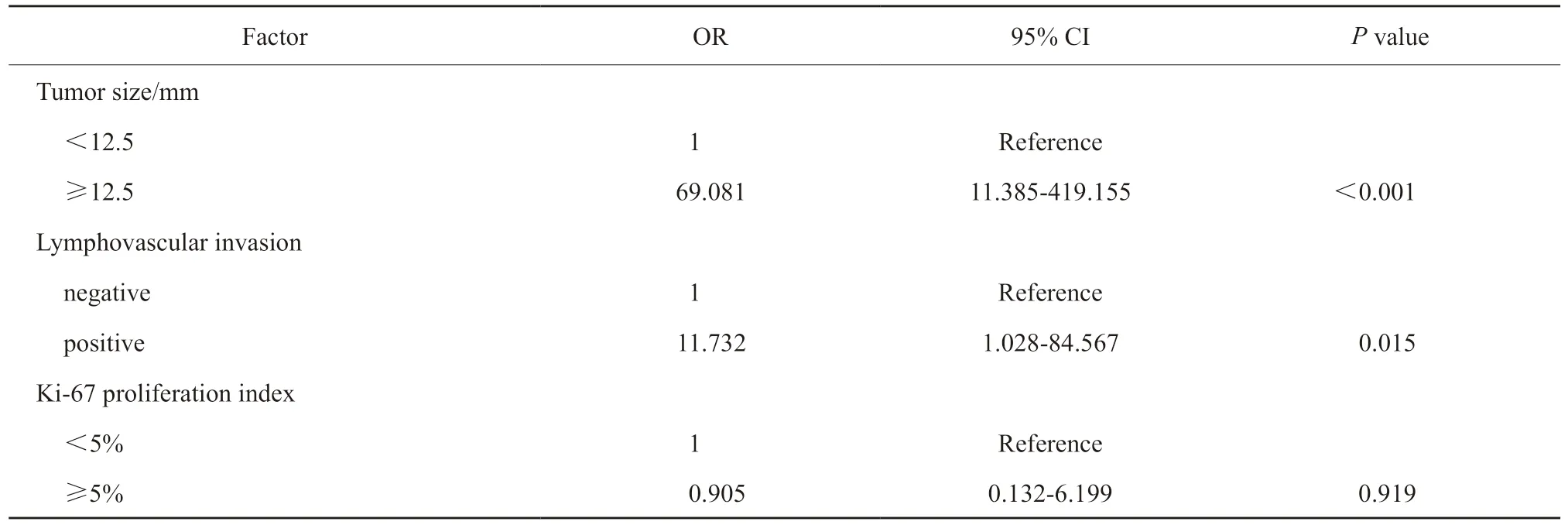
表2 淋巴结转移的多因素分析Tab.2 Multivariate analysis of factors for lymph node metastasis
2.5 内镜治疗患者的一般临床资料
将上述研究中肿瘤<12.5 mm的患者纳入内镜切除方式比较的研究,因为内镜切除和常规EMR切除的肿瘤无法准确判断边缘情况,故被排除在外,最终共纳入114例患者,年龄20~69岁,中位年龄55岁。
2.6 EMR-c组与ESD组的比较
本研究共切除114个R-NEN,其中EMR-c切除60个,ESD切除54个(图2、3)。术前评估为T1N0M0。EMR-c组与ESD组在年龄、性别、病变大小、病变部位、病理学分级及EUS等方面的组间差异均无统计学意义(P>0.05,表3)。
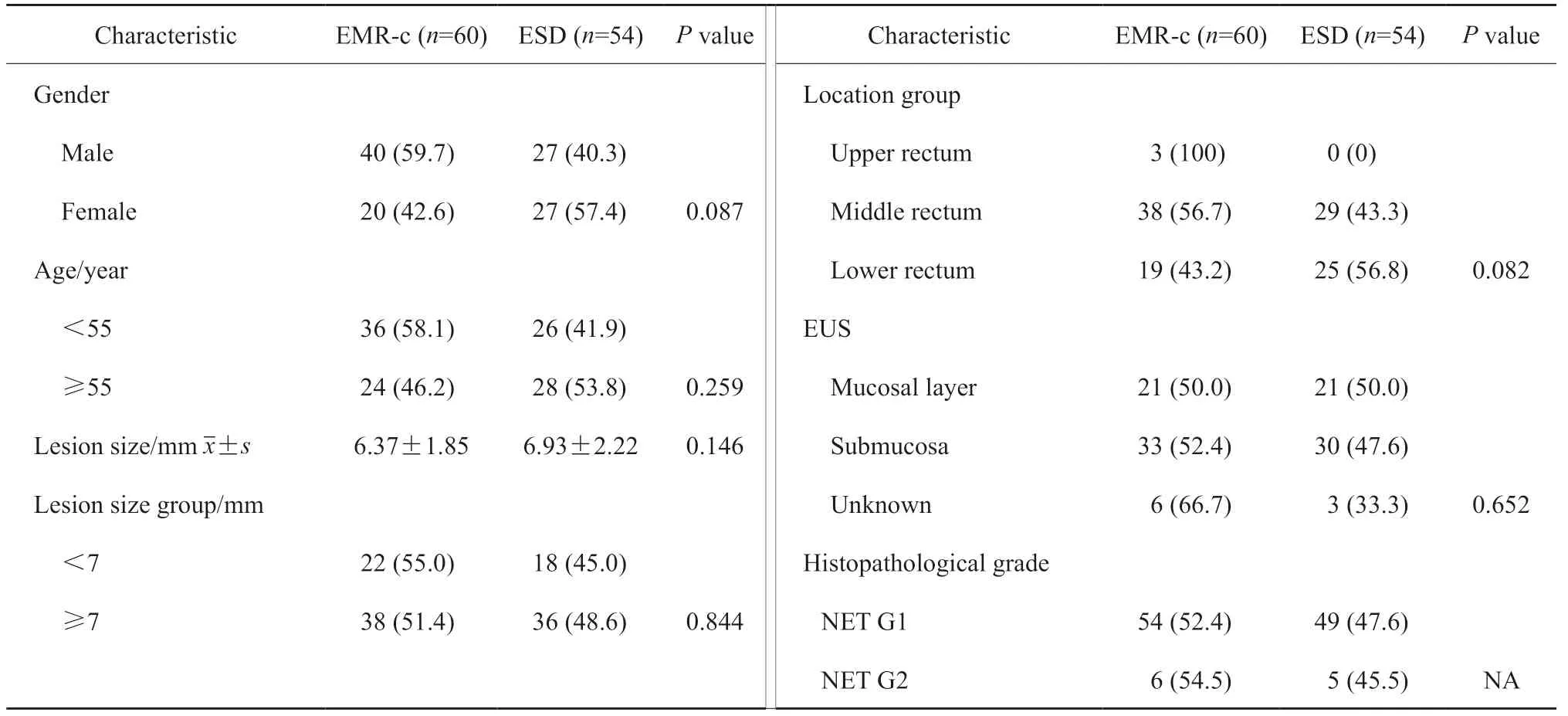
表3 内镜治疗患者和肿瘤的基线特征Tab.3 Baseline characteristics of patients and tumors[n(%)]
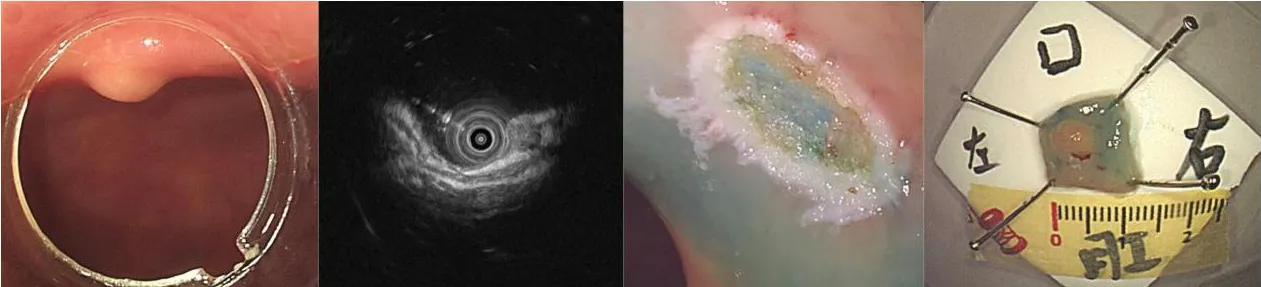
图2 EMR-c的手术过程Fig.2 The procedure of EMR-c
在手术的临床效果方面,EMR-c组的手术时间明显短于ESD组[(10.23±1.99)minvs(24.78±8.09)min,P<0.001,表4]。两组在内镜整块切除率(98.3%vs100%)、病理学完全切除率(88.3%vs77.8%)和并发症发生率(3.3%vs3.7%)方面差异无统计学意义(P>0.05)。EMR-c组有2个病灶出现术后出血,采用钛夹止血。ESD组有2个病灶发生穿孔,钛夹闭合后保守治疗有效。在所有病灶中,19个病灶未实现病理学完全切除。
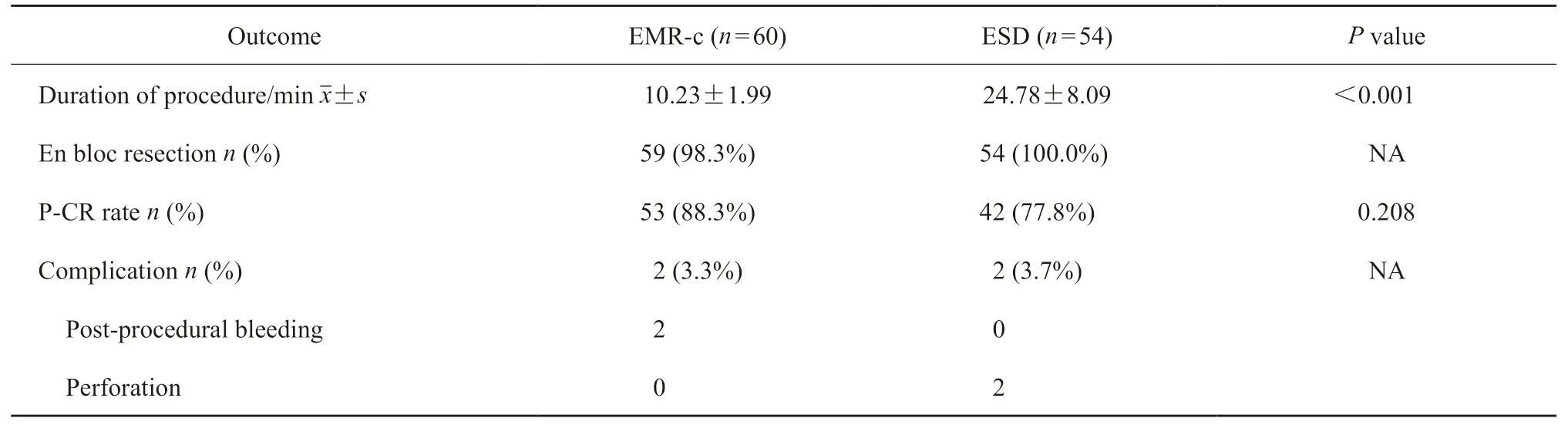
表4 EMR-c和ESD的临床结果比较Tab.4 Clinical outcomes of EMR-c and ESD
2.7 随访结果
在病理学不完全切除的病例中,仅有1例患者接受了额外的外科手术,手术后病理学检查未发现残余肿瘤;其余患者均选择定期随访。随访期间,24例患者失访。共成功随访90例患者,其中EMR-c组48例,ESD组42例。随访时间为16~134个月。在随访期间,两组患者均无局部复发或转移。

图3 ESD的手术过程Fig.3 The procedure of ESD
3 讨论
2015年的美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[3]指出,R-NEN的大小应作为选择治疗和监测策略的主要标准。<1 cm的病灶建议内镜切除或局部切除,>2 cm的病灶建议手术切除。介于两者之间的R-NEN没有明确的治疗建议。目前,对于10~20 mm肿瘤的治疗策略仍存在争议[6],有人建议行根治性手术切除,也有人建议行内镜下切除或经肛门切除,采取何种治疗的关键在于淋巴结是否受累。
以往研究[7]表明,R-NEN发生转移的病例仅占所有病例的4%~18%。本研究中,R-NEN的淋巴结转移率是8.9%。肿瘤大小与淋巴结转移风险密切相关,当肿瘤<10 mm时,肿瘤通常局限于黏膜下层以上,目前所报道的淋巴结转移率为1%~7%[8],20 mm以上的肿瘤,其转移率高达60%~80%[9],介于两者之间的肿瘤淋巴结转移率为20%~40%[10]。但是目前的研究并未给出肿瘤大小分组的截断值。在本研究中,当把肿瘤大小12.5 mm作为截断值时,淋巴结转移的灵敏度、特异度和AUC分别为88.2%、95.4%和0.974,提示可以用12.5 mm作为区分肿瘤大小的截断值。本研究中,当肿瘤≥12.5 mm时,淋巴结转移率为65.2%,远高于肿瘤<12.5 mm时的1.2%。此外还得出肿瘤大小≥12.5 mm是淋巴结转移的独立危险因素。肿瘤大小可在EUS下测量出较为准确的数值,因此在临床工作中,也许可以在术前评估中将肿瘤≥12.5 mm作为选择合适手术入路的基本变量。对于≥12.5 mm的R-NEN,应考虑存在较高的淋巴结转移率,需要谨慎选择手术方案。当然,这还需要前瞻性研究的数据来验证,并指导临床实践中R-NEN患者的治疗决策。
由于大部分R-NEN起源于黏膜深层或黏膜下层,要保证病理学完全切除比较困难,因此必须选择一种安全有效的切除方法。关于R-NEN的内镜治疗方法仍有争议,目前已有多种治疗策略[11-12],包括常规EMR、EMR-c、ESD等。EMR-c是在常规EMR的基础上改良的一种技术,它通过将病变吸引至透明帽内,然后再将病变切除,能够提高病变的完全切除率,既简便又高效。ESD作为近些年新兴的内镜治疗方式,病变切除层次更深,更有可能保证病变的整块切除率,但是其技术难度较高,手术耗时较长,并发症发生率较高。有研究[13]证实,与常规EMR相比,EMR-c完整切除率高,并且相对ESD来说,手术时间更短,操作较简单。本研究选择肿瘤<12.5 mm的患者进行内镜切除方式比较,结果表明,对于<12.5 mm的R-NEN,EMR-c和ESD均是安全有效的方法。两组病理学完全切除率及并发症发生率相似,且EMR-c组的手术时间明显短于ESD组。
本研究19例未实现病理学完全切除的患者中,只有1例追加了外科手术,切除标本中未发现肿瘤。其余18例患者均定期随访,至今未见复发或转移。目前对于内镜治疗术后切缘阳性者,可考虑密切随访、外科手术或再次行ESD。若发现有较高转移风险因素存在时,通常需考虑追加外科手术[14]。
本研究存在一定的局限性。首先,本研究为单中心回顾性研究,可能会导致选择偏倚。其次,手术不是由同一名医师完成的,技术水平的差异也不可避免。因此,需要开展多中心、前瞻性的随机研究,以进一步探讨R-NEN淋巴结转移的危险因素,并评估内镜切除方法的总体效能。
综上所述,肿瘤大小≥12.5 mm和淋巴管血管侵犯是R-NEN患者淋巴结转移的独立危险因素。对于<12.5 mm且无淋巴结转移的R-NEN来说,EMR-c和ESD均是安全有效的治疗方法。
利益冲突声明:所有作者均声明不存在利益冲突。
