肝动脉栓塞术治疗囊性神经内分泌肿瘤肝转移的疗效及安全性分析
2022-10-26刘文生刘海宽陈洛海范文哲李家平
禹 航,刘文生,张 宁,刘海宽,陈洛海,姚 望,范文哲,李家平,陈 洁,王 于
1.中山大学附属第一医院肿瘤介入科,广东 广州 510000;
2.复旦大学附属肿瘤医院胰腺外科,复旦大学上海医学院肿瘤学系,复旦大学胰腺肿瘤研究所,上海市胰腺肿瘤研究所,上海 200032;
3.中山大学附属第一医院消化内科,广东 广州 510080;
4.复旦大学附属肿瘤医院神经内分泌肿瘤中心,头颈及神经内分泌肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032
神经内分泌肿瘤(neuroendocrine neoplasm,NEN)起源于全身神经内分泌细胞,是一种罕见的且具有较强异质性的肿瘤。2020年的统计数据[1]显示,NEN发病率已上升至4.10~5.93/100 000。美国监测、流行病学和最终结果(Surveillance,Epidemiology,and End Result,SEER)数据库资料[2]显示,1973—2012年的NEN发病率增长了近6.4倍。
NEN发病通常较为隐匿,40%~50%的NET患者在首诊时已出现肝转移[3]。一旦发生远处转移,患者的预后将受到严重影响,中位总生存期(median overall survival,mOS)为无远处转移患者的1/2甚至更低[2]。多数NEN肝转移(NEN liver metastasis,NENLM)的影像学表现为强化明显的富血供肿瘤,同时也不乏其他类型的NENLM,如乏血供型肝转移病灶及更罕见的囊性肝转移病灶[4-6]。对不可手术切除的NENLM而言,在联合全身用药的基础上,肝动脉栓塞术(transarterial embolization,TAE)是肝内病灶目前公认的主要治疗手段[3,7-9]。囊性NENLM(cystic NENLM,cNENLM)的局部治疗报道很少,主要以外科治疗为主[10-11]。目前的研究[6,12]指出,富血供型及乏血供型的NENLM都适合采用TAE治疗,而对于cNENLM的TAE治疗则尚未见报道。本文总结了中山大学附属第一医院及复旦大学附属肿瘤医院接受TAE治疗的cNENLM患者,分析其疗效及安全性。
1 资料和方法
1.1 临床资料
2016年1月—2022年1月共440例NENLM患者在中山大学附属第一医院及上海复旦大学附属肿瘤医院行TAE,其中10例为cNENLM。10例患者均符合下列标准:①病理学穿刺活检或外科术后标本经病理学检查证实为NET;②术前、术后均完善增强计算机体层成像(computed tomography,CT)、正电子发射CT(positron emission tomography and CT,PET/CT)等影像学检查,并按照Qian等[13]提出的标准,影像学检查可见肝内多发囊性病灶(典型病例见图1);③多学科团队(multidisciplinary team,MDT)讨论后无外科手术指证,并按照欧洲神经内分泌肿瘤学会等指南[3,7-9]选择全身治疗;④体力状况(performance status,PS)评分为0~1分;⑤心、肺、肝、肾功能可耐受。排除标准:①术前、术后影像学资料缺失:②心、肺、肝、肾功能无法耐受手术;③既往接受过肝脏局部治疗。
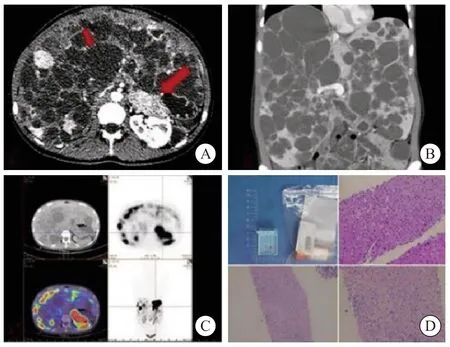
图1 cNENLM患者图像Fig.1 Image of cNENLM patient
1.2 治疗方法
1.2.1 全身治疗
经过MDT讨论,并根据指南[3,7-9]中全身治疗药物的推荐,共9例患者使用长效生长抑素类似物Sandostatin LAR治疗,另1例患者接受CAPTEM(卡培他滨+替莫唑胺)方案化疗。
1.2.2 手术方法
通过Seldinger法穿刺右股动脉,插管后置管肝动脉造影,充分了解肝内肿瘤血供,再使用微导管超选至肿瘤供血血管,在数字减影血管造影(digital subtraction angiography,DSA)透视下依次注入40~120 μm Embosphere(美国Merit Medical System公司)、90~120 μm聚乙烯醇(美国Cook Medical公司)颗粒进行栓塞。肿瘤供血区域肝动脉二级分支血流停滞,即5个心动周期对比剂不廓清时达到栓塞终点。术前1 h至术后48 h,以短效生长抑素类似物静脉持续滴注,并在术后予止吐、止痛等对症支持治疗。每4~6周复查后重复TAE治疗,直至肝内病灶完全缓解(complete response,CR)、疾病进展(progressive disease,PD)或无明显疗效。
1.3 疗效评价方法
本研究疗效观察为客观缓解率(objective response rate,ORR)及无进展生存时间(progression-free survival,PFS),PFS定义为第1次TAE的时间到肿瘤进展或死亡的时间。
影像学基线资料为患者术前7 d内的胸腹增强CT或磁共振成像(magnetic resonance imaging,MRI)检查,术后4~6周内以相同影像学检查方式复查。由放射科高年资医师对比前后影像学资料,并依据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1[14]对囊性肝转移病灶进行疗效评价。最终评价结果分为CR、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)及PD。统计疗效数据后计算ORR及疾病控制率(disease control rate,DCR)。ORR=(CR+PR)/总例数×100%,DCR=(CR+PR+SD)/总例数×100%。
术后并发症根据美国国立癌症研究所发布的常见不良事件评价标准(common terminology criteria for adverse events,CTCAE)v5.0[15]进行评估。
2 结果
本研究的患者年龄为39~62 岁,平均(53.5±6.25)岁,其中男性5例,女性5例。原发部位:直肠3 例(30.0%),胰腺2 例(20.0%),胃、肾脏、盆腔、腹膜后及睾丸各1例(50.0%)。具体临床资料见表1。
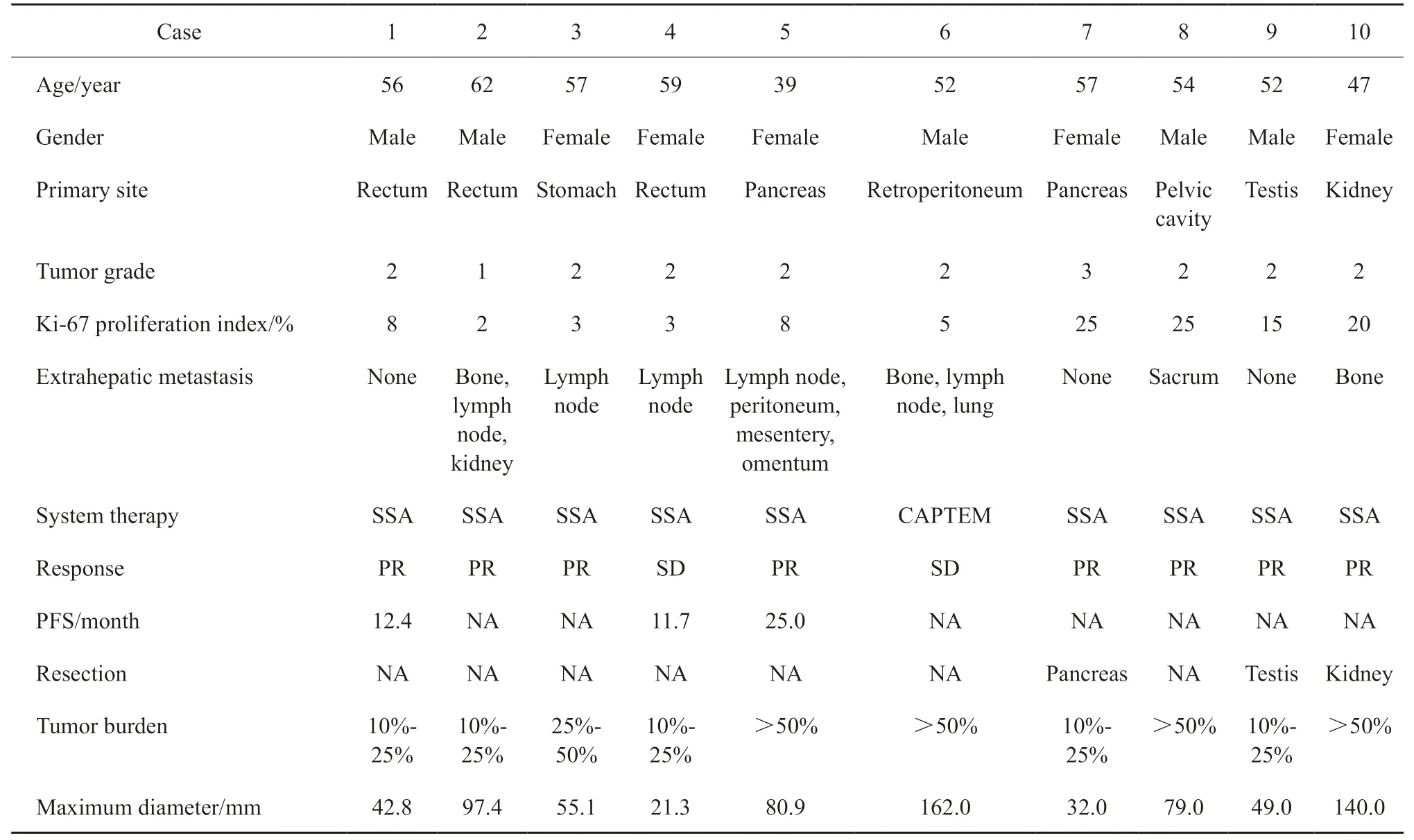
表1 患者的临床资料Tab.1 Clinical characteristic of patients
本研究中10例cNENLM患者的病理学分级为:1例G1,7例G2,2例G3。10例患者共行31次TAE治疗,人均(3.00±1.48)次,术中DSA如图2所示。10例患者的术前影像学检查均显示肝内多发囊性病灶,部分伴有实性转移。DSA可见肝内各级血管较稀疏,呈抱球状,可见部分结节状肿瘤染色。经TAE治疗后,DSA可见肝内血管稀疏、血管抱球状好转,肿瘤染色消失。术后影像学复查可见肝内囊性病灶较前缩小、减少(图3)。
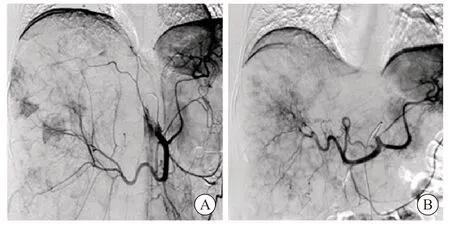
图2 DSA图像Fig.2 DSA image
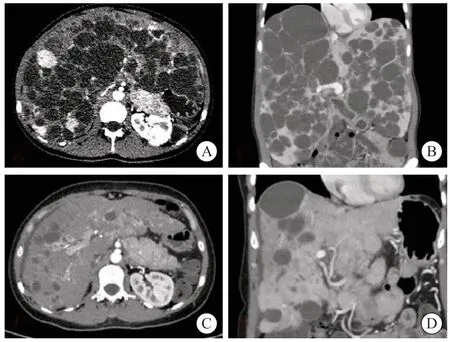
图3 TAE前后CT图像Fig.3 CT image before and after TAE
本研究的随访时间为78个月。依据RECIST 1.1的疗效评价结果显示,CR 0例,PR 8例,SD 2例,PD 0例,ORR为80.0%,DCR为100.0%。在随访过程中共3例达到PFS,分别为11.7、12.4和25.0个月,其余患者尚未达到PFS,所有患者均未达到OS。
所有患者的术后并发症均为Ⅰ/Ⅱ级,无严重术后并发症(表2)。均为发热、肝区疼痛、恶心呕吐、一过性肝功能损伤等常见TAE后不良反应,对症处理后好转出院。
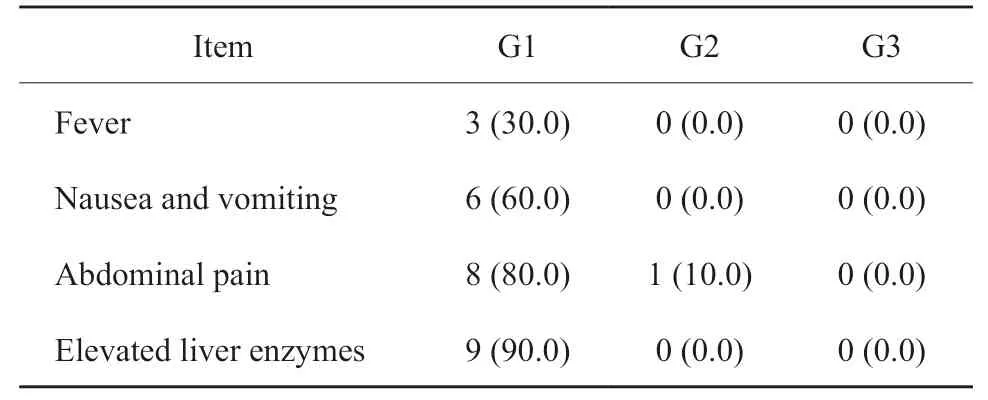
表2 TAE治疗后的不良反应Tab.2 Adverse events after TAE treatment[n(%)]
3 讨论
NEN是一种低度恶性的肿瘤,起病隐匿,因此大部分NEN患者在首诊时已出现肝脏转移。当全身肿瘤负荷主要位于肝脏时,肝转移瘤的局部治疗占据重要地位[16-17]。NENLM的影像学表现多样,70%的NENLM表现为富血供,12%表现为乏血供[4],而cNENLM仅见于少数案例报告。本研究中的cNENLM同样罕见,同期共440例经TAE治疗的NENLM患者中,仅10例为cNENLM。影像学上将囊性病灶定义为:①囊性病灶是一种大部分由类水样内容物组成的、边界清楚的无强化病灶;②由于病灶内容物的多样性,其密度或信号可以与纯水有轻微不同[13]。研究指出囊性转移瘤的成因包括:①富血供肿瘤生长速度超出血液可供应范围,导致肿瘤坏死;②黏液腺癌产生大量黏液蛋白;③全身治疗或局部治疗导致坏死[13]。本研究中cNENLM的产生原因多为第1种,所有患者均为首诊,已排除术前全身治疗或局部治疗。既往文献[10-11]报道过经手术切除的cNENLM,术后标本病理学检查可见囊壁由肿瘤细胞构成,囊内可见血性内容物,CT可见部分囊肿壁不同程度强化。本研究中的囊性转移瘤病灶CT值平扫为(20.98±4.80)HU,动脉期为(22.93±4.60)HU,门脉期为(22.75±4.50)HU,病灶基本不强化。
cNENLM需要与肝内良性囊肿相鉴别。cNENLM原发部位多样,本研究的10例患者中3例来自直肠,2例来自胰腺,其余分别来自胃、肾脏、腹膜后、盆腔及睾丸。囊性转移可表现为肝内单发或多发的囊性病灶,增强后囊壁可见强化。生长抑素受体在PET/CT中可见囊性转移病灶囊壁代谢浓聚。而肝囊肿的影像学检查中,囊壁无强化,生长抑素受体在PET/CT中也无代谢浓聚。囊性转移瘤具有侵袭性,随访过程中会进行性增大,而肝囊肿则通常进展缓慢,因此对比既往影像学检查也可佐证cNENLM。为进一步明确诊断,穿刺取囊壁组织进行病理学检查可作为确诊囊性肝转移的金标准。另外,在经过NET相关治疗后,肝内囊性病灶较前缩小也可以反推出其为囊性转移。
既往研究[18]表明,对于无法手术切除肝内转移的患者而言,可以安全快速降低肝内肿瘤负荷的TAE是重要的治疗手段。前期研究[19]发现,TAE在G1/2患者中,总体ORR达到78.4%,PFS为13.6个月。目前对于cNENLM的TAE治疗效果如何尚无定论,但在本研究中,cNENLM在经过TAE治疗后,ORR达到80.0%,DCR达到100.0%。10例患者中3例达到PFS,最长为25.0个月,其余7例PFS尚未达到。囊性转移TAE疗效与前期研究中NENLM的TAE疗效相近,因此TAE治疗在囊性肝转移中的疗效与实性肝转移相似。目前所见的cNENLM治疗报道[10-11]中,其病灶多为单发或总体负荷较小,这些患者多采用手术切除来减瘤。本研究中的患者多为两叶多发囊性转移,无法进行手术根治性切除,因此TAE适用于这部分患者的局部治疗。
cNENLM患者TAE的术后常见不良反应为发热、肝区疼痛及肝功能一过性损伤,对症处理后均可好转。所有患者均未出现严重术后并发症。
综上所述,本研究440例NENLM患者接受介入治疗,cNENLM共10例,仅占2.3%,为罕见NET肝转移瘤表现,全身治疗联合TAE治疗的总体疗效显著,ORR与实性转移瘤相仿,术后并发症可控,因此TAE可作为cNENLM患者有效且安全的减瘤手段。
利益冲突声明:所有作者均声明不存在利益冲突。
