例析科学探究题的解题流程
2022-10-26张正凯
张正凯
(甘肃省白银市平川中恒学校)
高考对于学生的科学探究能力要求越来越高,学生需要具备基本的解题素养,在掌握试题的基础上,利用一定的解题流程逐步解答问题.科学探究类试题涉及的问题开放性较强,为学生学识和能力的展示提供了平台,但在解答此类试题时还是要遵循一定的流程,才能提高试题解答的质量和效率.
1 必备知识
科学探究类试题本质上是考查学生对元素及其化合物知识、化学反应原理的掌握情况,同时运用逻辑思维能力和创新意识对问题进行分析解决.笔者通过对近几年高考化学试题中的科学探究题进行分析,总结归纳出了解答此类试题需要具备的必备知识.首先,掌握一定的实验基础知识,高中化学知识中包含的基本实验操作有蒸发、结晶、过滤、升华、蒸馏、萃取、分液等,学生不仅要掌握这些操作的注意事项,还要知道常见物质的提纯、除杂等实验中使用的实验操作及常见误差分析等;其次,所掌握的化学知识要有较强的实践性,化学知识来源于生活生产也要应用于生活生产,在平时的学习中,学生要深化理解教材中化学实验的基本原理,并能据此对相关的陌生实验进行探究分析,能应用化学知识对实验方案提出改进或优化策略等;再次,在高中化学阶段要培养自身的实验素养,对定量实验能进行定量和定性的综合分析,既能有效提取解题信息,又能正确处理所涉及的数据,尽量降低实验分析过程中产生错误的概率;最后,要掌握规范的答题格式,正确使用化学术语,能体现出科学、等量、单一变量与对照性等实验原则,提高答案的逻辑性和科学性.
2 流程解读
在高考化学实验探究题中,试题的背景往往是一个化学问题或某种化学现象,在未知结果的情况下要求学生自主设计实验方案等进行探究,因此,解答此类试题的关键是了解整个实验探究的过程,或提出科学的假设并准确设计实验方案和预测实验现象及结果.实验探究类试题主要包括物质组成探究型、物质性质探究型及反应规律和原理探究型3种题型,随着新高考制度和核心素养的提出,试题的命题形式更加灵活多变,综合性和创新力度都有所加强,对学生的发散思维和迁移应用能力提出了较高的要求,是每年高考的必考题,但同时也是学生容易丢分的试题.
探究类试题即对未知事物进行科学探索,需要学生对未知进行大胆猜想和论证.首先,解读所给问题或情境,发现其中涉及的化学问题,进而明确试题的要求和涉及的反应原理;其次,联系相关化学知识,依据反应原理大胆提出科学合理的假设或猜想;再次,设计验证假设或猜想的实验方案,寻求假设或猜想正确与否的证据;然后,设计实施方案的具体实验操作步骤,并进行实验操作;最后,记录实验操作过程中的现象和数据,通过总结和分析得出实验结论.此外,除了以上流程,有的试题在最后还会涉及对实验方案的评价和反思,往往涉及误差分析或绿色化学等知识.学生在扎实掌握化学基础知识的基础上,依据以上流程解析试题,结合题给信息认真分析所设问题,必能提高解题的准确率.
3 例题精析
例某化学实验小组为了探究氨的还原性和氧化性,设计了如下实验方案.
实验1:探究氨气的还原性,实验装置如图1所示.

图1
已知:ⅰ.Mg(OH)2可代替消石灰与氯化铵在加热条件下反应,生成NH3和碱式氯化镁[Mg(OH)Cl];ⅱ.Cu2O呈红色,在酸性溶液中不稳定,歧化为Cu、Cu2+.
(1)装置A 中反应的化学方程式为_________,装置D 的作用是________.
(2)反应结束后,装置C 中的氧化铜完全转化为红色固体.为探究红色固体的成分,进行如表1所示实验探究.

表1
实验2:探究氨气的氧化性,实验装置如图2.
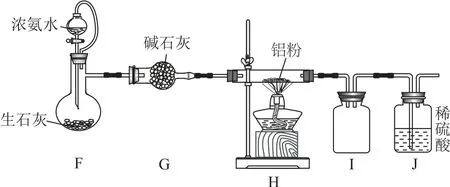
图2
已知:ⅲ.2Al+2NH32AlN+3H2;ⅳ.氯化铝性质稳定,基本不与水、酸反应,加热时溶于浓碱溶液产生NH3.按图2所示连接好装置,检查装置气密性,打开分液漏斗活塞,待装置中空气排尽后再点燃H 处酒精灯.
(3)用平衡移动原理解释装置F 中产生NH3的原因:_______.
(4)H 处反应完全时的现象为_________.
(5)将H 中固体冷却后移至烧杯中,加入_________溶解、_________(填操作)、洗涤、干燥,即可得到纯净的氮化铝.
解析由题意知,本题涉及探究氨的还原性和氧化性2个实验,在探究氨气的还原性实验中涉及的反应原理是氨气与氧化铜发生的氧化还原反应,通过观察盛有氧化铜的硬质玻璃管中的现象,以及称量硬质玻璃管在反应前后的质量变化进行验证,包括氨气的制取、干燥、尾气的收集等操作;而探究氨气的氧化性实验中涉及的反应原理是氨气与铝粉的氧化还原反应,通过观察盛有铝粉的硬质玻璃管中的现象进行验证,同样包括氨气的制取、干燥和尾气的收集等操作.实验过程中需要观察实验现象、记录实验数据,是一道定性和定量相结合的综合类探究题.考查的知识点包括化学方程式的书写、安全操作、平衡移动原理、实验分析、基本实验操作等.
(1)已知Mg(OH)2可代替消石灰与氯化铵在加热条件下反应,生成 NH3和碱式氯化镁[Mg(OH)Cl],故装置A 中发生反应的化学方程式为
装置D 是一个安全瓶,能防止倒吸.
(2)①常温下,与稀硫酸不发生反应的是铜.②溶液变蓝说明有CuSO4生成,则红色固体中一定含有Cu2O,可能含有Cu.③6.4g 固体是单质铜,n(Cu)=0.1mol.设10.4g红色固体中含有Cu、Cu2O 的物质的量分别为x、y,根据反应

(3)装置F中的反应物是浓氨水和生石灰,生石灰可与浓氨水中的水发生反应并放出热量,不仅降低了氨气的溶解度,还使NH3·H2O 发生分解反应生成NH3和H2O;此外,生石灰与水的反应还使得氨水中的溶剂减少,促使平衡NH3+H2O⇌NH3·H2O向左移动,有利于NH3的逸出.
(4)已知2Al+2NH32AlN+3H2,由于NH3极易溶于水,而H2难溶于水,反应过程中装置J中将观察到有气泡冒出,所以当反应进行完全时,装置J中将不再产生气泡.
(5)装置H 中的固体含有生成的氮化铝和没有反应的铝粉,氮化铝不溶于酸,因此可以选用稀盐酸或稀硫酸等将固体中的铝粉除去,再经过过滤、洗涤、干燥操作,即可得到纯净的氮化铝.
实验探究题在每年的高考中都会涉及,学生只要克服心理压力,在平时的学习和复习中储备一定量的基础知识,按照一定的解题流程,发挥自身的独立思考能力、发散思维能力、知识迁移能力和创新能力,就能在考场上赢得胜利,获得阶段性的成功.
(完)
