铈离子与焦磷酸根离子配位聚合物网络用于草甘膦快速荧光检测
2022-10-25王冬伟蒋建功刘雪科刘东晖周志强
张 强, 王冬伟,2, 蒋建功, 刘雪科,刘东晖*,, 周志强
(1. 中国农业大学 理学院,北京 100193;2. 农业农村部 农药检定所,北京 100125)
食品安全与人类健康息息相关,受到全世界广泛关注[1-2]。农药的大量使用导致其在环境与农作物中多有检出,所造成的农药残留问题不容忽视[3]。草甘膦是一种有机膦类除草剂,具有非选择性和广谱特性,作为世界上生产和使用最多的除草剂之一[4-6],在130 多个国家和100 多种作物中生产使用。然而,草甘膦的大量使用带来了环境问题,在许多国家的地表水中有所检出[7-8]。同时,有研究表明,土壤和饮用水中存在的草甘膦残留会对人体健康造成影响[9-10],可使乙酰胆碱酯酶不可逆失活,产生各种健康风险,如呼吸、心肌和神经肌肉功能障碍[4,11-12]。
由于草甘膦会给环境与人类健康带来潜在风险,因而研究其准确快速的检测方法显得十分必要。目前,包括高效液相色谱法 (HPLC)[13]、气相色谱-质谱法 (GC-MS)[14]、高效液相色谱-质谱法(HPLC-MS)[5]、离子色谱 (IC)[15]、毛细管电泳(CE)[16]和酶联免疫吸附试验 (ELISA)[17-18]在内的多种方法在草甘膦的检测中有所应用。尽管这些方法可以实现草甘膦的准确检测,但也存在局限之处,例如样品预处理费时费力、实验成本高等[11],无法满足原位、实时、快速检测的需要。在使用GC-MS 检测草甘膦时,还需要加入三氟乙酸酐-七氟丁醇等衍生化试剂与其反应才能进行检测[14]。因此,迫切需要开发出简单、快速的草甘膦检测方法。虽然灵敏度高、仪器简单、操作方便的荧光分析法可以较好地解决这一问题,然而,由于草甘膦分子中缺乏发色团和荧光团,从而限制了草甘膦荧光传感器的发展与应用[5]。
镧系元素离子,因具有特殊的电子结构而具备优异的光学性能[19]。当其处于溶剂中时,其发光会受到溶剂影响被猝灭[20-21]。为提高镧系元素离子的发光稳定性,可引入配体与其自组装形成镧系配位聚合物[22-23]。其中,有机配体常用于镧系金属配位聚合物的合成,通过天线效应增强镧系金属离子的荧光。Ma 等通过两步反应,用时5 d 合成出了三羧酸酯官能化环三萜配体,该配体可与镧系金属离子形成配位聚合物,通过天线效应增强镧系金属离子荧光[24]。与有机配体相比,小分子配体简单易得,合成方法简单,商品化试剂价格低廉、即买即用,且在水溶液中通过简单的自组装便可与镧系金属离子配位形成聚合物,省时省力,同时避免了实验过程中有机溶剂的使用。Qu 等以2,6-吡啶二羧酸 (DPA) 和鸟苷酸 (GMP)为配体,与Eu3+和Tb3+形成配位聚合物网络 (CPNs),实现了对草甘膦的荧光检测[25]。焦磷酸根离子(PPi) 是碱性磷酸酶的底物之一,具有较强的螯合能力[26]。有研究表明,与单磷酸根离子和磷酸生物分子 (如ATP) 相比,只有焦磷酸根离子 (PPi)可以与铈离子 (Ce3+) 配位提高其荧光强度。如图1所示:通过配体场效应,使得 2d5/2和 2d3/2激发态能量差增加,导致 2f5/2和 2d3/2之间的能量差减小,2f5/2和 2d5/2之间的能量差增加,从而促进了电偶极子向低激发态 (2d3/2) 的跃迁,而电偶极子到高激发态 (2d5/2) 的跃迁受阻。因此,从 2d5/2到2d3/2的非辐射跃迁的能量损失减少,相应地从2d3/2到基态 (2f7/2和 2f5/2) 的辐射跃迁增加,从而显著增强 Ce3+的荧光[27],合成出的Ce-PPi CPNs 具备优异的荧光性质。
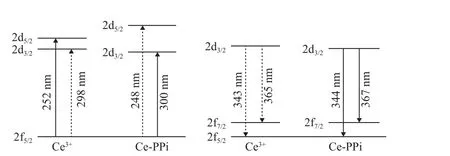
图1 Ce3+与Ce-PPi CPNs 能级和能量转移过程示意图[27]Fig. 1 Schematic diagram of energy levels and energy transfer process of Ce3+ and Ce-PPi CPNs[27]
本研究基于Ce3+与PPi 之间的配位作用,自组装合成出Ce-PPi CPNs,并通过荧光光谱、扫描电子显微镜 (SEM) 和X 射线光电子能谱 (XPS) 对其结构及性能进行表征。草甘膦可与Ce3+配位,干扰 Ce3+和PPi 之间的配体场效应,导致Ce-PPi CPNs 的荧光强度降低,检测示意图如图2 所示。该方法还可用于自来水和苹果样品中草甘膦的检测,具备实际应用的潜力。
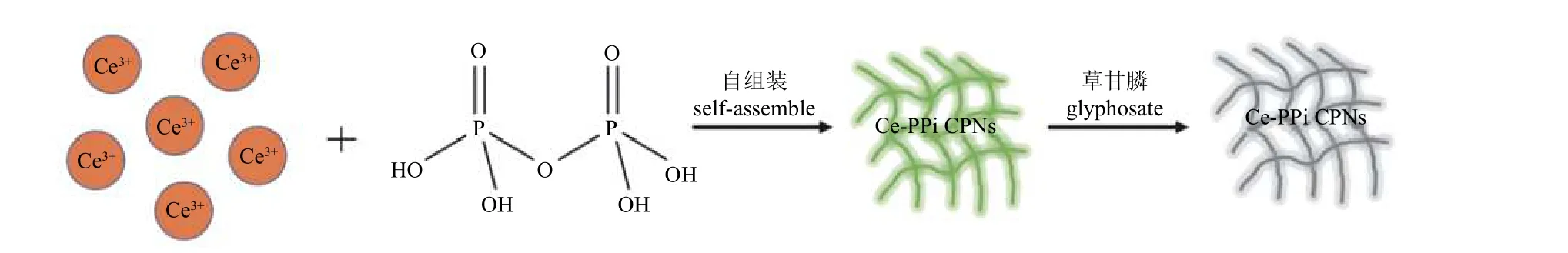
图2 Ce-PPi CPNs 用于草甘膦荧光检测示意图Fig. 2 Principle of the fluorometric glyphosate assay based on Ce-PPi CPNs
1 材料与方法
1.1 主要试剂、药剂与仪器
硝酸铈六水合物 ( (Ce(NO3)3· 6H2O,99.5%),购自易恩 (上海) 化学技术有限公司;焦磷酸钠(99%)、磷酸 (分析纯) 和葡萄糖 (99%),购自麦克林 (上海) 生化科技有限公司;实验用水均为Milli-Q 超纯水。草甘膦 (glyphosate) 标准品 (99.5%)、甘氨酸 (99%)、抗坏血酸 (99%),购自阿拉丁 (上海) 生化科技有限公司。毒死蜱 (chlorpyrifos,95%)、灭多威 (methomyl,92%)、莠去津 (atrazine,94%)、异丙甲草胺 (metolachlor,95%)、戊唑醇(tebuconazole,93%)、嘧菌酯 (azoxystrobin,93%)、马拉硫磷 (malathion,92%)、杀螟硫磷(fenitrothion,94%)、草铵膦 (glufosinate ammonium,95%)、辛硫磷 (phoxim,91%)、乙酰甲胺磷 (acephate,93%)和百草枯 (paraquat,90%)原药,由中国农业大学应用化学系农药综合分析室提供。N-丙基乙二胺 (PSA),购自吴桥 (河北)津杨过滤器材厂。磷酸盐缓冲液 (PBS,0.1 mol/L,pH=7.4),购自索莱宝 (北京) 科技有限公司。其余试剂均为分析纯,购自国药集团 (上海) 化学试剂有限公司。
RF-6000 荧光分光光度计 (日本Shimadzu 公司);UV2600 紫外可见 (UV-Vis) 分光光度计 (日本Shimadzu 公司);SU8020 场发射扫描电子显微镜 (日本Hitachi 公司);Escalab 250Xi X 射线光电子能谱仪 (美国Thermo Scientific 公司)。
1.2 Ce-PPi CPNs 的制备
参考Zhou 等的方法制备[27]。与Zhou 等使用DNA 聚合反应的副产物PPi 不同,本研究中直接通过PPi 和Ce3+的自组装制备。使用超纯水配制硝酸铈六水合物和焦磷酸钠水溶液 (50 mmol/L)。先后吸取2 mL 硝酸铈六水合物和焦磷酸钠水溶液,加入到10 mL 塑料离心管中,在转速1 500 r/min下涡旋混合5 min,再以15 000 r/min的转速离心10 min。去除上清液,加入5 mL 超纯水充分洗涤沉淀物。重复3 次后冷冻干燥得到材料Ce-PPi CPNs。
1.3 Ce-PPi CPNs 的形貌特性及结构表征
分别使用扫描电子显微镜与X 射线光电子能谱仪对Ce-PPi CPNs 的形貌特征与元素组成进行表征。
1.4 草甘膦的荧光检测
以水为溶剂配制10 mmol/L 草甘膦母液,再逐步稀释成不同浓度的草甘膦溶液。
条件优化:包括Ce3+浓度 (0.25~1 mmol/L)、PPi 的添加量 (2~8 μL,1 mmol/L)、PPi 和Ce3+的结合时间 (0~20 min)、草甘膦和Ce3+的作用时间(0~20 min)。
检测流程:在最佳条件下,将6 μL 不同浓度的草甘膦溶液 (0~5 μmol/L)、20 μL Ce3+溶液(0.5 mmol/L) 与4 μL PPi 溶液先后加入到2 mL 离心管中混合,加入570 μL 超纯水,最终体积为600 μL,在室温下保持转速600 r/min,振荡5 min。在300 nm 激发下记录荧光光谱。
草甘膦定量检测:以346 nm 处的荧光强度对草甘膦的浓度对数 (0.1~5 μmol/L) 作图,获得标准曲线,检出限 (LOD) 使用 3σ 规则计算得到。
1.5 选择性试验
为研究所提出方法的选择性,在检测系统中引入多种潜在干扰物质 (浓度均为5 μmol/L),包括Na+、Ca2+、Zn2+、抗坏血酸、葡萄糖、甘氨酸、毒死蜱、灭多威、莠去津、异丙甲草胺、戊唑醇、嘧菌酯、马拉硫磷、杀螟硫磷、草铵膦、辛硫磷、乙酰甲胺磷、H2PO4-、HPO42-、PO43-、百草枯和PBS 缓冲液 (pH=7.4)。检测流程如1.4 节中所述,在最佳条件下试验并测量荧光光谱。
1.6 实际样品分析
选择自来水和苹果样品,结合标准加入法验证该方法的实际应用潜力。
水样采自中国农业大学理学院,经0.22 μm滤膜过滤,将草甘膦添加到自来水样品中,并采用1.4 节中所述方法测定,计算获得回收率。
苹果购自当地市场,取可食部分切碎并用组织捣碎机粉碎。称取处理后的苹果样品5 g 于50 mL 离心管中,加入草甘膦溶液,静置30 min。加入5 mL 纯净水,涡旋10 min 及离心10 min。取1 mL 上清液于2 mL 离心管中,加入30 mg PSA,涡旋5 min,离心5 min 后经0.22 μm 滤膜过滤得到提取液。取300 μL 提取液进行试验,其余检测流程同1.4 节中所述。
2 结果与讨论
2.1 Ce-PPi CPNs 结构表征与分析
使用扫描电子显微镜观察Ce-PPi CPNs 的具体形貌及微观结构。如图3 所示,Ce-PPi CPNs 呈现纳米颗粒形态分布,尺寸约为10 至25 nm。结合X 射线能谱仪 (EDS) 分析其元素成分,SEMEDS 结果 (图4) 表明,铈和磷元素均匀分布在Ce-PPi CPNs 中,证明Ce3+和PPi 通过配位交联形成了纳米尺寸聚合物。

图3 Ce- PPi CPNs 的SEM 谱图Fig. 3 SEM image of Ce-PPi CPNs

图4 Ce- PPi CPNs SEM (A)、EDS (B)和 (C)(磷:红色,铈:绿色)谱图Fig. 4 (A) SEM image of Ce-PPi CPNs; EDS mapping images of (B) P in red and (C) Ce in green
对Ce-PPi CPNs 进行X 射线光电子能谱 (XPS)分析,进一步确定其具体元素成分。在图5 中,Ce3d3/2(904.4 eV)、Ce3d5/2(885.5 eV)、O1s (531.3 eV) 和 P2p (133.8 eV) 的特征峰在图中清晰可见。铈、磷和氧的XPS 数据与标准数据库 (美国国家标准与技术研究院,表1) 相似,进一步证明 Ce-PPi CPNs 已被成功制备。
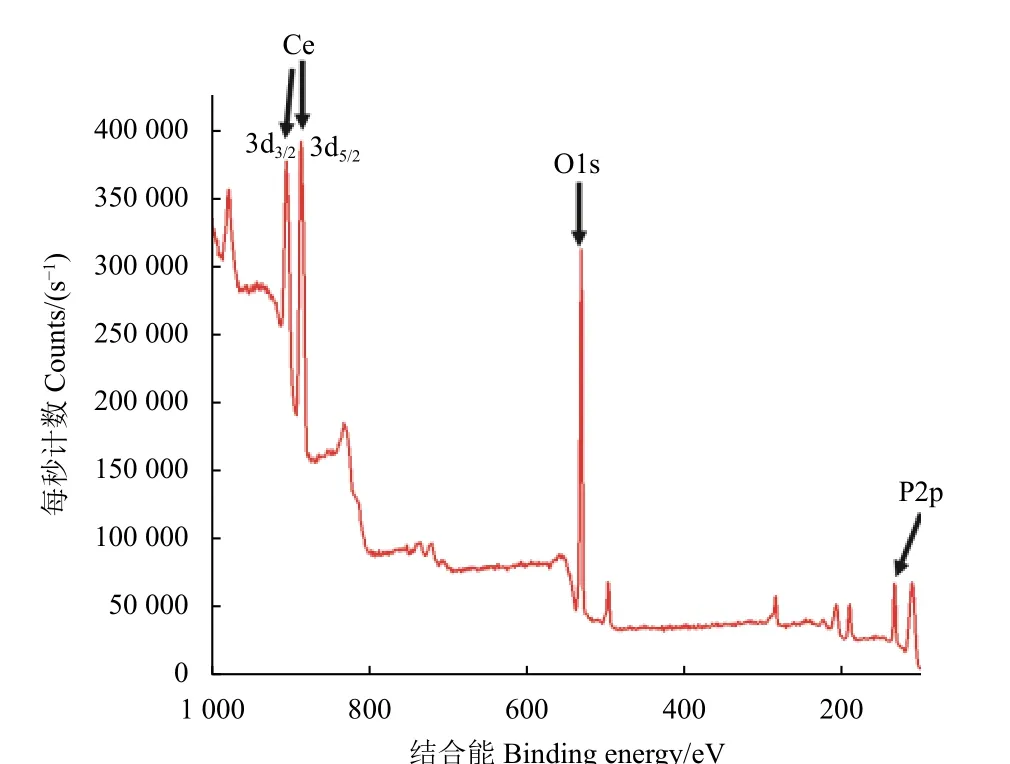
图5 Ce-PPi CPNs 的XPS 谱图Fig. 5 XPS image of Ce-PPi CPNs
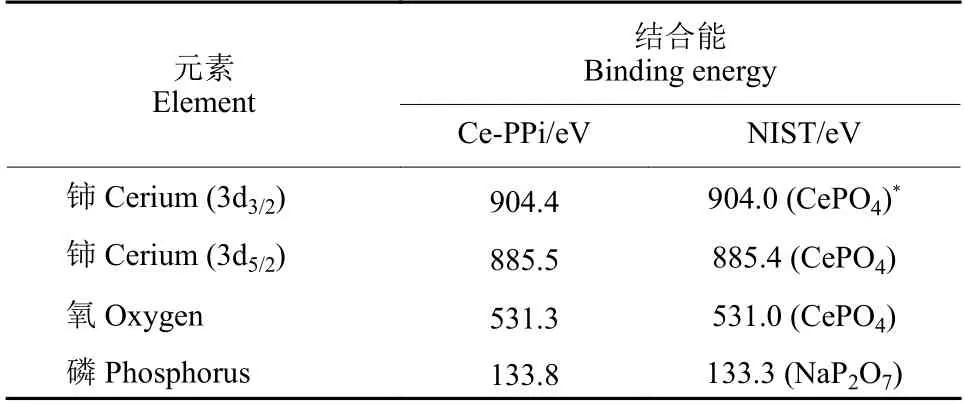
表1 Ce-PPi CPNs 和NIST 数据库中被测元素的结合能Table 1 Binding energies of tested elements in Ce-PPi and NIST database
如图6 所示,所制备的Ce-PPi CPNs,在300 nm 激发下最大发射峰位于346 nm,这与Zhou等研究结果相似[27]。
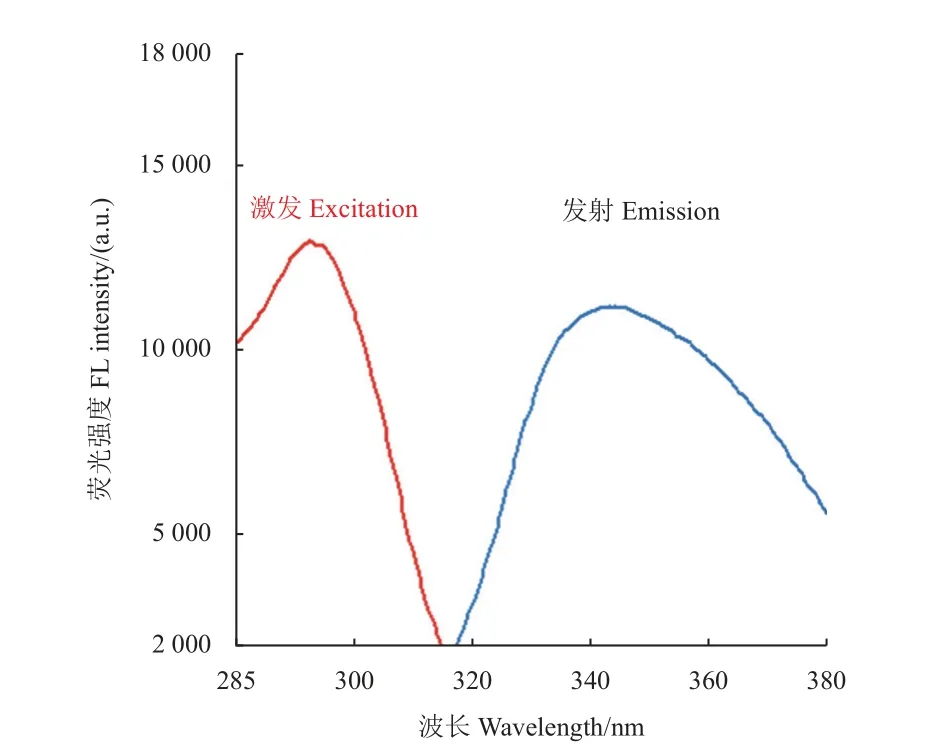
图6 Ce-PPi CPNs 的激发和发射光谱Fig. 6 The excitation and emission spectra of Ce-PPi CPNs
2.2 草甘膦检测机理
通过紫外-可见吸收光谱探究了荧光猝灭效应的可能机制。已有研究表明:PPi 可以与Ce3+配位,产生配体场效应,从而提高其荧光强度;单磷酸根离子也可与Ce3+配位,但不能产生荧光增强效应[27];而草甘膦中含有单磷酸基团和羧基,可与金属离子配位[28]。基于这一结论,可以推测:草甘膦、PPi 可以与Ce3+配位形成草甘膦-Ce3+-PPi配合物,由于草甘膦的介入,PPi 与Ce3+之间的配体场效应被干扰而减弱,从而造成荧光猝灭。
如图7 所示,在扫描范围内,草甘膦和PPi均没有紫外吸收峰,Ce3+的吸收峰分别在252 和298 nm。当PPi 与Ce3+混合后,298 nm 处的吸收峰红移至300 nm,且峰强度显著增加。如引言中所述,PPi 的配体场效应使得 2f5/2和 2d3/2之间能量差减小,298 nm 处峰的红移可视为配体场效应的特征表现,峰位置及强度的变化再次证明了PPi和 Ce3+的结合[27]。Ce3+与草甘膦混合后,Ce3+的吸光度有所下降,但峰的位置保持在252 和298 nm不变,说明Ce3+可以与草甘膦结合,但不会改变其光学性质。从图7 中还可以看出,当PPi、草甘膦和Ce3+三者同时存在时,Ce-PPi CPNs 的特征吸收峰从300 nm 蓝移至299 nm,峰强度进一步显著增加。配体场效应特征峰蓝移说明草甘膦可以削弱PPi 的配体场效应,导致 2f5/2和 2d3/2之间的能量差增大,从而产生荧光猝灭效应。
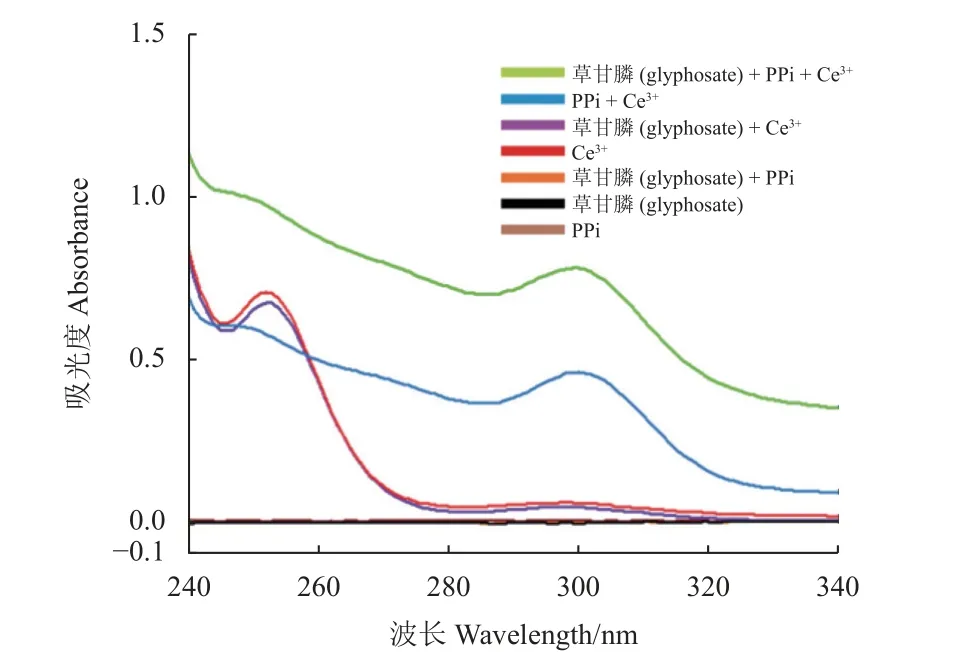
图7 不同物质的紫外-吸收光谱 (浓度均为1 mmol/L)Fig. 7 UV-Vis absorption spectra of different substances(the concentration of all substances was 1 mmol/L)
2.3 草甘膦荧光检测结果
在条件优化过程中,首先保持其他条件不变(1 mmol/L PPi 添加量4 μL,结合时间15 min,作用时间15 min,草甘膦浓度5 μmol/L),优化Ce3+的浓度 (0.25~1 mmol/L)。从图8A 中可以看出,相对荧光强度最大时所对应的Ce3+浓度为0.5 mmol/L,因此,选择0.5 mmol/L 为检测时Ce3+的浓度。其次,由于PPi 的添加量为4 μL 时相对荧光强度达到峰值 (图8B),因此PPi 的添加量确定为4 μL,其他条件为Ce3+浓度0.5 mmol/L,结合时间15 min,作用时间15 min,草甘膦浓度5 μmol/L。最后,优化了PPi 与Ce3+的结合时间以及草甘膦与Ce3+的作用时间,以使荧光猝灭完全。在图8C 中,PPi 与Ce3+结合5 min 时,相对荧光强度达到峰值,且之后基本不随时间的增加而变化,据此确定5 min为最佳结合时间。如图8D 所示,草甘膦与Ce3+、PPi 混匀后立即测定,此时相对荧光强度最大,且时间延长后基本不变,说明草甘膦与Ce3+作用速度快,在混匀后即可作用完全,无需振荡。因此,为提高检测速度,将PPi、Ce3+的结合与草甘膦、Ce3+的作用两步骤合并,检测流程简化为草甘膦、Ce3+和PPi 三者共同混合振荡5 min 后进行测定。按 (1) 式计算相对荧光强度。
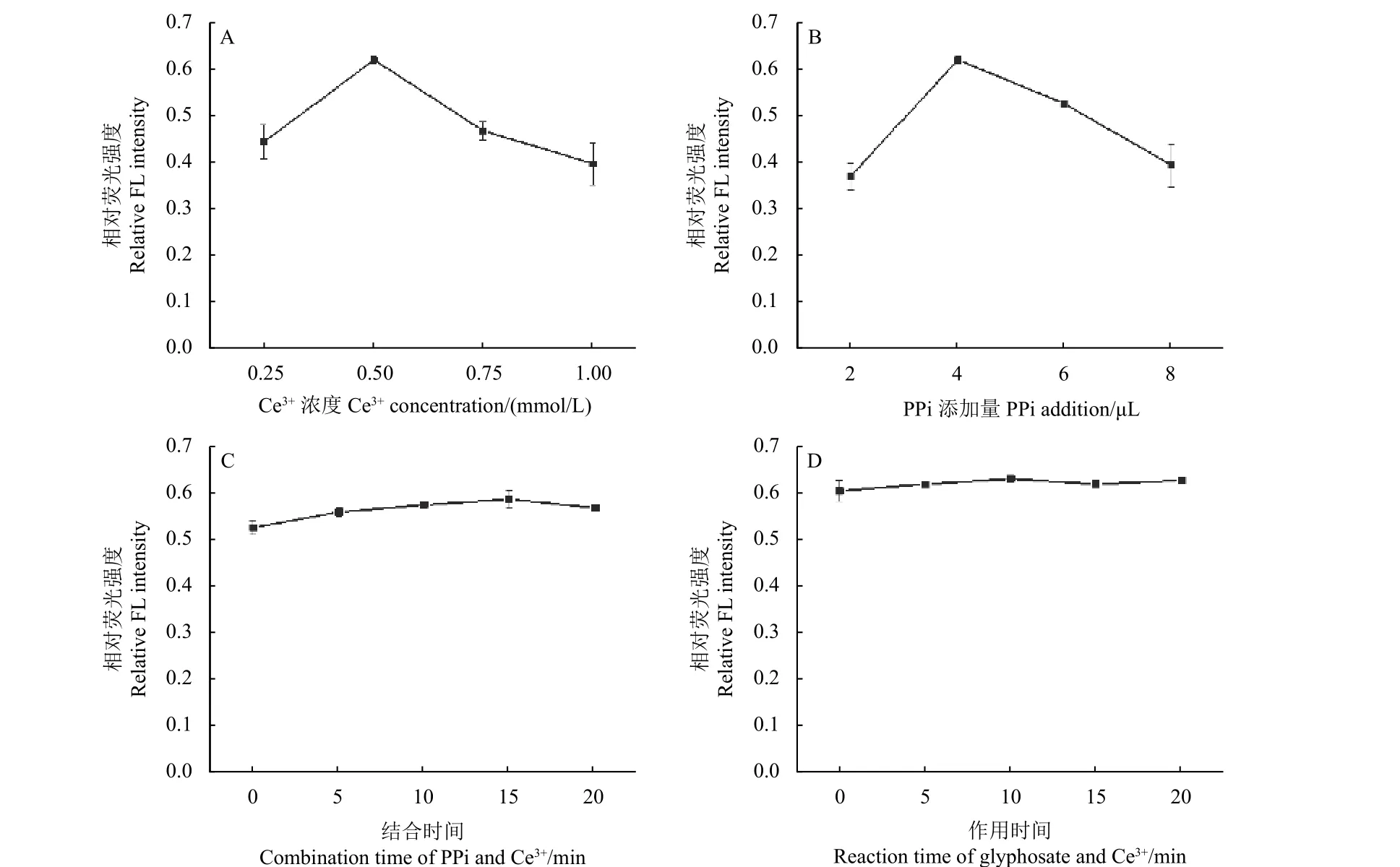
图8 Ce3+浓度(A)、PPi 添加量(B)、 PPi 与Ce3+结合时间 (C)以及草甘膦与 Ce3+ 作用时间(D)对Ce-PPi CPNs 相对荧光强度的影响Fig. 8 Effects of the concentration of Ce3+ (A) , the addition amount of PPi (B) , the combination time between PPi with Ce3+ (C) and reaction time of glyphosate and Ce3+ (D) on relative fluorescence intensities of Ce-PPi CPNs
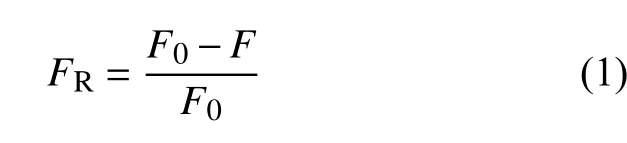
式中:FR为相对荧光强度;F0为不含有草甘膦时体系的荧光强度;F为含有草甘膦时体系的荧光强度。
草甘膦的检测是基于其对Ce-PPi CPNs 荧光猝灭作用实现的。如图9 所示,随着草甘膦浓度的增加,Ce-PPi CPNs 的荧光强度逐渐降低。以荧光强度对草甘膦的浓度对数 (浓度范围0.1~5 μmol/L)作图,得到的标准曲线方程为F= -4 097.888 logc+9 356.104 (c为草甘膦浓度),R2= 0.997 2。检出限(LOD) 根据3σ 规则计算得到,为0.014 μmol/L。检测速度。
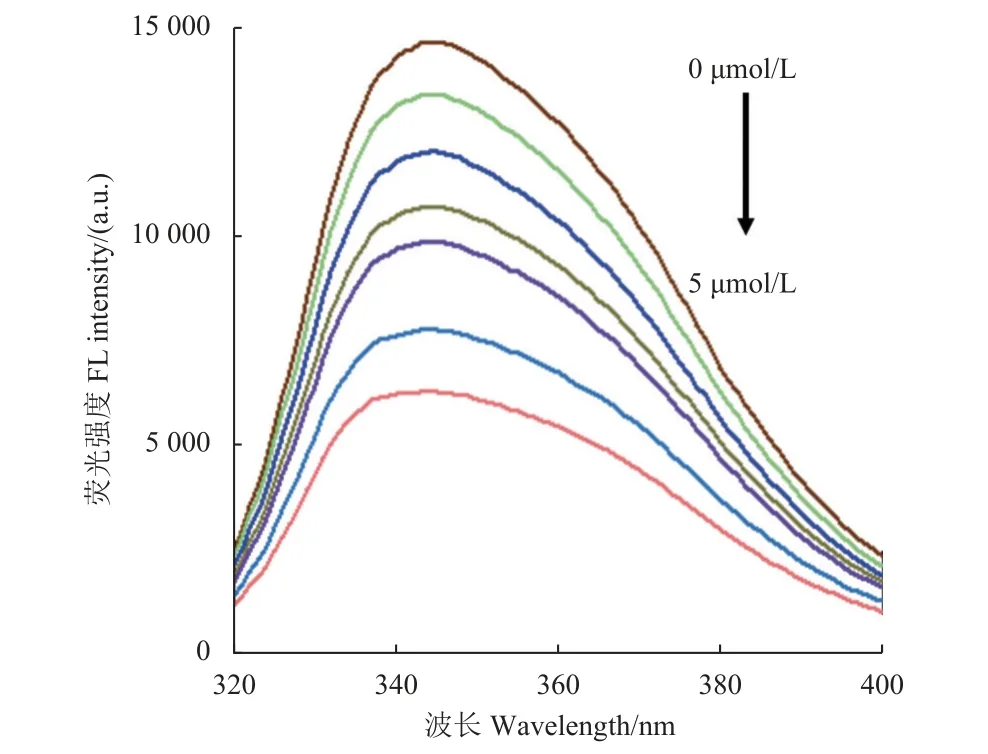
图9 Ce-PPi CPNs 在不同浓度草甘膦存在下的荧光光谱Fig. 9 Fluorescence spectra of Ce-PPi with various concentration of glyphosate
2.4 检测方法的选择性
为探究所建立方法在实际样品中的应用可能性,对方法的选择性进行了测定。如图10 所示,选择包括使用量较大的农药、有机磷类农药、草甘膦结构类似物及离子型化合物等在内的多种非目标物作为测试对象。结果表明,多种非目标物对Ce-PPi CPNs 的荧光信号均未产生显著影响,表明该方法对草甘膦具有良好的选择性。
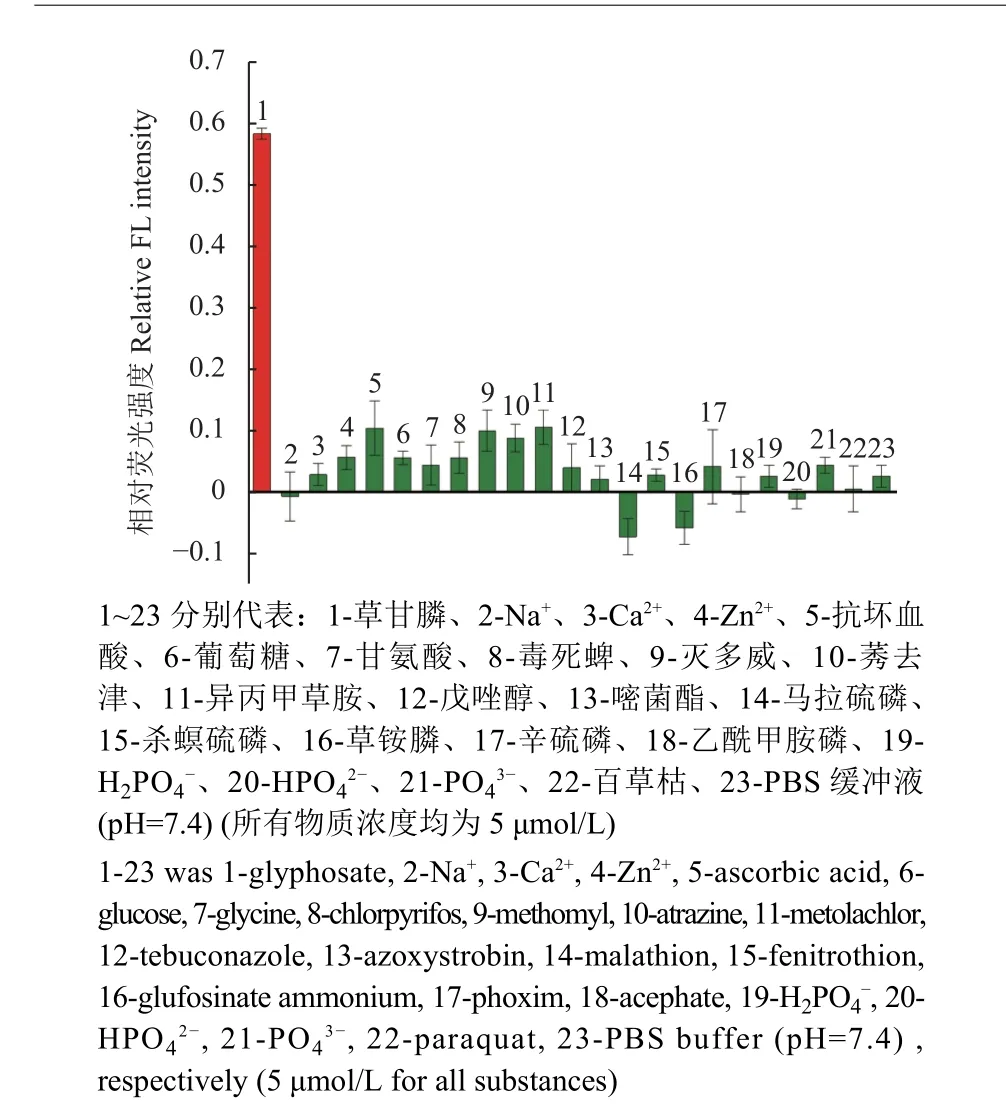
图10 草甘膦和潜在干扰物质存在时的相对荧光强度Fig. 10 The relative fluorescence intensity change rate of glyphosate and potential interfering substances towards detection
2.5 实际样品分析
根据GB 2763—2021《食品安全标准 食品中农药最大残留限量》规定,草甘膦在苹果中的最大农药残留限量 (MRL) 值为0.5 mg/kg[35],因此,选择自来水和苹果样品,将3 种浓度水平的草甘膦添加到基质中,测定荧光强度,验证检测方法的实际可行性。线性方程、回收率和相对标准偏差 (RSD) 测定结果 (表3) 表明:在实际样品检测中,回收率 (77%~87%) 和RSD (6.1%~8.8%) 均能满足实际检测的要求。在NY/T 1096—2006《食品中草甘膦残留量测定》与SN/T 4655—2016《出口食品中草甘膦及其代谢物残留量测定方法液相色谱-质谱/质谱法》中,草甘膦的定量限(LOQ) 分别为0.02 mg/kg 和0.05 mg/kg[36-37],本方法的LOQ 为0.05 mg/kg,满足残留分析要求。因此,该方法具备实际样品检测应用的潜力。
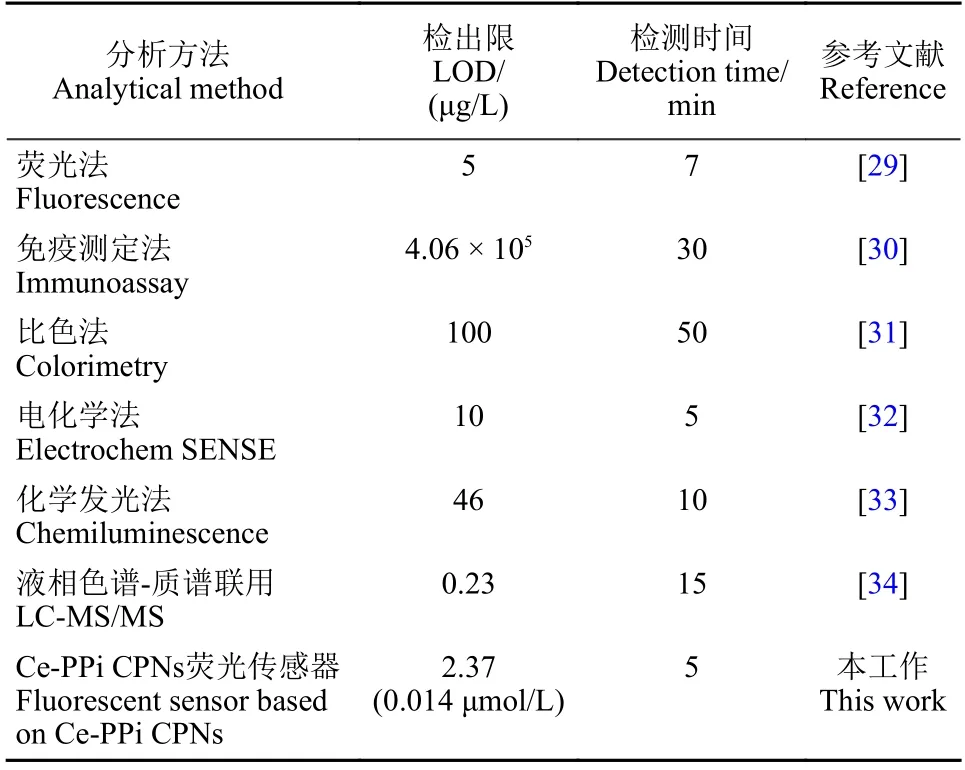
表2 不同草甘膦检测方法的检出限和检测时间对比Table 2 Comparison of limit of detection (LOD) and detection time of glyphosate by different analytical methods
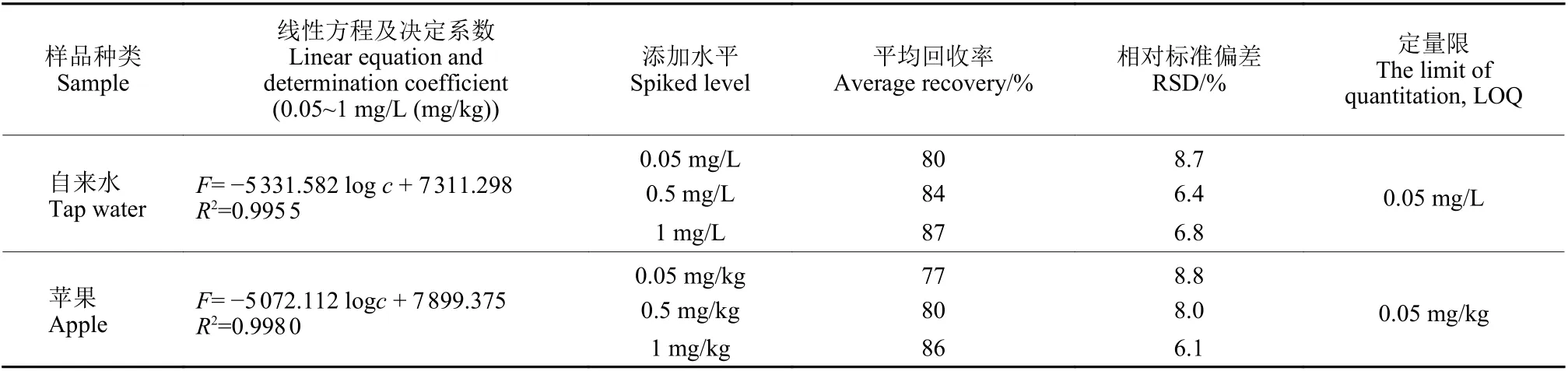
表3 自来水和苹果样品中草甘膦的添加回收率和相对标准偏差(n=5)Table 3 Recoveries and relative standard deviations (RSD) of glyphosate in tap water and apple samples(n=5)
3 结论
将铈离子与焦磷酸根离子在常温下混合搅拌,通过简单的自组装制备出Ce-PPi CPNs,草甘膦可以通过减弱PPi 与Ce3+之间的配体场效应猝灭Ce-PPi CPNs 的荧光,且Ce-PPi CPNs 荧光强度与草甘膦浓度具有良好的线性关系 (线性范围0.1~5 μmol/L)。据此,建立了一种草甘膦荧光检测方法,过程简便易操作,具备较低的检出限(0.014 μmol/L) 与超快的检测速度 (5 min),可应用于自来水与苹果样品中草甘膦的快速检测,所建立的方法满足残留分析的要求,为实际样品中草甘膦的快速、灵敏、现场和实时检测提供了新的选择。
谨以此文庆贺中国农业大学农药学学科成立70 周年。
Dedicated to the 70th Anniversary of Pesticide Science in China Agricultural University.
作者简介:

张强,男,2019.9—2022.6 在中国农业大学农产品安全专业攻读硕士研究生,获得硕士学位。在读期间,获得一等奖学金、中国农业大学“三好学生”及“优秀共青团员”等多项荣誉。研究方向为农药快速荧光检测方法开发。

刘东晖,女,中国农业大学教授,博士生导师。2008 年毕业于中国农业大学,获理学博士学位。2014—2015 年作为访问学者在宾夕法尼亚大学开展合作研究。主要研究方向为农药分析与环境安全,重点围绕手性农药分离分析、农药残留分析方法开发、农药及关键代谢产物环境风险及污染修复等开展研究。获教育部自然科学二等奖、北京市科学技术二等奖、中国植物保护学会科学技术奖二等奖、北京市科学技术三等奖、北京市教育教学成果二等奖等省部级以上奖励 5 项。2013 年入选“北京高等学校青年英才支持计划”,2019 年入选中国农业大学“人才培育发展支持计划”青年新星A 类。现任《农药学学报》青年编委会主任。
