三角帆蚌MAP2K1基因的分子特征和表达
2022-10-25刘美玲上官宵兆王晓强王雅昱汪桂玲李家乐
刘美玲,上官宵兆,王晓强,王雅昱,汪桂玲, ,李家乐,
1. 上海海洋大学/农业农村部淡水水产种质资源重点实验室,上海 201306
2. 水产科学国家实验教学示范中心/上海市水产养殖工程技术研究中心,上海 201306
三角帆蚌 (Hyriopsis cumingii) 所产珍珠占中国珍珠产量的80%以上[1],且品质良好、经济价值较高。但三角帆蚌培育珍珠的大小、光泽度等均与性别有关,在产珠性能方面雄性优于雌性[2],而人工雌雄分养情况下能促进雌性三角帆蚌的个体发育及产珠性能[3]。三角帆蚌属于雌雄异体,不存在异型染色体,目前性别决定无法从染色体层面进行研究,所以性别分化与决定相关基因的研究成为性别调控的热点,对揭示复杂的性别决定与分化机制研究及创造经济效益具有重大意义[4]。
丝裂原活化蛋白激酶 (MAPK) 也称为细胞外信号调节激酶,受各种细胞外生长因子及受体的相互作用而被激活,会影响许多组织特异性生物活性,如细胞增殖、存活和分化[5-6]。然而,MAPK在雌性生殖细胞中不遵循这种传统的模式[7]。在卵母细胞中,MAPK独立于生长因子和酪氨酸激酶受体而被激活,独立于转录调控发挥作用[8],受特殊上游调节剂激酶 MOS的控制,在卵母细胞减数分裂中起关键作用[9-10]。Mos/MAPK通路在脊椎动物中启动卵母细胞的成熟发育[10],C-MOS基因在Mos/MAPK通路中位于MAP2K1基因的上游。MAP2K1基因作为MAPK家族的一分子,参与细胞增殖、分化、基因转录调控和发育过程[11-13]。在脊椎动物中,MAP2K1基因参与小鼠 (Mus musculus) 的卵巢发育[14],促进水牛 (Bubalus) 卵母细胞的表达与发育[15],对鹅 (Anser cygnoides orientalis) 的卵泡发育起到支持与促进作用[5]。在无脊椎动物中,MAP2K1基因对斑节对虾 (Penaeus monodon) 卵母细胞的生长发育起促进作用[14];能促进果蝇 (Drosophilid) 的卵母细胞成熟[16]。
在贝类中,紫贻贝 (Mytilus galloprovincialis)、虾夷扇贝 (Mizuhopecten yessoensis) 的MAP2K1基因均有报道[17-18]。本文对三角帆蚌MAP2K1基因进行了克隆,分析了该基因在性腺不同阶段和雌雄性腺组织中的表达模式,探讨了该基因在三角帆蚌性腺发育中的作用。
1 材料与方法
1.1 实验材料
从浙江省金华市武义实验基地选取健康的1—8月龄和1、2、3龄三角帆蚌,暂养1周后对1—8月龄个体的性腺组织、1龄和2龄个体各组织 (性腺、闭壳肌、肝胰腺、鳃、外套膜、斧足)、3龄个体的性腺组织进行取样,样本立刻放入液氮,速冻后用镊子放入样本盒,-80 ℃保存。
1.2 总RNA提取与cDNA合成
按TRIzol法提取总RNA,利用NanoDrop 2000分度计进行核酸检测,通过1%琼脂糖凝胶电泳[19](电压180 V,电流200 mA) 检查RNA完整性情况(3条条带5.8S、18S、28S)。检查合格后将RNA保存于-80 ℃。将RNA进行反转录 (Prime ScriptTMRT reagent Kit with gDNA Eraser试剂盒,TaKaRa,日本) 得到cDNA模板,cDNA保存于-40 ℃。
1.3 基因序列的获取
通过转录组库[20]中得到的序列设计3'RACE的inner和outer引物 (表1),并参照SMART 3'RACE试剂盒 (Clontech, America) 说明书进行MAP2K1基因的3'端PCR扩增。电泳 (电压180 V,电流200 mA) 检测产物,割胶回收纯化。用PMD19-T(TaKaRa,大连) 载体连接纯化产物,16 ℃下连接4 h。准备冰盒,在冰上将连接产物转化入大肠杆菌DH5α (TaKaRa,大连) 中 30 min。准备含氨苄的固体培养基 (4 ℃冰箱保存),将所得菌液均匀地涂在上面,37 ℃培养10 h。挑选白色菌株送至生工 (上海) 测序。

表1 本实验所需引物Table 1 Primers for this study
1.4 基因生物信息学分析
使用NCBI (https://www.ncbi.nlm.nih.gov/) 中的ORF finder预测MAP2K1基因的开放阅读框(ORF)、Blast得到不同物种MAP2K1基因序列、Premier设计引物;蛋白基本理化性质利用Prot-Param tool (https://web.expasy.org/aprotparam/) 分析;二级结构利用SOPMA (https://npsa-prabi.ibcp.fr/NPSA/npsa_sopma.html) 预测;三级结构利用I-TASSER (https://zhanglab.ccmb.med.umich.edu/I-TASSER/) 预测;跨膜结构域利用TMHMM Serverv 2.0程序 (http://www.cbs.dtu.dk/services/TMHMM/) 预测并用 (http://www.genedenovo.com/news/582.html) 解读结果;信号肽利用SignalP-5.0(http://www.cbs.dtu.dk/services/SignalP/) 预测并用(http://www.cbs.dtu.dk/services/SignalP-3.0/output.php) 解读结果,基因表达量差别利用SPSS 18.0软件分析;表达量差别条形图利用SigmaPlot 12.5绘制;NJ (邻接法) 系统进化树利用MEGA 7.0构建,Bootstrap分析其可靠性,重复1 000次。
1.5 荧光定量分析
选取EF-1α为内参基因,使用CFX96 TouchTM Real-Time PCR Detection System (Bio-Rad) 仪器进行定量分析。定量体系 (20 μL) 为cDNA (使用前混合均匀) 1.6 μL,2×TB Green Premix ExTaq10 μL,F(上游引物) 0.8 μL,R (下游引物) 0.8 μL,RNase Free Water 6.8 μL。定量程序为 95 ℃ 3 min;95 ℃5 s,60 ℃ 30 s,循环 40次。
1.6 原位杂交
原位杂交的引物具有特异性,上游引物保持不变,将T7启动子序列 (TAATACGACTCACTAT AGGG) 加入到下游引物5'端前。三角帆蚌性腺cDNA作为模板进行扩增,得到目的条带割胶回收,纯化后作为模板,使用T7 (T7 High Efficiency Transcription) 试剂盒和DIG RNA Labeling Mix得到标记探针,cDNA 1 μL,4 μL 5×T7 Transcription Reaction、8 μL 10 mmol·L-1NTP Mix,2 μL T7 Transcription Enzyme Mix,RNase-free water 5 μL。反应程序为37 ℃,2 h。将所得探针纯化后保存于-80 ℃。
取2龄健康雌、雄三角帆蚌的性腺组织 (组织上连带少许表皮),将其在4%多聚甲醛与DEPC中固定2 h,转移至70%乙醇中,在乙醇中可保存约10 d。进而进行组织梯度脱水、组织透明、浸蜡、包埋、切片 (厚度控制在6~8 μm)、粘片。利用DIG nucleic acid detection kit进行原位杂交,并进行封片处理,在显微镜下观察杂交信号并拍照。
1.7 RNA干扰
1.7.1 dsRNA 的合成
使用Primer Premier 5.0软件在C-MOS基因的ORF区设计3对引物,在上下游引物前加上T7序列,将每组中正常引物与加有T7序列的引物交叉重组,共形成6对引物,分别进行PCR扩增,扩增后回收纯化cDNA序列 (质量浓度≥167 ng·μL-1)。利用T7 High Efficiency Transcription 试剂盒 (全式金,北京) 将cDNA逆转录成单链RNA,混匀,37 ℃ PCR孵育2 h。将同一片段的两管单链RNA在冰上等量混匀,将混匀物放置在70 ℃ PCR仪中反应10 min,反应结束立刻取出后室温静置20 min。向每 20 μL 的反应液加入 1 μL RNase A (用无酶水稀释 200倍) 和 1 μL DNase I,放置在 37 ℃PCR仪中反应30 min。这一步骤是为了去除DNA,使之退火合成dsRNA。将所得溶液中加入1/10体积的3 mol·L-1醋酸铵和等量异丙醇,冰中静置5 min;放置离心机中 12 000 r·min-1、4 ℃、10 min。弃上清,70%乙醇洗涤沉淀;12 000 r·min-1、4 ℃离心10 min。超净工作台内风干15 min;加入100 μL RNase-free water溶解。检测dsRNA的质量和浓度,-80 ℃保存。
1.7.2 dsRNA 干扰链注射
取1龄三角帆蚌按照每组15只分为4组 (干扰链1、干扰链2、干扰链3和对照组),实验组每只注射 50 μL (200 ng·μL-1) 干扰链,阴性对照组每只注射 50 μL (200 ng·μL-1) 生理盐水 (Normal saline,NS)。在第12、第24和第48小时提取性腺组织并立刻放置于液氮中。利用TRIzol法提取总RNA,试剂盒将其反转为cDNA,将反转后的cDNA作为模板进行荧光定量实验,检测直接干扰C-MOS基因后在性腺中的表达量情况及下游基因MAP2K1的表达量情况。
2 结果
2.1 MAP2K1基因cDNA的克隆及序列特征
本实验克隆得到三角帆蚌MAP2K1基因cDNA的序列,其中5' 非编码区 (UTR) 为145 bp,3'UTR为2 070 bp,开放阅读框 (ORF) 1 194 bp,编码397个氨基酸 (图1)。预测相对分子质量44.24 kD,等电点为6.81,平均亲水系数为-0.379,推测为亲水蛋白。根据MAP2K1蛋白既不具备跨膜结构、也不具备信号肽的特点,推测其不属于膜蛋白,而属于胞内蛋白。通过SOPMA分析得到MAP2K1基因具有S-TKC结构域 (72—372 aa,图2-a),通过ITASSER预测MAP2K1基因的蛋白质三级结构(图 2-b)。

图1 三角帆蚌MAP2K1基因核苷酸序列及氨基酸序列Fig. 1 MAP2K1 gene nucleotide sequence and amino acid sequence of H. cumingii

图2 三角帆蚌MAP2K1基因二级、三级结构预测Fig. 2 Secondary and tertiary structure prediction of MAP2K1 gene in H. cumingii
2.2 MAP2K1基因系统进化
利用GeneDoc进行不同物种之间的序列比对,结果显示来自多种物种的MAP2K1基因结构域重合度很高 (图3),说明在多种物种之间,MAP2K1基因进化和结构具有保守性,推断其具有功能相似性。

图3 三角帆蚌与其他物种MAP2K1基因的蛋白序列比对Fig. 3 Protein sequence comparison of MAP2K1 gene between H. cumingii and others
根据同源性比对结果分析,三角帆蚌MAP2K1基因与紫贻贝、虾夷扇贝、泥蚶 (Tegillarca granosa)的同源性较高,同源性分别为85.52%、82.65%、80.59%。与智人 (Homo sapiens)、北美属兔 (Ochotona princeps) 等同源性较低,同源性分别为72.27%、72.53%。系统进化树显示三角帆蚌与紫贻贝、虾夷扇贝、泥蚶聚为一支,亲缘关系较近 (图4)。
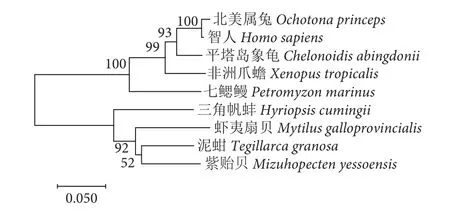
图4 不同物种MAP2K1基因的氨基酸序列构建的NJ系统进化树Fig. 4 NJ phylogenetic trees constructed from amino acid sequences of MAP2K1 gene in different species
2.3 MAP2K1基因在各组织和各时期的表达量差异
在雌雄三角帆蚌的不同组织中,MAP2K1基因均有一定的表达量,但是MAP2K1基因在雌性性腺中的相对表达量高于另5个组织,雌雄差异也比较显著 (P<0.05,图 5)。
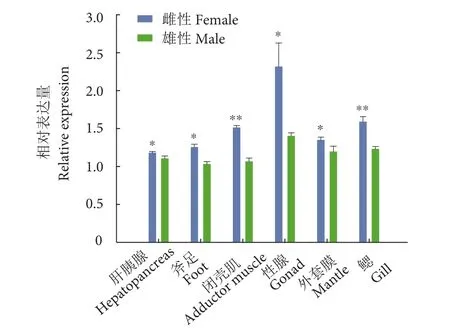
图5 三角帆蚌MAP2K1基因在雌雄各组织中的表达注:*表示存在显著性差异 (*. P<0.05, **. P<0.01) ;图7、图9、图10和图11同此。Fig. 5 Expression of MAP2K1 gene in both male and female tissues of H. cumingiiNote: *. Significant difference (*. P<0.05, **. P<0.01); the same case in Fig. 7, Fig. 9, Fig. 10 and Fig. 11.
在三角帆蚌幼龄 (1—8月) 性腺发育阶段过程中,MAP2K1基因均有一定程度的表达 (图6)。说明MAP2K1基因在三角帆蚌幼龄性腺发育阶段起到一定作用。

图6 三角帆蚌MAP2K1基因在早期性腺组织中的表达注:柱上不同字母表示存在显著性差异 (P<0.05) ;相同字母表示无显著性差异。Fig. 6 Expression of MAP2K1 in various tissues of female and male adults of H. cumingiiNote: Different letters indicate significant difference (P<0.05), while the same letters indicate insignificant difference.
三角帆蚌1龄性腺中,雌性相对表达量显著高于雄性 (P<0.01),但在雄性中也有一定表达 (图7);等到2龄左右,性腺相对表达量雌雄差异极显著(P<0.01),雄性中几乎不表达;在3龄性腺中,雌雄表达量均处于非常低的水平。结果表明,MAP2K1基因在三角帆蚌2龄卵巢发育过程中起到非常重要的作用。

图7 MAP2K1基因在1—3龄三角帆蚌性腺中的相对表达Fig. 7 Relative expression of MAP2K1 gene in gonads of H. cumingii of 1-3 years old
2.4 性腺组织原位杂交
结果显示,实验组中三角帆蚌雌性性腺的卵母细胞、卵子上,蓝紫色杂交信号非常显著。实验组中三角帆蚌雄性性腺的精原细胞、精母细胞上,蓝紫色杂交信号存在极少,雌性及雄性阴性对照组中均未出现杂交信号 (图8)。根据结果推测,MAP2K1基因可能参与三角帆蚌的卵巢发育过程。

图8 三角帆蚌MAP2K1基因在2龄三角帆蚌性腺原位杂交注:a. 雌性阴性对照组;b. 雌性实验组;c. 雄性阴性对照组;d. 雄性实验组。Fig. 8 MAP2K1 in situ hybridization in gonads of 2-year-old H. cumingiiNote: a. Female of negative control group; b. Female of experimental group; c. Male of negative control group; d. Male of experimental group.
2.5 RNA干扰结果
三条干扰链的干扰结果为,干扰链1在雌性和雄性中的干扰率分别为88.43%和77.90%;干扰链2在雌性和雄性中的干扰率分别为93.10%和78.10%;干扰链3在雌性和雄性中的干扰率分别为96.39%和86.26% (图9)。干扰率结果显示干扰链3对C-MOS基因的干扰效果最佳,为此选择干扰链3进行实验,检测C-MOS基因在12、24和48 h干扰后在性腺中的表达情况,结果显示干扰链3在第24小时的干扰效率最佳 (图10)。

图9 三角帆蚌C-MOS基因干扰后表达情况Fig. 9 Expression of C-MOS gene of H. cumingii after interference

图10 干扰链3随时间变化的干扰情况Fig. 10 Variation of Interference chain 3 with time
干扰C-MOS基因后,荧光定量检测其下游基因MAP2K1的表达量情况 (图11)。结果显示,MAP2K1基因在雌性中的表达量下降了82.31%,在雄性中的表达量下降了73.60%。说明在三角帆蚌中,C-MOS基因对MAP2K1基因有显著的调控作用。

图11 三角帆蚌C-MOS基因干扰后MAP2K1基因表达情况Fig. 11 Expression of MAP2K1 gene of H. cumingii after C-MOS gene interference
3 讨论
本研究克隆了三角帆蚌MAP2K1基因的cDNA序列,编码一个长为1 194 bp的ORF。蛋白质结构预测分析显示,MAP2K1基因中含有STKC催化结构域。蛋白苏氨酸/丝氨酸激酶是十分常见的一类蛋白激酶[21],主要作用是蛋白磷酸化、去磷酸化,有利于细胞内活性[22]。S-TKC是这类激酶中一个位于核心部位重要的催化结构域[23]。在S-TKC中有一个极其保守的区域,在催化结构域它已被证明是涉及ATP的结合,即赖氨酸残基附近N-末端的一个富含甘氨酸的残基。在S-TKC的中间区域,存在一个天冬氨酸残基,在催化结构域它已被证明对酶的催化活性起显著作用[24-26]。拥有S-TKC催化结构域的基因通常参与许多生理生化过程[27-30],若其构造折叠或变化,会对丝氨酸/苏氨酸蛋白激酶产生影响,从而对个体的生殖发育过程造成极大损害[31],这说明MAP2K1基因可能参与了三角帆蚌个体的生殖发育过程。
不同物种之间的序列比对结果显示,MAP2K1基因在三角帆蚌中的氨基酸序列与其他物种结构域重合度较高,说明与其他物种相似度较高,尤其与虾夷扇贝等软体动物相似度更高,由此推断在进化过程中,MAP2K1基因呈现高度保守状态。各组织、早期发育阶段、不同发育时期的定量结果说明,MAP2K1基因在卵巢中特异性高表达,在1—8月龄时期均有不同程度的表达,在1、2、3龄卵巢中的表达量均高于睾丸,对小鼠[14]、水牛[15]、鹅[5]、斑节对虾[14]及果蝇[16]MAP2K1基因的研究中,均发现雌性表达量高于雄性,与本实验结果相近,由此推测MAP2K1基因是三角帆蚌中的偏雌性基因,既参与了三角帆蚌的早期发育阶段,也参与了卵巢发育过程。根据原位杂交的探针定位显示,MAP2K1基因在卵母细胞及卵子上存在明显的信号,推测MAP2K1基因可能参与了三角帆蚌的卵巢发育过程。
RNA干扰结果显示,3条干扰链中干扰链2和干扰链3对C-MOS基因起到抑制作用,但是干扰链3的干扰效果最佳,在雌性和雄性中的干扰率分别为84.21%和96.87%。在选取干扰链3观察干扰C-MOS基因后MAP2K1基因的表达情况中,MAP2K1基因在雌性中的表达量下降了82.31%,在雄性中的表达量下降了73.60%。结果显示在三角帆蚌中,C-MOS基因对MAP2K1基因有显著的调控作用。在脊椎动物卵母细胞MAPK信号通路中,MAPK独立于生长因子和酪氨酸激酶受体而被激活,受特殊上游调节剂激酶MOS的控制,在卵母细胞减数分裂中起关键作用[9]。综上,推测在三角帆蚌中,MAP2K1基因可能参与了三角帆蚌的卵巢发育过程,是偏雌性基因。
