维氏气单胞菌重要致病因子基因对环境条件的响应
2022-10-25邓益琴孙承文林梓阳苏雯晓刘梦瑶程长洪郭志勋
王 茜 ,邓益琴,孙承文,林梓阳,苏雯晓,刘梦瑶,程长洪,郭志勋,冯 娟
1. 天津农学院,天津 300392
2. 中国水产科学研究院南海水产研究所/农业农村部南海渔业资源开发利用重点实验室,广东 广州 510300
3. 中国水产科学研究院珠江水产研究所,广东 广州 510380
维氏气单胞菌 (Aeromonas veronii),隶属于气单胞菌属[1],是一种革兰氏阴性短杆菌[2],普遍存在于水环境中[3-4],可引起草鱼 (Ctenopharyngodon idella)、罗非鱼 (Tilapia mossambica) 等多种淡水鱼类患病[5-6],常表现出体表溃烂、腹腔充血和脏器不同程度出血等症状,严重时可导致其死亡[7];同时,维氏气单胞菌引发的鱼病具有传染性强、死亡快的特点[8-9],可造成巨大经济损失。除了会危害多种鱼类外,维氏气单胞菌还可导致青虾 (Macrobrachium nipponense) 和中华绒螯蟹 (Eriocheir sinensis) 等甲壳类动物出现“软壳病”[10];造成林蛙 (Rana amurensis) 的“红腿病”等;还会引起人类的腹泻、胃肠炎、脑膜炎等[11-12],是一种人、兽以及水生动物共患的条件致病菌[13]。
维氏气单胞菌具有多种与其致病性相关的因子[14-15],如鞭毛蛋白、密度感应系统 (Quorum sensing, QS) 和Ⅲ型分泌系统 (Type Ⅲ secretion system, T3SS) 等,在细菌的致病过程中起到重要作用[16]。T3SS是一个由内外膜环、尖针和转位子组成的纳米注射器样系统[17-18],可以将毒性蛋白直接注射到宿主细胞的细胞质中,进而负责毒力因子的转运[19],是维氏气单胞菌目前研究最多的分泌系统。Sha等[20]通过构建缺失突变体,其毒性和致病性降低,证明了它作为毒力因子的作用。ascF基因调控的蛋白是T3SS系统的重要组成部分,与其致病性密切相关,温度、盐度及pH等不同环境因子会影响T3SS基因的表达,进而影响其致病能力[21]。鞭毛蛋白是气单胞菌重要的毒力因子之一,是TOLL样受体5 (TLR5) 的重要配体,从而介导细菌的黏附和入侵[22]。Tian等[23]剖析了鞭毛结构,表明鞭毛蛋白可以黏附在宿主表面形成生物膜,有助于效应蛋白穿透宿主细胞结构,揭示了鞭毛参与细菌运动和致病机制等。fliE基因编码形成的蛋白位于鞭毛蛋白的杆状结构,可以和FlgB蛋白相互作用,起到稳定和激活作用[24-25],对于鞭毛蛋白分泌、鞭毛装配和TLR5诱导的促炎反应至关重要[26]。QS 是细菌细胞间常见的一种通讯机制[27],能够通过分泌一些小分子自诱导物 (Autoinducer, AI) 相互感知[28],造成细菌致病性的改变[29]。luxR基因编码的家族调控蛋白在细菌群体感应信号系统中起到枢纽作用,可以参与到细菌发光、QS调控、致病性及生物膜形成等多个生物学过程中[30]。
对嗜水气单胞菌 (A. hydrophila) 的研究表明,环境因子可能与细菌的致病机制相互作用,导致细菌毒力和抗性增加,其毒性的表达受温度、pH及营养物质等外界环境因子影响[31]。然而,目前关于不同环境条件对维氏气单胞菌的重要致病因子表达及其致病性影响的研究较少。本文通过实时荧光定量PCR技术检测2株维氏气单胞菌ascF、fliE、luxR基因对温度、pH、培养转速、无机盐离子等环境条件的响应,探究环境因子对毒力因子致病机制的影响,为进一步探究外界环境条件对维氏气单胞菌致病性的影响,分析其致病机制,并建立维氏气单胞菌病的预警模式提供参考。
1 材料与方法
1.1 菌株
维氏气单胞菌菌株分离自广东省珠海市某花鲈养殖场,对分离到的菌株进行革兰氏染色,通过16S rDNA通用引物和gyrB基因引物进行分子鉴定,进一步对斑马鱼 (Danio rerio) 进行攻毒感染实验。经过分子鉴定分析得到2株不同分子分型的强毒株18BJ181 (菌A)、18BW235 (菌B),通过攻毒感染实验表明两者对斑马鱼的毒力具有一定差异,故选为实验菌株进行后续实验。
1.2 试剂与培养基
本实验所用的主要试剂有逆转录试剂盒 (Evo M-MLV反转录试剂盒Ⅱ,艾科瑞生物),荧光定量反应试剂盒 (SYBR Green ProTaqHS预混型qPCR试剂盒,艾科瑞生物),Trizol (TRNzol Universal总RNA提取,天根科技公司),RNAlater固定保存液 (赛默飞科技有限公司),硫酸铜 (CuSO4)、硫酸亚铁 (FeSO4)、硫酸锌 (ZnSO4)、硫酸镁(MgSO4) (广州化学试剂公司);胰蛋白胨大豆肉汤(Tryptic Soy Broth, TSB) 培养基 (广东环凯生物科技有限公司)。
1.3 菌株活化与培养
将实验室冻存的维氏气单胞菌液于TSA培养基上划线接种,28 ℃培养24 h,再挑取单菌落接种于TSB培养基中,28 ℃、180 r·min-1培养过夜,测定菌液的OD600,同时用平板计数法测定活菌浓度。
1.4 菌株毒力因子对环境因素的响应
1.4.1 对温度的响应
将过夜培养的菌液按5%的体积比分别接种于含有200 mL TSB培养基的统一规格的500 mL三角瓶中,分别在25、28和31 ℃下,180 r·min-1、不添加无机盐离子的条件下培养,每组设置3个平行。培养14 h后取2 mL菌液,8 000 r·min-1离心5 min,弃上清,加入2 mL RNAlater固定液,-80 ℃保存。
1.4.2 对 pH 的响应
将过夜培养的菌液按5%的体积比分别接种于pH为6.0、6.5、7.0、7.5、8.0的含有200 mL TSB培养基的统一规格的500 mL三角瓶中,每个pH设置3组平行。28 ℃、180 r·min-1、不添加无机盐离子的条件下培养14 h。然后取2 mL菌液,8 000 r·min-1离心5 min,弃上清,加入2 mL RNAlater固定液,-80 ℃保存。
1.4.3 对无机盐离子的响应
将过夜培养的菌液按5%的体积比分别接种于添加5 g·L-1的无机盐离子 [亚铁离子 (Fe2+)、铜离子 (Cu2+)、镁离子 (Mg2+)、锌离子 (Zn2+)] 的含有200 mL TSB培养基的统一规格的500 mL三角瓶中,28 ℃、180 r·min-1的条件下培养,每组设置3个平行。培养14 h后取2 mL菌液,8 000 r·min-1离心5 min,弃上清,加入2 mL RNAlater固定液,-80 ℃保存。
1.4.4 对培养转速的响应
将过夜培养的菌液按5%的体积比分别接种于含有200 mL TSB培养基的统一规格的500 mL三角瓶中,分别在不同转速150、180、210、240 r·min-1下,28 ℃、不添加无机盐离子下培养,每组设置3个平行。培养14 h后取2 mL菌液,8 000 r·min-1离心5 min,弃上清,加入2 mL RNAlater固定液,-80 ℃保存。
1.5 RNA的提取及cDNA合成
将上述样品取出后,按照Trizol法提取菌液的RNA。依照Evo M-MLV反转录试剂盒Ⅱ说明书合成cDNA,作为荧光定量PCR模板。
1.6 荧光定量PCR
根据各毒力因子的DNA序列设计qPCR特异性引物 (表1),内参基因为16S rDNA。根据SYBR Green ProTaqHS预混型qPCR试剂盒说明书进行荧光定量PCR反应。
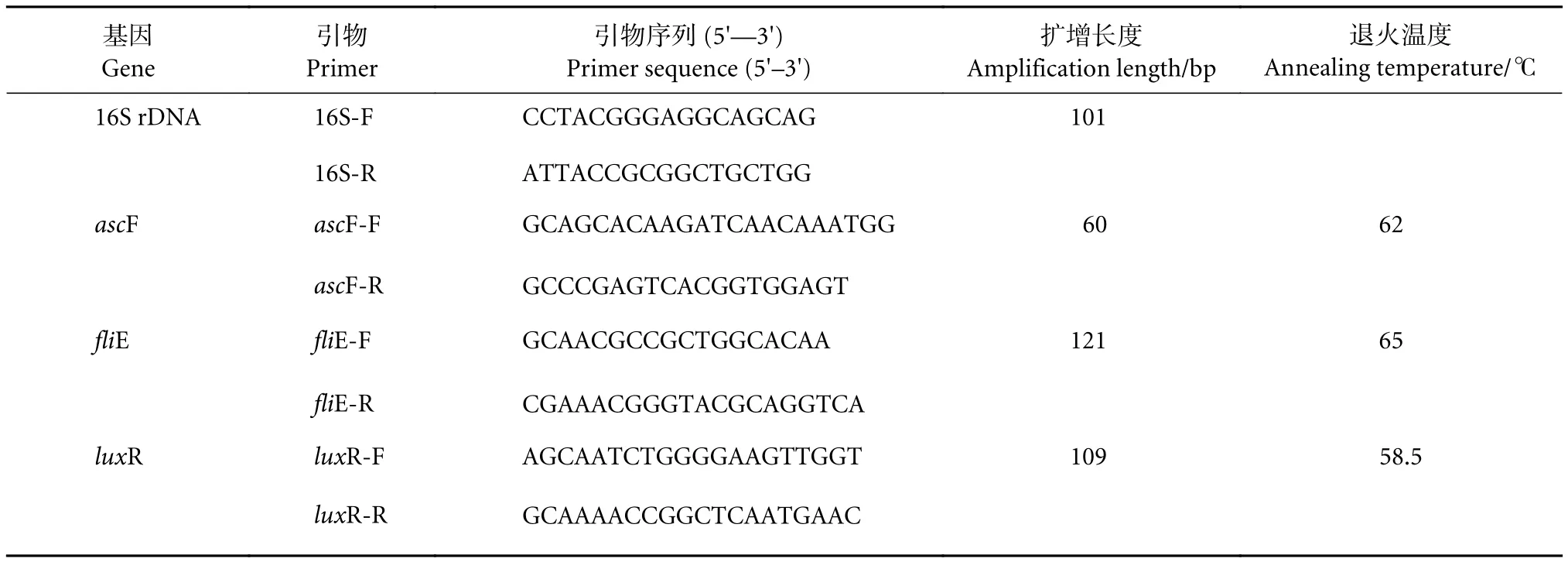
表1 引物序列Table 1 Primer sequence
1.7 数据分析
以16S rDNA为内参,根据2-ΔΔCT法计算各毒力因子的相对表达量,结果用Excel 2016软件做柱状图,同时用SPSS 22.0软件进行统计学分析。
2 结果
2.1 毒力因子对温度的响应
温度是影响维氏气单胞菌生长的重要因素,本实验设定的25~31 ℃对维氏气单胞菌的生长无显著影响,培养14 h后其菌量均可达到 (2~3) ×109CFU·mL-1。由于在适宜的温度范围内,菌A的asc-F和fliE基因总体没有较大差异 (图1),fliE基因对温度呈现“凸”型响应模式,在28 ℃时响应最高,而在25和31 ℃下表达量较低;luxR基因对温度的响应较为明显,在28 ℃时表现出较高的表达量。菌B的ascF和fliE基因对较低温度 (25 ℃)响应比较明显,表达量显著高于28和31 ℃;fliE基因对温度的变化呈现“凹”型模式。这与菌A的表达模式不同,而luxR对温度的响应则同菌A一致。

图1 维氏气单胞菌ascF、fliE、luxR毒力基因对温度的响应注:*. 与对照组相比,具有显著差异 (P<0.05);**. 与对照组相比,具有极显著差异 (P<0.01)。后图同此。Fig. 1 Responses of virulence factors (ascF, fliE, luxR) of A. veronii to temperatureNote: *. Significant difference compared with the control group (P<0.05); **. Very significant difference compared with the control group (P<0.01). The same case in the following figures.
2.2 毒力因子对pH的响应
2株菌的ascF、fliE和luxR基因对pH的响应见图2。ascF、fliE和luxR基因在pH为6.5偏酸性条件时的表达量较高,当pH升高至8.0偏碱性条件时,表达量有所降低,同细菌生长的最适pH介于7.0~7.5并不一致,说明在较高的菌浓度中,毒力因子对pH的响应同细菌本身的生长无关。有意思的是,2株菌的ascF基因的表达模式相同,而fliE和luxR基因的响应模式有较大差异,其中菌B对pH响应较强,而菌A响应较弱。
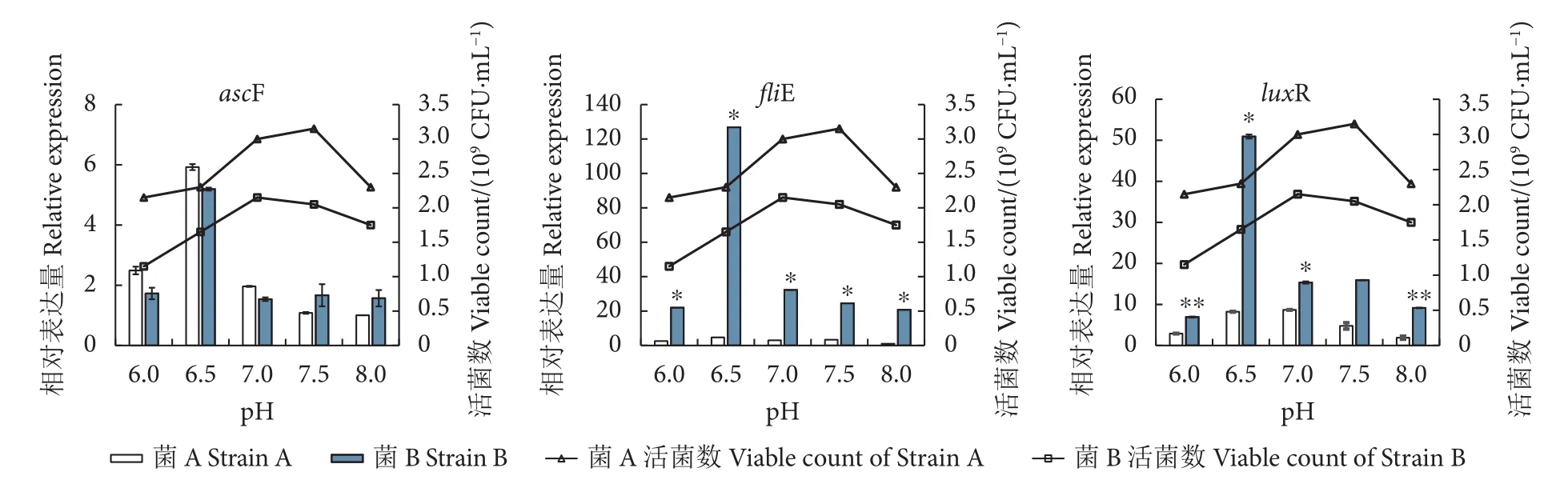
图2 维氏气单胞菌ascF、fliE、luxR毒力基因对pH的响应Fig. 2 Response of virulence factors (ascF, fliE, luxR) of A. veronii to pH
2.3 毒力因子对无机盐离子的响应
图3为2株菌的ascF、fliE和luxR基因对无机盐离子种类的响应。与不添加无机盐离子的对照组相比,分别添加 5 g·L-1Fe2+、Cu2+、Zn2+和 Mg2+的实验组对维氏气单胞菌的生长具有显著的抑制作用,培养14 h后其菌量仅有108CFU·mL-1。ascF、fliE和luxR基因在添加Zn2+和Mg2+时的表达量较高,对于Fe2+则呈现负响应模式;菌A和菌B对Zn2+的响应模式不同,菌A响应较强,菌B则较弱;与Zn2+不同的是,2株菌的ascF、fliE和luxR基因对Cu2+响应模式的差异在于菌B有较强的响应,而菌A响应较弱。
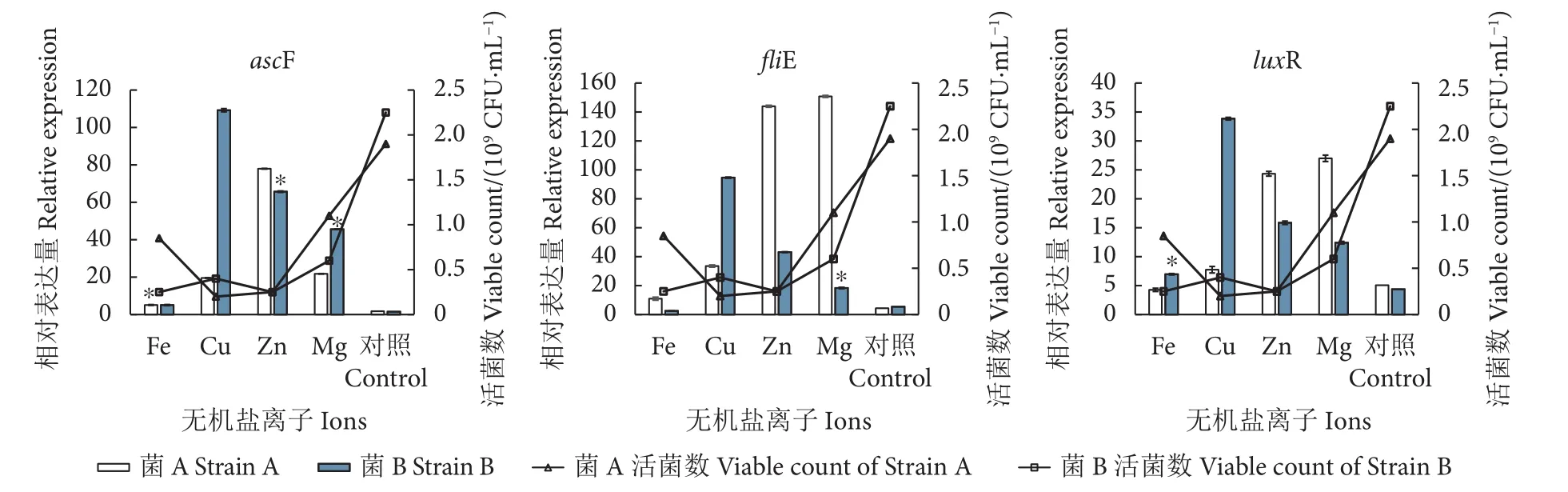
图3 维氏气单胞菌ascF、fliE、luxR毒力基因对无机盐离子的响应Fig. 3 Response of virulence factors (ascF, fliE, luxR) of A. veronii to ions
2.4 毒力因子对转速的响应
转速主要与培养基中的溶解氧相关,同时也代表一定情况下细菌接触和利用培养基中的营养物质的不同生长情况。2株菌的生长对转速的响应表现不太一致,菌A在低转速情况下其生物量显著低于高转速,而菌B对转速的响应则无显著差异。同时,2株菌的3个基因在对培养转速的响应上表现出很大差异 (图4)。整体而言,ascF基因的表达量普遍偏低,其差异并不显著;菌A的fliE基因的表达量较低,而菌B则表现出对于高转速的负响应;luxR基因对于转速有最优响应范围,菌A为210 r·min-1,菌 B为 150 r·min-1。
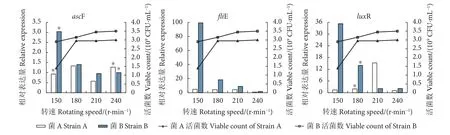
图4 维氏气单胞菌ascF、fliE、luxR毒力基因对转速的响应Fig. 4 Response of virulence factors (ascF, fliE, luxR) of A. veronii to rotating speed
3 讨论
本实验以2株维氏气单胞菌的ascF、fliE和luxR致病因子为研究对象,通过实时荧光定量PCR技术从转录水平上研究了3个基因对温度、pH、转速和无机盐离子等环境因子的响应,并探究了维氏气单胞菌的致病性和环境条件间的关系。结果显示:维氏气单胞菌的ascF、fliE和luxR毒力因子的表达受环境因子调控,在偏酸性 (pH 6.5~7.0)、中低转速 (150~210 r·min-1) 及 Zn2+、Mg2+环境下,3种基因对环境条件的变化为正响应模式,相对表达量上调;而在偏碱性 (7.5~8.0)、高转速 (240 r·min-1) 和 Fe2+、Cu2+环境下,3种基因的表达受抑制,呈现负响应模式。
外界环境的pH变化可能会影响细菌生物膜的功能,如T3SS的跨膜转运功能,进而对毒力基因表达量产生影响[32]。2株维氏气单胞菌的ascF和fliE毒力基因在pH为8.0偏碱性条件下的表达量比pH为6.5和7.0的要低,表明其对低pH为正响应,即在偏酸环境中,菌株更具有侵袭性,其致病性更强。在对嗜水气单胞菌的毒力基因表达研究中也发现,菌株的4种毒力基因在中性或偏酸性条件下均得以表达,在碱性条件下只有1种毒力因子得以表达[33],这与本文结果相似;Roy等[32]通过研究在不同温度和pH下沙门氏菌 (Salmonella) 生物膜的形成表明,偏碱性环境下 (pH 7.0~8.0) 其生物膜更容易形成,且毒力基因的表达也有明显提高,此结论与本文研究结果恰恰相反,表明不同菌种的致病机制可能有所差异。
环境温度影响是细菌生长繁殖及毒力因子表达最重要的因素之一,其变化会影响细菌体内多种重要蛋白的分泌及转运,导致细菌毒力因子表达的变化。本实验中,2株菌的3个基因对温度的响应有明显差异,luxR基因在28 ℃时表达量较高,菌A的ascF基因在31 ℃表达量最高,fliE毒力基因在28 ℃时表达量最高;而菌B的ascF和fliE毒力因子在25 ℃时表达量最高,菌B对温度变化的响应偏低。也有研究表明,溶藻弧菌 (Vibrio alginolyticus) T3SSvscO基因的表达对温度存在显著的响应[34],铜绿假单胞菌 (Pseudomonas aeruginosa) T3SS基因的表达受环境因子调控,环境因子通过影响cAMP (环磷酸腺苷) 在细胞内的表达水平从而调节其功能[35]。本实验的维氏气单胞菌ascF基因的表达则呈现典型的个体差异,说明了T3SS对温度响应的多样性。
本实验中,当转速调节至240 r·min-1时,培养基中的溶解氧增高,细菌接触培养基中的营养物质的表面积增加,致使细菌扩增速度增加,细菌生物量增多,进而导致细菌间密度增大,这可能降低了LuxR蛋白的C端与目的基因转录起始区域的特异性结合及转录功能,促进了QS的抑制作用,进而导致维氏气单胞菌的luxR基因表达量降低。对海参中的一种腐败菌蜂房哈夫尼菌 (Hafnia alvei)的研究表明,当改变外界环境因素时,其分泌的AI含量及活性均有不同程度的改变,证实了QS具有密度依赖性,与环境条件改变相关并呈现规律性变化[36]。本实验中,在pH为8.0的偏碱性及31 ℃环境下,维氏气单胞菌的luxR毒力基因的表达量均比pH为7.5和28 ℃时的表达量低,表明在偏碱性及31 ℃的环境下,维氏气单胞菌的QS可能受到了影响,导致其生物膜形成、毒力的转运及表达功能受到抑制,从而使luxR基因的表达量下降[37]。
本研究通过探究维氏气单胞菌的ascF、fliE和luxR 3种致病因子在不同环境条件下基因表达量的变化表明,3种致病因子的表达受环境因素的调控,并呈现规律性变化,当外界环境改变时,细菌可通过自身系统的改变调节相关基因的表达,进而避免不利环境的影响。通过探究致病因子对不同环境条件的响应,可为进一步探究外界环境对维氏气单胞菌致病性的影响,分析其发病机制提供一定的理论依据,为建立维氏气单胞菌病的预警模式开拓新的思路。
