传染性法氏囊病病毒超强毒株ZHA001株的分离及鉴定
2022-10-25于雷,潘雨,高洁,迟鑫,刘硕
于 雷,潘 雨,高 洁,迟 鑫,刘 硕
(北京中海生物科技有限公司,北京 100081)
传染性法氏囊病(infectious bursal disease,IBD)是由传染性法氏囊病病毒(infectious bursal disease virus,IBDV)引起的一种危害青年鸡的烈性、高度接触性的病毒病[1],1957年首次出现于美国[2]。我国自1979年发现该病以来[3],全国各地陆续有该病发生和流行的报道。
IBDV属于双RNA病毒科,其基因组由A、B两节段组成,编码5种蛋白,分别为VP1、VP2、VP3、VP4和VP5[4]。其中VP2是IBDV的主要结构蛋白和宿主保护性抗原,还与病毒毒力、抗原变异及细胞凋亡等有关[5]。目前已把VP2作为基因工程亚单位疫苗的主要目的基因进行研究。
依据致病性和抗原性的差异,血清Ⅰ型IBDV野毒株可分为经典毒株、变异毒株和超强毒株(very virulent IBDV,vvIBDV)[6]。自1990年以来,我国和其它国家及地区不断分离到vvIBDV,它能突破由经典毒株致弱的活疫苗或灭活疫苗提供的保护作用,导致雏鸡发病[7]。vvIBDV的高致死率给养禽业造成了巨大经济损失[8]。
山东某肉鸡场在B87活疫苗免疫后仍发生疑似传染性法氏囊病的病例。从发病死亡的鸡只上采集病料组织,进行病毒分离鉴定,分离到一株vvIBDV,对VP2基因进行了克隆和序列分析,从分子水平研究其毒力和基因变异情况,并对其致病性等进行了研究,解释免疫鸡群发病的原因,以期为该病的防治提供参考。
1 材料与方法
1.1 病料 采自山东某817肉鸡场疑似法氏囊病的病鸡法氏囊组织。
1.2 SPF鸡胚和SPF鸡 购自北京勃林格殷格翰维通生物技术有限公司。
1.3 标准品 IBDV阳性血清、IBDV琼扩抗原等由北京中海生物科技有限公司提供。
1.4 主要试剂及试剂盒 病毒核酸提取试剂盒、反转录试剂盒、PCR试剂盒、DNA凝胶回收提取试剂盒、pEASY©-T1 Cloning Kit等均购自北京全式金生物技术有限公司。
1.5 引物设计与合成 VP2基因扩增引物参照文献[9],上游引物为5′-CGAATTCATGACAAACCTGCAAGAT-3′,下游引物为5′-CCGCTCGAGTCACCTTAGGGCCCGGATTAT-3′。由北京三博远志生物技术有限公司合成。
1.6 病料处理 采集出现典型症状和病理变化的病死鸡法氏囊组织。将法氏囊组织剪碎,称重后按照1∶5比例(m/V)加入灭菌生理盐水(加入终浓度为2000 单位/mL的青、链霉素),放入研磨器中研磨,得到匀浆液;冻融3次;加入等体积氯仿,低温振荡作用过夜;4 ℃、10000 g离心5 min,取上清液。-70 ℃冷冻保存备用。
1.7 病毒分离 将上清液点眼接种4周龄SPF鸡5只,0.1 mL/只。接种后每天观察,死鸡随时剖检,无菌采集法氏囊;接种后96 h剖检存活鸡,收集病变法氏囊。法氏囊组织按照1∶5比例(m/V)加入灭菌生理盐水研磨,冻融3次后10000 g离心5 min,取上清液作为试验用毒种,-70 ℃冷冻保存备用。
1.8 琼脂扩散试验(AGP) 按常规方法进行:琼脂板用梅花打孔器打孔,中间孔加入IBDV阳性血清,周围孔分别加入分离株病毒液、标准IBDV琼扩抗原及生理盐水对照,37 ℃湿盒中孵育36 h,观察结果。
1.9 病毒RNA的提取 试验用毒种融化后用试剂盒提取病毒RNA。
1.10 VP2基因扩增及克隆与测序 以提取的病毒RNA为模板,通过下游引物进行反转录获得cDNA,以cDNA为模板,通过上、下游引物,经PCR扩增VP2基因。反应条件为:95 ℃ 5 min;94 ℃ 30 s,57.8 ℃ 30 s,72 ℃ 1 min 30 s,30个循环;72 ℃ 10 min。利用DNA凝胶回收试剂盒回收目的基因,与pEASY©-T1载体连接后转化Trans 5α感受态细胞,挑选阳性克隆,提取质粒,送北京三博远志生物技术有限公司测序。
1.11 VP2基因的序列分析 利用DNAStar软件对分离株及GenBank上其他毒株(表1)的VP2基因进行核苷酸序列和氨基酸序列比对,采用MEGA软件中Neighbor-Joining(NJ)方法进行遗传演化分析,并绘制系统进化树。

表1 IBDV参考毒株信息Tab 1 Information of reference IBDV strains
1.12 鸡胚半数致死量(ELD50)的测定 试验用毒种用灭菌生理盐水进行10倍系列稀释,取10-2~10-6共5个稀释度,每稀释度经绒毛尿囊膜途径接种鸡胚5枚,0.2 mL/枚,置37 ℃孵育168 h,记录各组鸡胚死亡情况及胚体病变,根据Reed-Muench法计算ELD50。
1.13 外源病毒检验 用灭菌生理盐水将试验用毒种稀释至103.5ELD50/0.1 ml,与等量鸡传染性法氏囊病阳性血清混合,37 ℃作用60 min。按照《中国兽药典》2020年版三部附录3505外源病毒检验法中“1 禽源制品及其细胞的检验”[10]中“1.2 鸡胚检查法”和“1.3 细胞检查法”进行。
1.14 致病性试验 用4周龄SPF鸡15只,随机分成2组,第1组10只,各点眼接种试验用毒种104.0ELD50(0.1 mL);第2组5只,不接种作为对照。两组鸡在相同条件下隔离饲养,连续观察96 h,观察各组鸡临床表现,对病死鸡进行剖检,并记录死亡数量及病理变化。
2 结果与分析
2.1 病毒的分离与鉴定 IBDV病料接种SPF鸡进行病毒分离,96 h内死亡3只,剖检可见法氏囊充血,肿胀,外观似紫葡萄样;2只存活鸡96 h时精神沉郁,羽毛蓬松,剖检法氏囊出现胶冻样肿胀。无菌采集所有鸡只法氏囊,经处理后作为试验用毒种。对其进行RT-PCR检测和琼脂扩散试验,核酸电泳后出现一条约1400 bp的条带,与预期大小相符(图1);琼脂扩散试验中,待检毒种与阳性血清孔间出现了一条乳白色沉淀线,与标准IBDV琼扩抗原阳性对照相同,而生理盐水阴性对照无沉淀,结果表明IBDV阳性。将该IBDV分离株命名为ZHA001株。

图1 RT-PCR扩增VP2基因Fig 1 Amplification of VP2gene with PT-PCR
2.2 序列测定结果及同源性分析 测序结果表明,ZHA001株VP2基因大小为1356 bp,编码452个氨基酸。利用DNAStar软件对该毒株及血清I型参考毒株的VP2基因核苷酸及推导的氨基酸序列进行同源性分析。结果显示,ZHA001株与其他IBDV毒株的核苷酸同源性超过90.1%,其中与超强毒株UK661和OKYM株的同源性为97.9%,与超强毒株HLJ19-6101株的同源性最高,为99.1%;与超强毒株氨基酸序列的同源性均大于99 %。
2.3 ZHA001株VP2高变区氨基酸分析 对ZHA001株VP2高变区的氨基酸进行分析,与参考毒株的特征性氨基酸位点进行比较,发现ZHA001株与超强毒特征性氨基酸位点相一致(表2),七肽区(326~332)也与超强毒株完全相同,为“SWSASGS”。
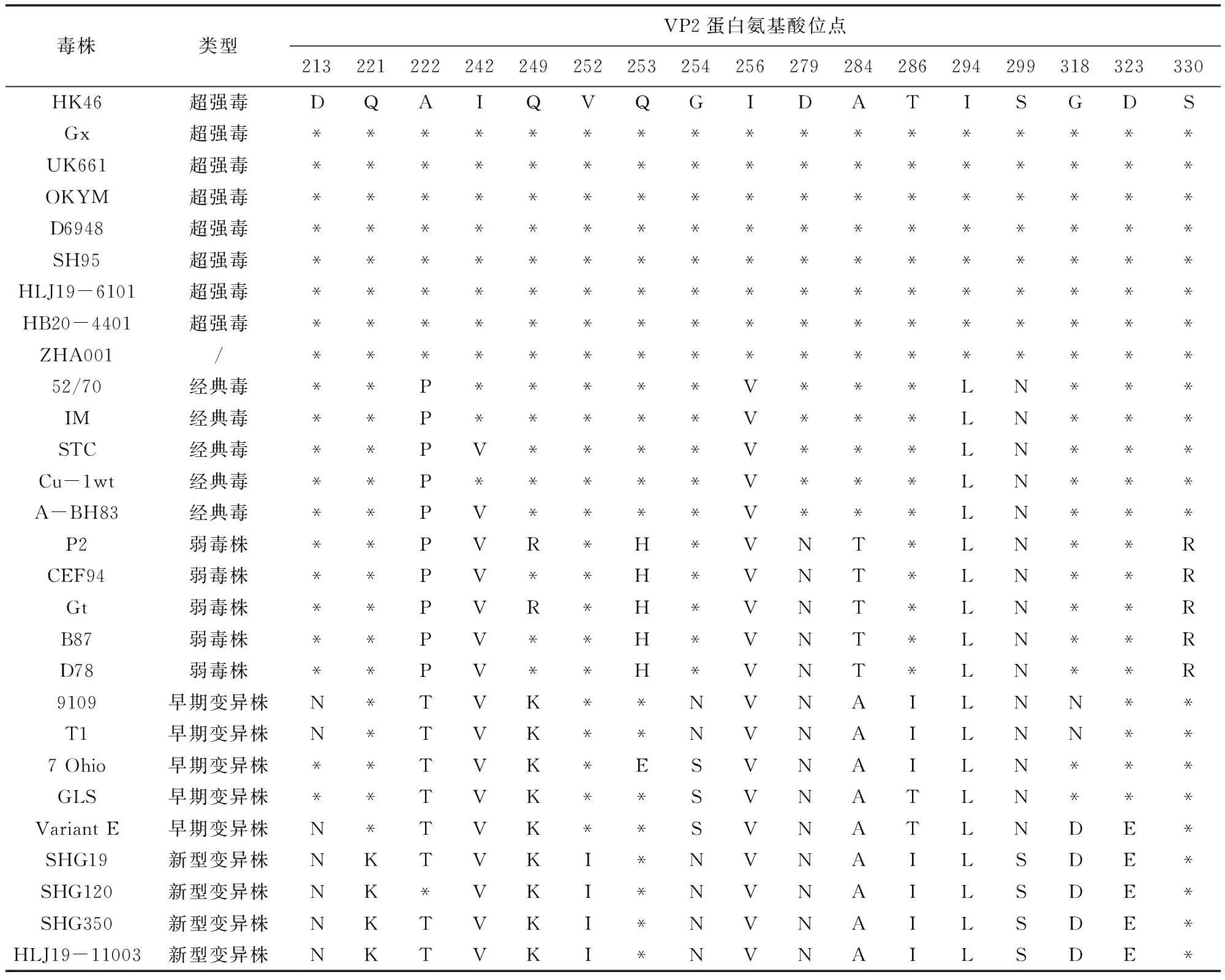
表2 IBDV VP2基因高变区氨基酸比对结果Tab 2 The amino acid alignment of IBDV VP2 gene hypervariable region
2.4 遗传进化分析 基于VP2基因的核苷酸序列遗传进化树显示,血清I型的IBDV毒株可分为经典毒株、超强毒株、弱毒株和变异毒株等不同分支;IBDV ZHA001株与超强毒株(UK661、OKYM、Gx、HK46、D6948、HLJ19-6101、HB20-4401、SH95等)在同一进化树分支(图2)。

图2 ZHA001株VP2基因进化树分析Fig 2 Phylogenetic analysis of ZHA001 based on VP2
2.5 鸡胚半数致死量测定 将试验用毒种系列稀释后接种10日龄鸡胚,根据接种后鸡胚的死亡情况,计算出ZHA001株的ELD50为10-4.38/0.2 mL。死胚表现为绒毛尿囊膜增厚,胚体水肿、脑部充血,剖检可见肝脏斑驳状病变。
2.6 外源病毒检验 试验用毒种与特异性阳性血清中和后接种SPF鸡胚和鸡胚成纤维细胞,培养后进行判定。结果,鸡胚检查法中两种途径接种的鸡胚胎儿均发育正常,绒毛尿囊膜无病变,取接种鸡胚的鸡胚液进行红细胞凝集试验,结果均为阴性;细胞检查法中,接种的细胞无细胞病变,对细胞进行红细胞吸附试验,未出现红细胞吸附现象。上述结果表明该试验毒种无外源病毒污染,毒种纯净。
2.7 毒力试验 IBDV ZHA001株接种SPF鸡后36 h,部分鸡只精神沉郁,拉白色或绿色稀便。48 h,所有接种鸡精神沉郁,羽毛蓬松。48~96 h内死亡9只,剖检见法氏囊呈紫葡萄样(图3A)。1只鸡濒死,剖检法氏囊出现充血、肿胀。非接种对照组5只鸡均健活,剖检法氏囊无异常(图3B)。结果表明ZHA001株为超强毒株。
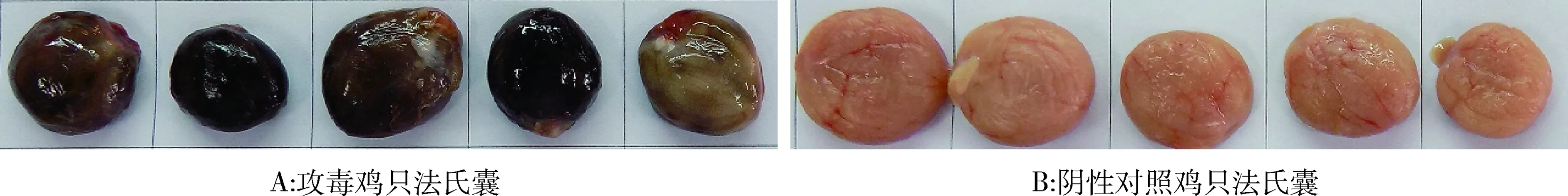
图3 ZHA001株致病性试验Fig 3 Challenge test of IBDV ZHA001
3 讨论与小结
传染性法氏囊病病毒主要侵害鸡,尤其是超强毒株,自20世纪90年代以来对我国养禽业造成重大经济损失。然而,随着饲养环境的改善和疫苗的广泛应用,超强毒株得到了很好的控制,仅呈现点发[11]。2017年以来不同于早期变异株的新型法氏囊变异株在国内开始流行[12-13],且流行范围仍在扩大[6]。本次超强毒株的分离,也表明了目前新型变异毒株流行的同时超强毒株并未消失。
目前对IBDV 分子流行病学研究集中在该病毒VP2 基因的高变区,VP2 基因与病毒中和抗体的诱导、抗原的变异以及毒力有关[14],VP2高变区氨基酸变化较大,因此对该区域的分子特征进行研究不仅可以发现IBDV的抗原性变化,还可提供IBDV毒株遗传进化信息。本研究克隆了IBDV ZHA001株VP2基因,并对其与NCBI上其他IBDV毒株进行比较分析。结果表明,分离毒株与其他IBDV 超强毒株的核苷酸相似性均超过97.6%,氨基酸相似性均超过99.3%,并且具有222A、242I、279D、256I、284A、294I和299S等超强毒株特征性氨基酸[15-17],从分子水平说明ZHA001株为IBDV 超强毒株;从进化树也可以看出,ZHA001株与8个超强毒的参考毒株位于同一个大的分支。致病性试验中,SPF鸡感染率10/10,死亡率9/10,符合超强毒株特性[18],与VP2基因序列分析和进化树分析一致。
分离ZHA001株的养鸡场在发生IBD前免疫过B87活疫苗,如果不是免疫失误,那么可能是超强毒突破疫苗保护所致,因为IBDV超强毒株能够突破高水平抗体的保护,导致鸡群高死亡率[1]。当然也不排除与抗原变异有关,ZHA001株VP2第212位氨基酸(D→N)、384位氨基酸(V→I)发生改变,尤其第212位氨基酸位于VP2的第一亲水区(212 ~224AA),该区域氨基酸的改变可能引起VP2抗原性改变,造成抗原变异。这种改变是否会造成抗原的剧烈改变还需进一步研究。
本次从免疫传染性法氏囊病活疫苗的发病肉鸡群分离到一株IBDV,命名为ZHA001株,经鉴定为超强毒株。本研究可为传染性法氏囊病的防控提供参考。
