严重急性呼吸综合征冠状病毒2膜蛋白对宿主细胞pre-mRNA 3'UTR加工的影响*
2022-10-25欧阳歆曾先燕娄哲琦谭正宗钱昱舟
欧阳歆 曾先燕 谷 斌 娄哲琦 黄 进 谭正宗 于 倩 车 雨 钱昱舟 朱 勇
(重庆医科大学生命科学研究院,重庆 400016)
严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2),引发的新型冠状病毒肺炎(COVID-19)疫情仍然在全球范围内广泛传播,严重危害人类健康。SARSCoV-2是一种有包膜包被的单链RNA病毒,具有极高的传染性[1]。SARS-CoV-2编码4种结构蛋白,包括S(spike)、M(membrane)、E(envelope)、N(nucleocapsid),其中M蛋白是一个跨膜蛋白,拥有两个跨膜结构域,是SARS-CoV-2编码的结构蛋白中最丰富的蛋白质,并且与多种病毒功能相关[2]。M蛋白具有高度保守的特性,因此适合作为COVID-19治疗的药物靶点[3]。现有研究表明,M蛋白可以通过干扰宿主细胞应对病毒感染的重要细胞生物过程中关键因子的表达和功能,以帮助病毒逃避宿主免疫反应的攻击或者影响宿主细胞的存活[4-5],但是其中具体分子机制仍需进一步阐明。
Banerjee等[6]研究发现,SARS-CoV-2编码的蛋白质可通过与宿主RNA的相互作用,从转录、转录后、翻译和翻译后调控等多个层面调控宿主基因表达,破坏这些重要的细胞功能可以抑制宿主抗病毒因子的产生和功能。转录后调控包括选择性剪接和选择性多聚腺苷酸化 (alternative polyadenylation,APA),APA是一种通过对premRNA 3'端进行加工、调控基因的表达及功能的机制[7]。pre-mRNA 3'端加工可以发生在3'非翻译区(untranslated regions,UTR)或者编码区,主要包括两个步骤,即切割和聚腺苷酸化[8]。大约70%的人类pre-mRNA上有多个polyA位点,由premRNA上的序列元件和APA调控因子相互作用决定选择不同位置的polyA位点,由此产生具有不同3'UTR长度的mRNA亚型。mRNA的稳定性、定位和翻译效率很大程度受3'UTR长度影响,因为3'UTR存在一系列特殊的序列元件,如miRNA和RNA结合蛋白位点[7-10]。近期,有研究发现,COVID-19患者大多数基因发生动态APA事件且呈现3'UTR缩短,并且这些基因富集于抗病毒免疫反应中,揭示了APA在SARS-CoV-2调节宿主抗病毒免疫反应中的作用[11]。但目前关于SARS-CoV-2编码的蛋白质对宿主pre-mRNA 3'端加工影响的研究甚少。深入研究SARS-CoV-2编码的蛋白质对宿主pre-mRNA 3'UTR加工的影响,有利于阐明病毒致病机制,以及制定针对性治疗策略。
本研究利用RNA-Seq和生物信息学等方法,分析SARS-CoV-2膜蛋白对宿主细胞pre-mRNA 3'UTR加工的影响,以及发生APA事件的基因表达和功能的变化。
1 材料与方法
1.1 材料
1.1.1 细胞系与质粒
本研究使用的人肺上皮细胞A549和过表达SARS-CoV-2膜蛋白质粒pcDNA3.1-M-3×flag来源于重庆医科大学感染实验室林永教授课题组。pcDNA3.1质粒为本实验室保存。
1.1.2 试剂
胎牛血清(以色列BI公司);DMEM培养基、胰酶、青霉素链霉素(美国gibco公司);转染试剂PEI(美国polysciences公司);Trizol(美国Thermo公司);5×SDS-PAGE蛋白质上样缓冲液、脱脂奶粉、RIPA裂解液、蛋白酶抑制剂、50×磷酸酶抑制剂、化学发光液(北京碧云天公司);反转录试剂盒(美国abcam公司);蛋白质预染marker(美国proteintech公司);SYBR(美国Thermo公司);AKT1、Phospho-AKT1(Thr450)抗体(成都正能生物公司);β-actin抗体(美国Proteintech公司);anti-flag抗体(美国Bethyl公司)。
1.2 方法
1.2.1 细胞培养
A549细胞培养使用含有10%胎牛血清、1%双抗(青霉素-链霉素)的DMEM培养基,在细胞培养箱内37℃,5%CO2培养。
线上活动。一是配合电台早晚上下班高峰节目互动话题,栏目设计有奖问答环节,制作播出访谈节目,三局相关人员分别上线,通过与受众第一时间互动达到政策法规宣传效果。二是制作“听众话国策”“大咖话国策”和“主播话国策”电台宣传视频。三是发动新媒体宣传,联合FM106.4经典车电台、慈溪发布、青春慈溪、慈溪卫生和计划生育、慈溪法治国土、慈溪环保微信公众平台跟踪报道,发布最新消息,拓宽宣传面和受众面。
1.2.2 瞬时转染
提前24 h以每孔3.5×105个细胞的数量将细胞种至六孔板内。在细胞状态良好,并且生长至40%密度时开始转染。首先将六孔板内细胞的完全培养基换成无血清无双抗的基础培养基。将转染试剂PEI和质粒稀释液混合,室温孵育15 min后逐滴加入各孔内,6~8 h后换成完全培养基继续培养。
1.2.3 蛋白质免疫印迹(Western blot)实验
用含有1%蛋白酶抑制剂、2%50×磷酸酶抑制剂的RIPA裂解液,冰上裂解细胞30 min,加入5×SDS-PAGE蛋白质上样缓冲液,95℃高温变性10 min。电泳时分别使用70 V和110 V恒压跑浓缩胶和分离胶;在冰水浴中,使用100 V恒压,100 min的条件转膜。用5%脱脂牛奶封闭2 h。按照相应分子质量切下条带,4℃孵育一抗过夜。次日根据一抗种属孵育二抗。在化学发光成像系统上对蛋白质条带进行曝光成像。
1.2.4 RT-qPCR实验
按照反转录试剂盒说明书步骤将提取好的RNA反转录成cDNA。RT-qPCR采用10µl体系,SYBR 5µl,正 向 引 物0.4µl,反 向 引 物0.4µl,cDNA 2µl,H2O 2.2µl。每个基因设置3个复孔。最后结果分析采用2-ΔΔCt计算相对定量。RT-qPCR引物如表1所示。
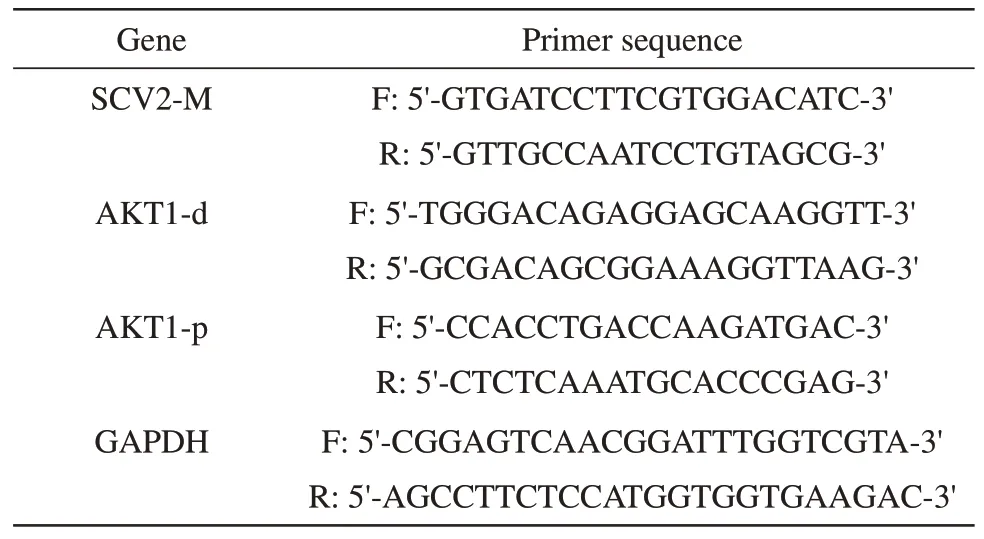
Table1 Primers for RT-qPCR
1.2.5 生物信息学分析
RNA-Seq测序由北京诺禾致源公司完成,在Illumina平台上进行。使用工具包APAlyzer[12]对RNA-Seq数据进行分析,得到发生APA事件的基因。本研究主要分析3'UTR区域APA,使用每个基因3'UTR上第一个和最后一个多聚腺苷酸化位点[12]。每个基因3'UTR的APA可以由一个相对表达量(relative expression,RE)分数表示,此相对表达量分数计算式为log2(RDaUTR/RDcUTR),其中RDcUTR代表在终止子到3'UTR上第一个polyA位点的区域内匹配的序列数比上这段区域的长度,RDaUTR代表在3'UTR上第一个polyA位点到最后一个polyA位点的区域内匹配的序列数比上这段区域的长度。一个基因在两个样本之间的差异用RE差 异(RE difference,RED)来 表 示[12]。APAlyzer的输出结果包括4列,分别是“gene symbol”、“RED”、“P-value”、“APAreg”。在“APAreg”中定义了3种类型,“UP”表示实验组aUTR读数丰度至少比对照组高5%,且“P-value”<0.05,“DN”表示实验组aUTR读数丰度至少比对照组低5%,且“P-value”<0.05,“NC”表示剩余的基因。“UP”表示3'UTR延长,“DN”表示3'UTR缩短(https://bioconductor.org/packages/release/bioc/vignettes/APAlyzer/inst/doc/APAlyzer.html)。使用R语言ggpubr软件包绘制发生APA事件的基因的火山图。使用deepTools将得到的bam文件转换bigWig格式文件[13],在IGV软件(2.11.1)里进行可视化。Matescape数据库[14]进行功能富集分析。
1.2.6 统计学分析
使用Excel、GraphPad 8.0、R 4.1.3软件进行统计分析。所有数据以均数±标准差(x±s)表示,两组间的差异显著性统计使用t检验统计学方法,P<0.05表示差异有统计学意义。
2 结 果
2.1 构建外源表达SARS-CoV-2膜蛋白细胞模型
利用瞬时转染技术分别将pcDNA3.1质粒和带3×flag标签的SARS-CoV-2 M蛋白表达质粒转入A549细胞内,转染后24 h收取细胞提取总蛋白质和总RNA,使用Western blot和RT-qPCR技术检测M蛋白(图1a,b)和M蛋白的mRNA(图1c)表达情况。结果显示,M蛋白及M蛋白的mRNA在A549细胞中表达,说明该模型成功,可进行后续实验。
2.2 筛选发生APA事件的基因
将上述收取的RNA进行RNA-Seq高通量测序,对原始数据进行处理,使用R软件包APAlyzer描绘宿主细胞APA事件[12]。将APA在实验组与对照组中的差异程度量化为RED的变化,RED>0且定义为“UP”的基因则为3'UTR延长,RED<0且定义为“DN”的基因则为3'UTR缩短。以P<0.05和|RED|>0为条件,筛选显著发生APA事件的基因。共筛选出813个发生APA事件的基因,其中3'UTR延长的基因有444个,3'UTR缩短的基因有369个。绘制发生APA事件的基因的火山图,图中红点表示“UP”即3'UTR延长的基因,蓝点表示“DN”即3'UTR缩短的基因(图2)。图中纵轴尺度调整为0~20,标注P值排序前五的基因。结果显示,M蛋白外源表达后影响宿主细胞pre-mRNA 3'UTR加工,且多数基因3'UTR延长(54.6%)。
2.3 差异APA基因的GO和KEGG分析
对差异APA基因进行功能富集分析,以P<0.01作为显著富集阈值,图中选取Top10的富集项进行展示,横坐标代表富集项的显著性,纵坐标为富集项的ID和名称,红色标注的条目代表本文感兴趣的条目或者已有研究报道M蛋白在其中发挥作用。结果显示,3'UTR延长的差异APA基因广泛参与有丝分裂细胞周期、调节细胞内应激、mRNA加工等生物过程(图3a),涉及病毒感染、内质网上蛋白质加工等信号通路(图3b)。3'UTR缩短的差异APA基因参与核糖核蛋白复合物的生物合成、mRNA代谢过程、细胞内蛋白质运输等生物过程(图3c),涉及内质网上蛋白质加工、细胞周期、凋亡等信号通路(图3d)。总体来说,SARS-CoV-2 M蛋白影响宿主细胞内与细胞增殖存活、应对病毒感染、基因表达调控以及蛋白质合成加工相关生物过程的基因的3'UTR加工。
以上富集项发现AKT1(AKT serine/threonine kinase 1)基因包含在多种生物学过程及信号通路,包括细胞周期的调控、细胞内定位的调控、病毒感染等(表2)。其所编码的蛋白质AKT1是丝氨酸/苏氨酸蛋白激酶(serine threonine protein kinase,AKT)家族中的一员,是磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/AKT信号通路中的核心因子,发挥抑制凋亡、促进细胞增殖、参与免疫和炎症反应的作用[15-16]。有研究发现,AKT1在SARS-CoV-2感染的动物模型及患者肺部样本呈现被激活状态,并且介导抑制宿主细胞的自噬[17]。
2.4 AKT1基因的3'UTR延长
本文使用IGV软件查看AKT1基因3'UTR的变化。根据polyA位点相对于编码区的位置,靠近编码区的polyA位点定义为近端polyA位点,简称近端,远离编码区的polyA位点定义为远端polyA位点,简称远端。图中d表示远端(distal),p表示近端(proximal),红色箭头指示M蛋白实验组AKT1基因的3'UTR上polyA位点由近端向远端移动(图4a)。如图4b所示,分别在AKT1基因的3'UTR区的近端和远端设计引物。利用RT-qPCR技术,以远端作为参照,计算得出近端相对远端的RNA表达水平(图4c)。如图中所示M蛋白实验组proximal/distal相比于对照组降低(P<0.01),说明AKT1 mRNA 3'UTR远端的RNA表达水平高于近端的RNA表达水平,表示在实验组中AKT1 mRNA的3'UTR延长。
2.5 AKT1蛋白表达水平及磷酸化情况
Western blot法检测AKT1的蛋白质表达、功能活化即磷酸化情况(磷酸化位点为Thr450)(图5a)。在过表达M蛋白实验组AKT1蛋白表达水平无明显变化,而AKT1磷酸化水平升高,说明AKT1被激活。以β-actin为内参,对Western blot结果进行半定量分析,计算M蛋白实验组p-AKT1与pcDNA3.1对照组p-AKT1相对蛋白质表达水平,AKT1磷酸化水平明显升高(P<0.01)(图5b)。
3 讨 论
SARS-CoV-2仍在全球肆虐横行,危害人类生命健康。感染SARS-CoV-2后将会引发宿主产生过度的炎症反应,导致患者肺部严重损伤,进而引起呼吸衰竭是患者死亡的重要原因[18]。因此深入探索其致病机制,以及制定更好地治疗策略刻不容缓。
已有研究报道SARS-CoV-2编码的蛋白质可通过与宿主RNA的相互作用,从转录、转录后、翻译和翻译后调控等多个层面调控宿主基因表达,如NSP16抑制 宿主RNA剪 接、NSP1抑制mRNA翻译,以及NSP8和NSP9阻断蛋白质的运输,破坏这些重要的细胞功能可以抑制宿主抗病毒因子的产生和功能[6]。作为转录后调控中一种重要的机制,APA通过对pre-mRNA进行加工,产生不同3'UTR长度的mRNA亚型,影响基因或蛋白质的表达和功能[7]。但目前尚未有研究探讨SARS-CoV-2编码蛋白对宿主pre-mRNA 3'UTR加工的影响。
本研究针对SARS-CoV-2编码蛋白中表达丰富且高度保守的M蛋白,分析M蛋白对宿主细胞pre-mRNA 3'UTR加工的影响。结果发现,M蛋白外源表达后影响宿主细胞pre-mRNA 3'UTR加工,且多数基因3'UTR延长。此结果与An等[11]的研究结果相悖,但是An等的研究结论是利用COVID-19患者外周血样本的RNA-Seq数据分析得出,由于样本以及病毒感染的完整性不同可能导致了结果的差异性。此外,本文研究发现参与多种病毒性生物过程及信号通路的关键调控因子AKT1的3'UTR加工受到影响,但是其蛋白质水平并未发生改变。根据目前已有文献报道,APA不仅仅影响基因的表达,大约一半的人类基因使用APA生成3'UTR长度不同的mRNA转录本,同时产生相同的蛋白质,但是蛋白质的功能和定位被改变[19]。因此,APA能够在不改变氨基酸序列的情况下,促进蛋白质功能的多样性。AKT1的3'UTR长度改变对其功能的影响仍需进一步探索。另外,本文发现在表达SARS-CoV-2 M蛋白的细胞内AKT1蛋白功能被激活。有研究报道,在SARS-CoV-2感染后,发现AKT1被激活,进而导致AKT/mTOR/HIF-1信号通路失调[20]、宿主细胞自噬受到抑制[17]、促炎趋化因子被激活上调[21]。PI3K/AKT/mTOR信号通路也被报道参与肺损伤、肺纤维化以及免疫细胞的发育等[22-24]。因此AKT1在SARS-CoV-2感染中具有重要意义,仍需进一步探索M蛋白影响AKT1 3'UTR加工的机制。
4 结 论
本研究发现SARS-CoV-2 M蛋白在肺上皮细胞系A549内外源表达后影响宿主细胞中与细胞增殖存活、应对病毒感染、基因表达调控以及蛋白质合成加工相关的基因pre-mRNA 3'UTR加工,验证了其中参与多种病毒性生物过程及信号通路的关键调控因子AKT1的3'UTR变化,及其蛋白质功能被激活。本研究为更加深入理解SARS-CoV-2的致病机制提供了研究基础。
致谢感谢重庆医科大学感染实验室林永教授惠赠本研究所需的重要实验材料。
