miR-103 通过NF-κB 通路上调MGMT 表达诱导胃癌细胞紫杉醇耐药
2022-10-25高晓丹王丽洁王书梦
高晓丹 王丽洁 王书梦 苏 洁
胃癌(gastric carcinoma)是常见的消化系统肿瘤。紫杉醇(paclitaxel,PTX)作为天然抗癌药物,在胃癌化疗中疗效确切[1]。但获得性耐药的出现往往导致PTX 治疗失败。微小RNA-103(miRNA-103,miR-103)是一种可参与肝癌、肺癌、胶质瘤等恶性生物学行为的miRNA[2-4]。研究显示,miR-103 参与恶性肿瘤化疗耐药[5]。但miR-103 与胃癌PTX 耐药的关系还不明确。核因子κB(nuclear factor kappa-B,NF-κB)通路已被发现在多种恶性肿瘤化疗耐药中发挥作用[6-7]。最新研究显示,miR-103 能够靶向TLR4 而抑制NFκB 磷酸化水平[8],提示miR-103 在NF-κB 信号通路中可能发挥抑制作用。O6-甲基鸟嘌呤-DNA-甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)是NF-κB 参与恶性肿瘤细胞耐药的重要下游信号分子[9]。但目前miR-103 是否通过NF-κB/MGMT 介导胃癌PTX 耐药还不清楚。本研究通过构建PTX 耐药胃癌细胞,观察miR-103 对胃癌PTX 耐药的影响,并探讨NF-κB/MGMT 在其中的作用,现报道如下。
1 实验材料
1.1 细 胞 人胃癌NCI-N87 细胞购自中国科学院典藏培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心。
1.2 主要试剂 PTX(批号20211212)购自南京本草益康生物科技有限公司;miR-103 抑制物(miR-103 inhibitor)转染试剂盒购自上海吉玛公司;四甲基偶氮唑盐比色[3-(4,5-Dimethylthia-zol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]和结晶紫染液购自上海碧云天公司;逆转录聚合酶链式反应试剂盒(含引物)(批号0000173942)和实时荧光定量PCR(RTqPCR)试剂盒(批号0000170712)购自美国Promega公司;miR-103 和U6 合成引物购自上海生工生物;RIPA 总蛋白提取试剂盒购自北京索莱宝公司;胎牛血清(FBS,批号2132094P)、DMEM 高糖培养基(批号8120033)、磷酸盐缓冲液(PBS,批号AE29449009)购自美国Gibco 公司;NF-κB p65(1∶1000)(批号06)、p-NF-κB p65(1∶1000)(批号12)、IκBα(1∶1000)(批号23)抗体及荧光二抗(1∶500)(批号02)抗体购自美国CST 公司;MGMT(1∶1000)(批号GR3301548-3)抗体购自美国Abcam 公司;GAPDH(1∶1000)(批号15)抗体购自南京Bio-World 公司;抗鼠和抗兔IgG、HRP-linked 二抗(批号G1421、G1526)购自美国Santa Cruz 公司。
2 实验方法
2.1 N87/PTX 构建和细胞培养 采用逐渐增加PTX浓度,间歇诱导的方法构建N87/PTX 细胞。N87 和N87/PTX 细胞以DMEM 全培养基(含10%FBS 和1%青-链霉素)进行培养。培养环境为37 ℃,含5%CO2的无菌环境。
2.2 转染miR-103 inhibitor 抑制内源性miR-103将N87/PTX 细胞接种于6 孔板,培养过夜。次日,将10 μL miR-103 抑制物(inhibitor)和阴性对照(NC)分别用 DMEM 高糖培养基稀释 50 倍。将Lipofectamine 2000 稀释300 倍。分别吸取miR-103 inhibitor 0.5 mL 和Lipofectamine 2000 稀释液1.5 mL 混合并静置20 min。将细胞培养基更换为上述混合液,置于培养箱培养24 h。将转染miR-103 inhibitor 和NC 的N87/PTX 细胞分别设为miR-103 inhibitor 组和NC 组,同时以未转染的N87/PTX 细胞作为空白对照组(Control)。
2.3 MTT 法检测细胞活力 N87 或N87/PTX 细胞以每孔9×103个接种于96 孔板,以PTX(0、0.01、0.1、1、10、100、1000 μmol/L)处理48 h,每个浓度设置5个重复孔。48 h 时每孔直接加入20 μL MTT 溶液(5 mg/mL)处理4 h,而后每孔加入二甲基亚砜100 μL,用酶标仪(490 nm)检测吸光度并计算细胞活力,根据细胞活力计算各细胞IC50。实验重复3 次。耐药指数=N87/PTX 细胞IC50 均值/N87 细胞IC50 均值。
2.4 RT-qPCR 检测miR-103 表达水平 取对数期所需细胞接种于96 孔板,当细胞生长至80%汇合度时以TRIZOL 法提取细胞总RNA。按说明书以逆转录聚合酶链式反应试剂盒进行逆转录反应得到cDNA。稀释cDNA 和引物。以U6 为内参,用RT-试剂盒在ABI 7500 型RT-qPCR 系统中进行检测。实验重复3 次,以2-△△Ct法计算miR-103 的表达水平。miR-103 上游引物:5′-AGCAGCATTGTACAGGGCTATCA-3′,下游引物:5′-GCCGTCGGTGATGCTTTTTTGG-3′。U6 上游引物,5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游引物:5′-CGCTTCACGAATTTGCGTGTCAT-3′。
2.5 结晶紫染色 取对数期细胞接种于6 孔板中,细胞生长至60%汇合度时按需求加入PTX(3 μmol/L)处理48 h。PBS 洗涤,加入4%多聚甲醛固定10min。PBS 洗涤,每孔加入2 mL 结晶紫染液染色10 min。清水洗涤,于倒置显微镜下观察拍照,随机记录3 个视野细胞数目,计算细胞贴壁存活率。
2.6 miR-103 的靶基因预测 以miRcode 网站(http://www.mircode.org/)分析miR-103 与IKBα 的编码基因NFKBIA 结合的可能性。同时在RNA22 v2 microRNA target detection 网站(https://cm.jefferson.edu/rna22/Interactive)预测二者结合的潜在位点。
2.7 蛋白印迹法检测p-NF-κB p65、MGMT 及IKBα 蛋白表达 提前配制含蛋白抑制剂和磷酸酶抑制剂的RIPA 细胞裂解液,置于冰上备用。将所需检测细胞以PBS 洗两遍,第二遍保留PBS,用蛋白刮刀刮下细胞并转移至1.5 mL EP 管中,4 ℃、800 g 离心5 min,弃去上清液并用吸水纸吸干水分,各加入100 μL 裂解液于冰上裂解15 min,4 ℃、8500 g 离心20 min,上清液即为提取总蛋白,总蛋白经BCA 蛋白定量试剂盒定量后制备成蛋白样品。以每孔道30 μg/10 μL 蛋白样品进行电泳,随后将蛋白转印至PVDF 膜上。PVDF 膜以5%脱脂奶粉封闭过夜。次日加入NF-κB p65、p-NF-κB p65、IKBα、MGMT 及GAPDH 抗体避光孵育4 h。TBST 洗膜后,加入抗鼠和抗兔IgG,HRP-linked 二抗室温避光孵育1 h,PVDF 膜以TBST 清洗后用ECL 化学发光试剂盒进行显色,凝胶成像仪进行曝光。
2.8 免疫荧光法检测NF-κB p65 细胞分布 将细胞铺在盖玻片上,24 h 后于冰上用预冷的甲醇固定20 min。然后用0.1% Triton X-100 对细胞进行通透处理,室温条件下用3% BSA 封闭30 min。将细胞与NF-κB p65 抗体(1∶500)室温孵育2 h。PBST 洗涤后,细胞与荧光二抗(1∶1000)孵育2 h。在室温下用0.5 μg/mL 的DAPI 孵育10 min。于倒置荧光显微镜下观察拍照。
2.9 统计学方法 应用Graphpad prism 7.0 统计软件对实验结果进行分析处理。数据用Shapiro-Wilk进行正态性检验,均为正态分布,以均数±标准差()表示,组内两样本均数比较用t 检验,多样本均数比较采用单因素方差分析,两两多重比较采用LSD-t 检验,P<0.05 为差异有统计学意义。
3 实验结果
3.1 miR-103 在N87/PTX 表达上调 MTT 结果显示,PTX 对N87 和N87/PTX细胞的IC50分别为(1.5±0.2)和(40.6±4.5)μmol/L,经计算N87/PTX 耐药指数为27.1。RT-qPCR结果显示,N87细胞和N87/PTX 细胞miR-103 表达水平分别为(0.9±0.1)和(10.7±0.9),与N87 细胞比较,N87/PTX 细胞miR-103 表达水平显著升高(P<0.01)。
3.2 抑制miR-103 影响PTX 对N87/PTX 细胞的细胞毒作用 MTT 结果显示,PTX 对Control、NC 及miR-103 inhibitor 组N87/PTX 细胞的IC50 分别为(43.5±4.8)、(41.7±4.5)及(3.3±0.3)μmol/L。与NC 组比较,miR-103 inhibitor 组IC50 显著降低(P<0.01)。
3.3 抑制miR-103 影响N87/PTX 细胞对PTX 的敏感性 结晶紫染色结果显示,PTX(3 μmol/L)对Control 组N87/PTX 细胞存活能力有一定影响。Control+PTX 和NC+PTX 组细胞存活率无明显差异。与NC+PTX 组比较,miR-103 inhibitor+PTX 组N87/PTX 细胞存活率显著降低(P<0.01),见图1 和表1。
表1 PTX 处理后各组N87/PTX 细胞存活率比较(%,)

表1 PTX 处理后各组N87/PTX 细胞存活率比较(%,)
注:Control 为空白对照;NC 为阴性对照;miR-103 inhibitor 为miR-103 抑制物;PTX 为紫杉醇;Solvent 为溶媒;与Control+Solvent 比较,aP<0.01;与NC+PTX 比较,bP<0.01
3.4 NFKBIA 基因(IKBα 蛋白的编码基因)可能是miR-103 的靶基因 RNA22 v2 和miRcode 软件分析结果显示,IKBα 的编码基因NFKBIA 与miR-103存在互补结合位点,可能是后者的靶基因,二者结合位点序列见表2。
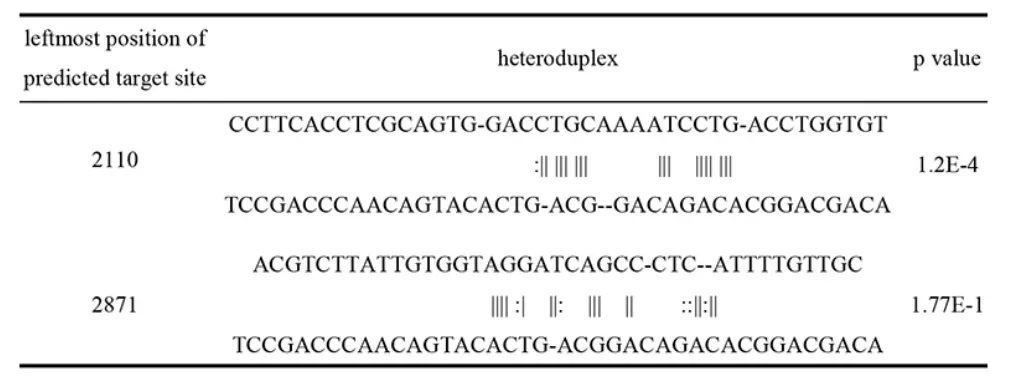
表2 miR-103 与NFKBIA 基因的结合序列
3.5 p-NF-κB p65、IKBα 及MGMT 蛋白在N87/PTX 细胞的表达 蛋白印记结果显示,相较于N87细胞,N87/PTX 细胞IKBα 蛋白表达明显下调,p-NF-κB p65 和MGMT 蛋白表达显著上调(P<0.01),见图2 和表3。
表3 N87/PTX 细胞p-NF-κB p65、IKBα 及MGMT相对蛋白表达量比较(%,)

表3 N87/PTX 细胞p-NF-κB p65、IKBα 及MGMT相对蛋白表达量比较(%,)
注:N87 为正常培养的N87 细胞;N87/PTX 为PTX 耐药N87 细胞;N87 为正常培养的N87 细胞;N87/PTX 为PTX 耐药N87 细胞;IKBα为核因子κB 抑制蛋白α;MGMT 为O6-甲基鸟嘌呤-DNA-甲基转移酶;与N87 比较,aP<0.01
3.6 miR-103 对p-NF-κB p65、IKBα 和MGMT 蛋白表达的影响 蛋白印记结果显示,NC 和Control组N87/PTX 细胞p-NF-κB p65、IKBα 及MGMT 蛋白表达无明显差异。与NC 组比较,miR-103 inhibitor 组N87/PTX 细胞p-NF-κBp65 和MGMT 蛋白表达显著下调,IKBα 蛋白表达明显上调(P<0.01),见图3 和表4。
表4 各组细胞p-NF-κB p65、IKBα 及MGMT相对蛋白表达量比较(%,)

表4 各组细胞p-NF-κB p65、IKBα 及MGMT相对蛋白表达量比较(%,)
注:Control 为空白对照;NC 为阴性对照;miR-103 inhibitor 为miR-103 抑制物;p-NF-κB p65 为磷酸化型NF-κB p65;IKBα 为核因子κB 抑制蛋白α;MGMT 为O6-甲基鸟嘌呤-DNA-甲基转移酶;与NC组比较,aP<0.01
3.7 miR-103 对NF-κB p65 核质分布的影响 免疫荧光结果显示,Control 和NC 组N87/PTX 细胞NF-κB p65 分布于细胞核和细胞质中。相较于NC组,miR-103 inhibitor 组N87/PTX 细胞NF-κB p65主要表达于细胞质,而在细胞核内表达明显减少,见图4。
4 讨论
miR-103 作为miRNA 家族成员,已显示与恶性肿瘤化疗耐药有关。一项关于肺癌的研究发现,miR-103 可靶向PTEN 激活PI3K/AKT 信号通路,从而促进肺癌细胞A549 对达沙替尼耐药[5]。研究显示,miR-103 能通过调节COP1 诱导人白血病细胞对阿霉素耐药[10]。本研究成功构建PTX 耐药胃癌细胞N87/PTX,并发现miR-103 在N87/PTX 细胞中表达升高。进一步研究发现,miR-103 inhibitor 处理即可降低PTX 对N87/PTX 细胞的IC50,还可抑制N87/PTX 细胞的贴壁存活能力。提示miR-103 可能与N87/PTX细胞PTX 耐药相关。通过生物学信息学分析发现,IKBα 蛋白的编码基因NFKBIA 与miR-103 存在互补结合位点,NFKBIA 可能是miR-103 的靶基因。提示miR-103 对胃癌细胞PTX 耐药的影响可能与IKBα 相关。在经典的NF-κB 通路中,IKB 能结合NF-κB 而抑制后者活性,而其自身降解可活化NFκB。在过去的研究中,NF-κB 已被证明在卵巢癌[7]、乳腺癌[12]及黑色素瘤[13]等恶性肿瘤化疗药物耐药中发挥作用。在本研究中,N87/PTX 细胞IKBα 蛋白表达下调,p-NF-κB p65 蛋白表达上调。提示miR-103可能通过靶向抑制IKBα 蛋白表达,从而磷酸化激活NF-κB p65 蛋白。
为了进一步进行验证,本研究采用miR-103 抑制物miR-103 inhibitor 抑制N87/PTX 细胞内源性miR-103 活性表达。结果发现,miR-103 inhibitor 可诱导N87/PTX 细胞IKBα 蛋白表达上调,p-NF-κB p65 蛋白表达下调。免疫荧光实验发现,miR-103 inhibitor 处理后N87/PTX 细胞核NF-κB p65 表达明显减少。通常情况下,NF-κB 磷酸化激活后通过转位至细胞核内与其相关的DNA 基序结合,从而诱导靶基因的转录[7-8,13]。这些提示,在本研究中,miR-103 可能通过靶向抑制IKBα 蛋白表达,从而磷酸化激活NF-κB p65 蛋白,后者进入细胞核参与转录调控。
MGMT 是NF-κB 参与恶性肿瘤细胞耐药的重要下游信号分子,能与DNA 鸟嘌呤6 位氧上的烷基化合物结合,将烷基转移到MGMT 的第145 号半胱胺酸活性位点上,使DNA 上烷基化的鸟嘌呤被还原,最终避免子链DNA 缺口出现,导致细胞耐药[9,14]。本研究中N87/PTX 细胞MGMT 蛋白表达上调,提示N87/PTX 细胞耐PTX 效应可能与NF-κB 通路介导MGMT 蛋白表达上调有关。进一步实验发现,miR-103 inhibitor 还可诱导N87/PTX 细胞MGMT 蛋白表达下调,提示miR-103 可能通过NF-κB 通路介导MGMT 蛋白表达上调。
综上所述,miR-103 可能通过靶向抑制IKBα 蛋白表达而促进NF-κB p65 磷酸化进入细胞核,而后者通过调节MGMT 的转录表达,最终介导胃癌细胞PTX 耐药。
