微小RNA-199a-5p调控Klotho表达对体外脑缺血再灌注大鼠氧-葡萄糖剥夺/再灌注诱导的肾上腺嗜铬瘤细胞损伤的保护作用
2022-10-25王小亚杜旭辉何晓刚
王小亚,杜旭辉,何晓刚
作者单位:1平顶山市第二人民医院神经内科,河南 平顶山 467000;2许昌市中心医院神经内科,河南 许昌 461000
脑缺血被认为是全世界脑血管疾病高发病率和高死亡率的主要原因[1]。尽管再灌注是有效治疗脑缺血的可行疗法,但它也可能在称为脑缺血/再灌注(ischemia/reperfusion,I/R)损伤的过程中加剧脑损伤和功能损伤[2]。近年来,大量的研究表明,涉及多种信号途径和生物学过程的多种机制参与脑I/R损伤;然而,其机制复杂,目前对这方面的认识还不尽如人意。许多研究证实,氧化应激和炎症反应是脑I/R后神经元丢失的主要病理原因[3-4]。因此,关注与氧化应激相关的分子机制和脑I/R损伤背后的炎症反应可能会促进更有效的治疗药物的开发。
微小RNA(microRNA,miRNA)是一类非编码小RNA,可以广泛调节脑缺血的生物过程,包括氧化应激和炎症反应。有人提出,miRNA可能是脑缺血的潜在诊断标志物和有前途的治疗剂[5]。据报道,miR-199a-5p在缺血性中风大鼠模型中高表达,沉默miR-199a-5p后,大鼠的认知功能明显改善,脑梗死面积明显减少,神经细胞凋亡受到抑制,证实了沉默miR-199a-5p对缺血性中风大鼠认知功能和神经元的保护作用[6]。已知,miRNA通过调节下游靶基因发挥作用,通过生物信息学预测发现miR-199a-5p与Klotho之间存在结合位点。Klotho是一种具有多效性的抗衰老基因。据之前研究报道,Klotho可能作为一种内源性神经保护因子对抗缺血损伤,敲低Klotho加剧了小鼠神经功能障碍和脑损伤,证实了Klotho本身或Klotho的增强剂可能是预防和治疗老年急性缺血性脑损伤的一种有前途的方法[7]。然而,miR-199a-5p在脑I/R损伤中的潜在保护机制以及Klotho在其中发挥的作用仍有待阐明。
本研究自2021年5―11月通过构建神经元PC12细胞的氧-葡萄糖剥夺/再灌注(oxygen-glucose deprivation/reperfusion,OGD/R)损伤模型模拟体内脑I/R损伤条件,旨在研究抑制miR-199a-5p对OGD/R损伤PC12细胞氧化应激和炎症反应的保护作用,以及Klotho在此过程中的作用。
1 材料与方法
1.1 材料大鼠肾上腺嗜铬瘤细胞PC12(未分化)(货号YS3032C)获自美国ATCC。马血清(货号26050088)、胎牛血清(货号10100147)、青霉素-链霉素(货号15070063)获自美国Gibco;DMEM培养基(货号D6046)获自德国MERCK,miR-199a-5p模拟物/抑制剂(miR-199a-5p mimics/inhibitor)及其阴性对照(miR-NC mimics/inhibitor)、Klotho敲低载体质粒(shRNA-Klotho)及其对照载体质粒(shRNApLKO.1)、3'-UTR Klotho野生型载体质粒(Klotho-WT)及3'-UTR Klotho突 变型载体 质粒(Klotho-MUT)均由上海GenenPharma提供;TRIzol试剂(货号15596026)、大鼠肿瘤坏死因子-α(TNF-α)(货号BMS622)、白细胞介素-1β(IL-1β)(货号ERIL1B)、单核细胞趋化蛋白-1(MCP-1)(货号BMS631INST)和白细胞介素-6(IL-6)(货号BMS625)ELISA试剂盒获自美国Invitrogen;HiScript®Ⅱ1st Strand cDNA Synthesis Kit(货号R211-01)获自南京VAZYME;Arraystar SYBR®Green Real-time qPCR Master Mix(货号AS-MR-005-5)获自上海Arraystar;RIPA裂解缓冲液(货号89900)获自美国Thermo Scientific;一抗Klotho(货号YB-2925R,113 kDa)、甘油醛-3-磷酸脱氢酶(GAPDH)(货号YB-01000,37 kDa)获自上海钰博生物科技;胆囊收缩素/缩胆囊素八肽(CCK-8)细胞增殖试剂盒获自美国BestBio;Annexin V-FITC/PI双染细胞凋亡检测试剂盒(货号FY600003-20T)获自上海Fuyuanbio;活性氧(ROS)检测试剂盒(货号:S0033M)获自上海Beyotime;大鼠丙二醛(MDA)含量[货号JK-(a)-2197]、谷胱甘肽过氧化物酶(GSH-Px)活性[货号JK-(a)-2396]、超氧化物歧化酶(SOD)活性[货号JK-(a)-2293]测定试剂盒获自上海晶抗。双荧光素酶报告基因检测试剂盒(货号11402ES60)获自上海Yeasen。
1.2 方法
1.2.1 细胞培养PC12细胞系维持在DMEM培养基中,补充有10%马血清、5%胎牛血清、青霉素(100 mg/L)-链霉素(100 mg/L),在含有95%空气和5%二氧化碳的37℃加湿培养箱中培养。所有处理均在汇合超过80%的细胞进行。
1.2.2 细胞处理与转染将PC12细胞分为Control组、OGD/R组、miR-NC inhibitor组、miR-199a-5p inhibitor组、miR-199a-5p inhibitor+shRNA-pLKO.1组和miR-199a-5p inhibitor+shRNA-Klotho组。Control组细胞不做任何处理;OGD/R组进行OGD/R处理;其余四组细胞按照Lipofectamine 2000试剂盒方法对 应 转 染miR-NC inhibitor、miR-199a-5p inhibitor、shRNA-pLKO.1或shRNA-Klotho,转染48 h后进 行OGD/R处理,通过RT-qPCR或Western blotting确定转染效率。
PC12细 胞OGD/R处 理[8]如 下:PC12细 胞 的DMEM培养基更换为DMEM无糖培养基并转移到缺氧室(95%N2和5%二氧化碳)中3 h,消耗细胞内外葡萄糖和氧气。在OGD阶段结束时,将培养基更换为含有4.5 g/L葡萄糖的培养基,并在正常培养环境中培养24 h以复氧,各组设置6个复孔,检测各项指标。
1.2.3 RT-qPCR检测PC12细胞 中miR-199a-5p和Klotho mRNA表达水平PC12细胞中总RNA通过TRIzol试剂获取,使用cDNA合成试剂盒将全部的总RNA逆转录为cDNA。随后通过SYBR® Green Real-time qPCR Master Mix进行RT-qPCR。U6作为内参对照基因,2-ΔΔCt法计算目的基因表达。
引物由北京擎科生物科技有限公司参与合成,引物序列如下:miR-199a-5p:5'-GCCAAGCCCAGTGTTCAGAC-3'(正向)和5'-GTGCAGGGTCCGAGGTATTC-3'(反向);Klotho:5'-TGAGGACGACCAGCTGAGGGT-3'(正向)和5'-CATGGATGCCTTGGGCTCAAA-3'(反向);GAPDH:5'-AAAAGCATCACCCGGAGGAGAA-3'(正 向)和5'-AAGGAAATGAATGGGCAGCCG-3'(反 向);U6:5'-TGCGGGTGCTCGCTTCGGCAGC-3'(正向)和5'-CCAGTGCAGGGTCCGAGGT-3'(反向)。
1.2.4 Western blotting分析PC12细胞中Klotho蛋白水平通过RIPA裂解缓冲液从各组PC12细胞中获得总蛋白质。通过在10% SDS-PAGE(30微克/泳道)分离蛋白质,并迁移到PVDF膜上,于室温下在5%脱脂牛奶封闭2 h。将膜与一抗Klotho和GAPDH在4℃下过夜孵育。一抗孵育后,将膜与二抗在室温下孵育1 h,使用ECL蛋白印迹底物试剂盒显影。Image J软件用于进行灰度值分析。
1.2.5 CCK-8测定PC12细胞活力将上述各组转染处理的PC12细胞按每孔1×106个接种在96孔板中,培养24 h后,每孔中添加10 μL的CCK-8溶液在37℃下孵育3 h,然后在酶标仪上测量发射波长为450 nm的光密度(optical density,OD)值。
1.2.6 流式细胞仪测定PC12细胞凋亡率收集按照上述转染处理的各组PC12细胞,重悬于缓冲液中,依次添加50 μL Annexin V-FITC和10 μL PI在37℃下染色15 min。使用流式细胞仪评估凋亡细胞,并使用Cell Quest 5.1软件分析数据。
1.2.7 PC12细胞中ROS生成测定将上述各组转染处理的PC12细胞按每孔1×106个接种在6孔板中,添加DCFH-DA(10 μmol/L)在37℃下培养20 min。然后收集细胞并使用流式细胞仪量化每组的荧光强度(fluorescence intensity,FI),通过FlowJo软件分析数据。
1.2.8 PC12细胞中氧化应激指标的测定将按照上述方法转染处理的各组PC12细胞经裂解后离心以收集上清液。根据试剂盒的方案,使用相应试剂盒评估上清液中MDA含量以及SOD和GSH-Px活性。
1.2.9 ELISA检测PC12细胞中炎症因子水平将按照上述方法转染处理的各组PC12细胞经裂解后离心以收集上清液。根据试剂盒的方案,使用相应的ELISA试剂盒检测PC12细胞上清液中TNF-α、IL-1β、MCP-1和IL-6水平。
1.2.10 双荧光素酶验证PC12细胞中miR-199a-5p与Klotho靶 向 关 系Targetscan(http://www.targetscan.org/vert_71/,Release 7.2)网站预测显示miR-199a-5p与Klotho之间存在潜在结合位点。将Klotho-WT和Klotho-MUT克隆到pmirGLO报告质粒载体中,与miR-199a-5p mimics或miR-NC mimics一起通过Lipofectamine 2000转染试剂共转染到PC12细胞中。使用双荧光素酶报告基因检测系统检测相对荧光素酶活性。荧光素酶活性标准化为海肾荧光素酶活性。
1.3 统计学方法使用SPSS 22.0分析数据,符合正态分布的计量资料采用以±s表示,两组间差异比较采用独立样本t检验,多组间差异比较采用单因素方差分析,组间多重比较采用SNK-q法,P<0.05表示差异有统计学意义。
2 结果
2.1 各组PC12细胞转染效率验证RT-qPCR和Western blotting结果显示,与Control组相比,OGD/R组PC12细胞中miR-199a-5p表达水平增高,Klotho mRNA和蛋白水平降低(P<0.05);与miR-NC inhibitor组 相 比,miR-199a-5p inhibitor组PC12细 胞 中miR-199a-5p表达水平降低,Klotho mRNA和蛋白水平增高(P<0.05);与miR-199a-5p inhibitor+shRNApLKO.1组 相 比,miR-199a-5p inhibitor+shRNAKlotho组PC12细胞中miR-199a-5p表达水平增高,Klotho mRNA和蛋白水平降低(P<0.05);miR-NC inhibitor组 与OGD/R组、miR-199a-5p inhibitor+shRNA-pLKO.1组 与miR-199a-5p inhibitor组PC12细 胞中miR-199a-5p和Klotho表达水平差异无统计学意义(P>0.05)。见图1,表1。
表1 各组PC12细胞中miR-199a-5p和Klotho表达水平/±s
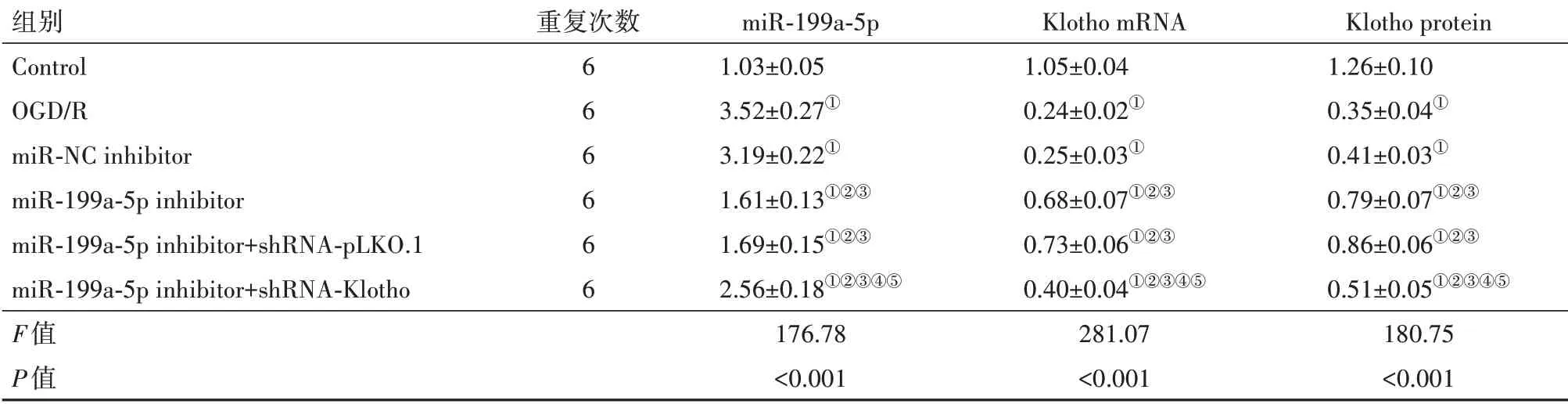
表1 各组PC12细胞中miR-199a-5p和Klotho表达水平/±s
注:①与Control组比较,P<0.05。②与OGD/R组比较,P<0.05。③与miR-NC inhibitor组比较,P<0.05。④与miR-199a-5p inhibitor组比较,P<0.05。⑤与miR-199a-5p inhibitor+shRNA-pLKO.1组比较,P<0.05。
组别Control OGD/R miR-NC inhibitor miR-199a-5p inhibitor miR-199a-5p inhibitor+shRNA-pLKO.1 miR-199a-5p inhibitor+shRNA-Klotho F值P值重复次数6 6 6 6 6 6 miR-199a-5p 1.03±0.05 3.52±0.27①3.19±0.22①1.61±0.13①②③1.69±0.15①②③2.56±0.18①②③④⑤176.78<0.001 Klotho mRNA 1.05±0.04 0.24±0.02①0.25±0.03①0.68±0.07①②③0.73±0.06①②③0.40±0.04①②③④⑤281.07<0.001 Klotho protein 1.26±0.10 0.35±0.04①0.41±0.03①0.79±0.07①②③0.86±0.06①②③0.51±0.05①②③④⑤180.75<0.001
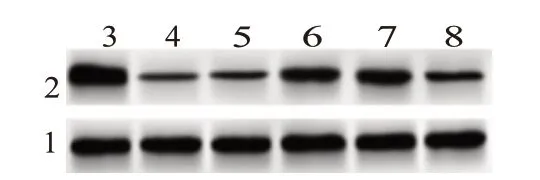
图1 蛋白质印迹法检测各组PC12细胞中Klotho蛋白水平
2.2 各组PC12细胞活力及凋亡情况CCK-8和流式细胞术结果显示,与Control组相比,OGD/R组PC12细胞活力降低,细胞凋亡率增高(P<0.05);与miR-NC inhibitor组 相 比,miR-199a-5p inhibitor组PC12细胞活力增高,细胞凋亡率降低(P<0.05);与miR-199a-5p inhibitor+shRNA-pLKO.1组相比,miR-199a-5p inhibitor+shRNA-Klotho组PC12细胞活力降低,细胞凋亡率增高(P<0.05);miR-NC inhibitor组与OGD/R组、miR-199a-5p inhibitor+shRNA-pLKO.1组与miR-199a-5p inhibitor组PC12细胞活力和细胞凋亡率差异无统计学意义P>0.05)。见表2。
表2 各组PC12细胞活力与凋亡情况/±s
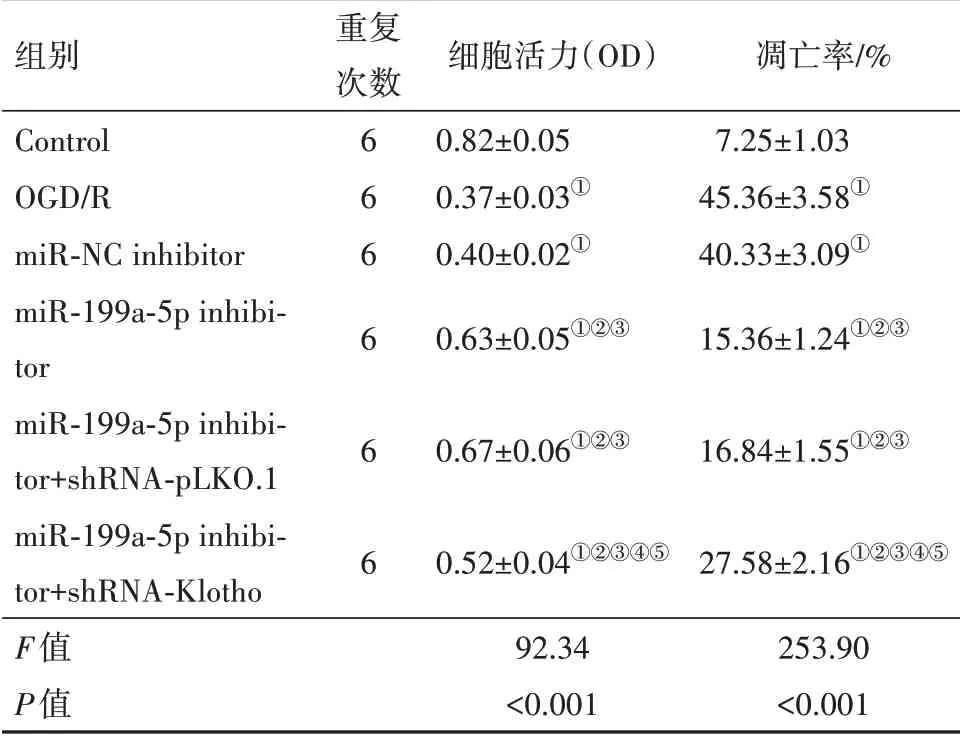
表2 各组PC12细胞活力与凋亡情况/±s
注:①与Control组比较,P<0.05。②与OGD/R组比较,P<0.05。③与miR-NC inhibitor组比较,P<0.05。④与miR-199a-5p inhibitor组比较,P<0.05。⑤与miR-199a-5p inhibitor+shRNA-pLKO.1组比较,P<0.05。
组别Control OGD/R miR-NC inhibitor miR-199a-5p inhibitor miR-199a-5p inhibitor+shRNA-pLKO.1 miR-199a-5p inhibitor+shRNA-Klotho F值P值重复次数6 6 6 6 6 6细胞活力(OD)0.82±0.05 0.37±0.03①0.40±0.02①0.63±0.05①②③0.67±0.06①②③0.52±0.04①②③④⑤92.34<0.001凋亡率/%7.25±1.03 45.36±3.58①40.33±3.09①15.36±1.24①②③16.84±1.55①②③27.58±2.16①②③④⑤253.90<0.001
2.3 各组PC12细胞氧化应激情况结果显示,与Control组相比,OGD/R组PC12细胞中ROS释放量和MDA含量增多,SOD和GSH-Px活性降低(P<0.05);与miR-NC inhibitor组相比,miR-199a-5p inhibitor组PC12细胞中ROS释放量和MDA含 量 降低,SOD和GSH-Px活性升高(P<0.05);与miR-199a-5p inhibitor+shRNA-pLKO.1组相比,miR-199a-5p inhibitor+shRNA-Klotho组PC12细胞中ROS释放量 和MDA含量增多,SOD和GSH-Px活性降低(P<0.05);miR-NC inhibitor组与OGD/R组、miR-199a-5p inhibitor+shRNA-pLKO.1组 与miR-199a-5p inhibitor组PC12细 胞 中ROS释 放 量、MDA含 量 以 及SOD和GSH-Px活性变化差异无统计学意义(P>0.05)。见表3。
表3 各组PC12细胞中活性氧(ROS)释放量与丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)水平/±s
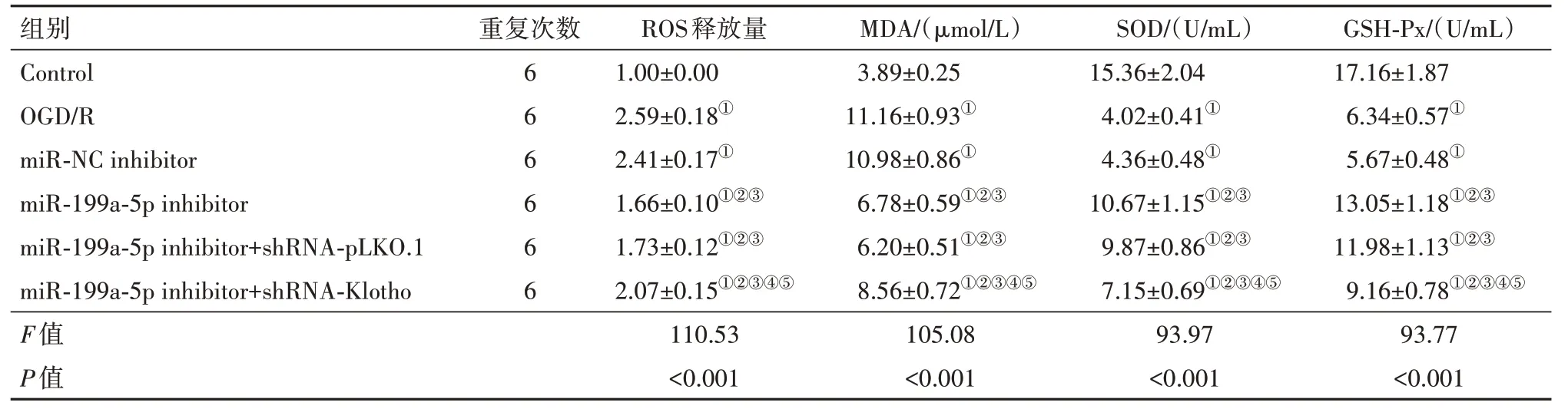
表3 各组PC12细胞中活性氧(ROS)释放量与丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)水平/±s
注:①与Control组比较,P<0.05。②与OGD/R组比较,P<0.05。③与miR-NC inhibitor组比较,P<0.05。④与miR-199a-5p inhibitor组比较,P<0.05。⑤与miR-199a-5p inhibitor+shRNA-pLKO.1组比较,P<0.05。
组别Control OGD/R miR-NC inhibitor miR-199a-5p inhibitor miR-199a-5p inhibitor+shRNA-pLKO.1 miR-199a-5p inhibitor+shRNA-Klotho重复次数6 6 6 6 6 6 ROS释放量1.00±0.00 2.59±0.18①2.41±0.17①1.66±0.10①②③1.73±0.12①②③2.07±0.15①②③④⑤MDA/(μmol/L)3.89±0.25 11.16±0.93①10.98±0.86①6.78±0.59①②③6.20±0.51①②③8.56±0.72①②③④⑤SOD/(U/mL)15.36±2.04 4.02±0.41①4.36±0.48①10.67±1.15①②③9.87±0.86①②③7.15±0.69①②③④⑤GSH-Px/(U/mL)17.16±1.87 6.34±0.57①5.67±0.48①13.05±1.18①②③11.98±1.13①②③9.16±0.78①②③④⑤F值P值110.53<0.001 105.08<0.001 93.97<0.001 93.77<0.001
2.4 各组PC12细胞炎症反应情况结果显示,与Control组相比,OGD/R组PC12细胞中TNF-α、IL-1β、MCP-1和IL-6水平升高(P<0.05);与miR-NC inhibitor组相比,miR-199a-5p inhibitor组PC12细胞中TNF-α、IL-1β、MCP-1和IL-6水平降低(P<0.05);与miR-199a-5p inhibitor+shRNA-pLKO.1组相比,miR-199a-5p inhibitor+shRNA-Klotho组PC12细 胞 中TNF-α、IL-1β、MCP-1和IL-6水平升高(P<0.05);miR-NC inhibitor组与OGD/R组、miR-199a-5p inhibitor+shRNA-pLKO.1组 与miR-199a-5p inhibitor组PC12细胞中TNF-α、IL-1β、MCP-1和IL-6水平差异无统计学意义(P>0.05)。见表4。
表4 各组PC12细胞中肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、单核细胞趋化蛋白-1(MCP-1)和白细胞介素-6(IL-6)水平/±s
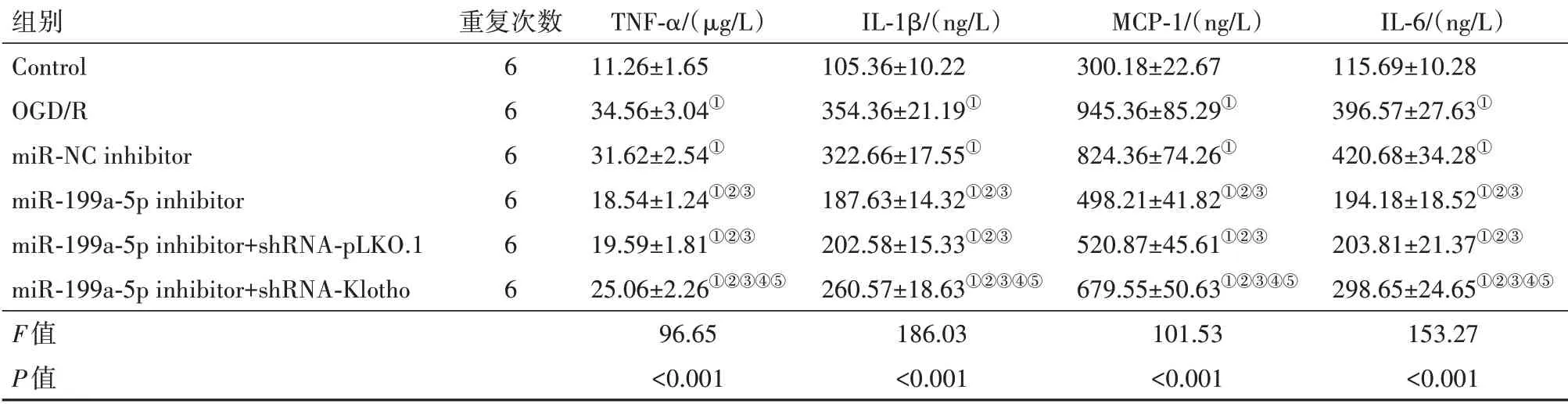
表4 各组PC12细胞中肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、单核细胞趋化蛋白-1(MCP-1)和白细胞介素-6(IL-6)水平/±s
注:①与Control组比较,P<0.05。②与OGD/R组比较,P<0.05。③与miR-NC inhibitor组比较,P<0.05。④与miR-199a-5p inhibitor组比较,P<0.05。⑤与miR-199a-5p inhibitor+shRNA-pLKO.1组比较,P<0.05。
组别Control OGD/R miR-NC inhibitor miR-199a-5p inhibitor miR-199a-5p inhibitor+shRNA-pLKO.1 miR-199a-5p inhibitor+shRNA-Klotho F值P值重复次数6 6 6 6 6 6 TNF-α/(μg/L)11.26±1.65 34.56±3.04①31.62±2.54①18.54±1.24①②③19.59±1.81①②③25.06±2.26①②③④⑤96.65<0.001 IL-1β/(ng/L)105.36±10.22 354.36±21.19①322.66±17.55①187.63±14.32①②③202.58±15.33①②③260.57±18.63①②③④⑤186.03<0.001 MCP-1/(ng/L)300.18±22.67 945.36±85.29①824.36±74.26①498.21±41.82①②③520.87±45.61①②③679.55±50.63①②③④⑤101.53<0.001 IL-6/(ng/L)115.69±10.28 396.57±27.63①420.68±34.28①194.18±18.52①②③203.81±21.37①②③298.65±24.65①②③④⑤153.27<0.001
2.5 miR-199a-5p与Klotho靶向验证Targetscan预测发现,Klotho(简称KL)的3'-UTR区(1062-1069)存在与miR-199a-5p互补的结合位点。因此采用双荧光素酶报告基因实验进一步验证,结果显示,与miR-NC mimics组相比,miR-199a-5p mimics组转染Klotho-WT的PC12细胞中相对荧光素酶活性显著降低(P<0.05),而转染Klotho-MUT的PC12细胞中相对荧光素酶活性变化差异无统计学意义(P>0.05)。见表5。
表5 双荧光素酶检测Klotho与miR-199a-5p的靶向关系/±s
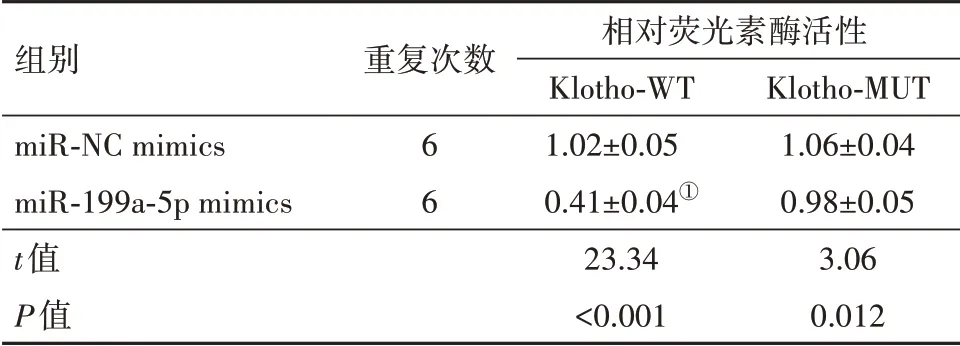
表5 双荧光素酶检测Klotho与miR-199a-5p的靶向关系/±s
注:①与miR-NC mimics组比较,P<0.05。
组别miR-NC mimics miR-199a-5p mimics t值P值重复次数6 6相对荧光素酶活性Klotho-WT 1.02±0.05 0.41±0.04①23.34<0.001 Klotho-MUT 1.06±0.04 0.98±0.05 3.06 0.012
3 讨论
脑I/R损伤通常由手术麻醉、心脏骤停或中风引起,是世界范围内导致死亡和残疾的主要原因[9]。脑血流不足会导致脑损伤,血液再灌注会进一步加重脑损伤。I/R损伤导致兴奋性神经递质释放、ROS生成过多、神经炎症和神经元凋亡,这些过程是脑损伤的病理生理机制[10-11]。但目前尚无有效的I/R损伤治疗策略。因此,寻找新的有效参与脑I/R损伤的分子靶点,有助于临床制定有效的治疗策略。
越来越多的证据表明,miRNA在神经系统疾病的发病机制中起着重要作用,包括脑I/R损伤。体内外研究表明,通过靶向miRNA抑制氧化应激和炎症反应,对脑I/R损伤有良好的治疗作用[12]。因此,基于miRNA的治疗可能成为一种潜在且有前景的脑I/R损伤治疗策略。近年来,miR-199a-5p因其在多种疾病中的作用而受到广泛研究。已有报道称,miR-199a-5p通过抑制癌细胞生长和诱导凋亡而抑制肿瘤生长[13],miR-199a-5p还促进化疗诱导不同类型的癌细胞凋亡[14]。另外,抑制miR-199a-5p提高了间充质干细胞的存活率[15]。这些发现表明miR-199a-5p是一个促进细胞凋亡的因子,因此,miR-199a-5p可能参与细胞凋亡相关的病理过程。令人关注的是,miR-199a-5p在心肌I/R中也起着重要的调节作用,抑制miR-199a-5p可促进心肌细胞对缺氧诱导的凋亡的耐受性[16]。另外,据报道,阿托伐他汀通过抑制miR-199a-5p保护心肌免受I/R损伤诱导的细胞凋亡[17]。这些结果表明,miR-199a-5p的下调对不良刺激的细胞具有保护作用。本研究结果表明,miR-199a-5p下调对神经元细胞PC12的OGD/R损伤有保护作用。有趣的是,有研究证实miR-199a-5p在神经系统疾病中起着关键作用。Wang等[18]报道,miR-199a-5p的下调减轻了毛果芸香碱诱导的癫痫持续状态,并通过抑制细胞凋亡来保护神经元免受损伤。此外,Li等[19]研究证实,抑制miR-199a-5p对OGD/R诱导的神经元凋亡和ROS的产生具有保护作用。本研究结果证实,miR-199a-5p下调可通过提高OGD/R诱导的PC12细胞活力,降低细胞凋亡,对神经元发挥保护作用。
氧化应激主要是由过量的ROS引起的,ROS广泛参与包含细胞凋亡、神经损伤和炎症等在内的多个病理过程,是脑I/R后神经元损伤的核心机制。而防御性抗氧化剂,如SOD和GSH-Px,可以改善氧化剂的升高,从而保护脑组织免受ROS细胞毒性[20]。miR-199a-5p已被证明可减少I/R损伤中的氧化应激反应和细胞凋亡[19]。同样,本研究表明,miR-199a-5p抑制物改善了OGD/R诱导的PC12细胞中ROS生成和MDA含量(氧化应激引起的脂质过氧化的主要标志物)增加,并提高了SOD和GSH-Px活性。因此,这些结果表明,抑制miR-199a-5p可有效防止由ROS诱导的氧化损伤和脂质过氧化作用引起的I/R损伤。此外,研究表明,在I/R期间,促炎介质(TNF-α、IL-1β、MCP-1和IL-6)水平显著增高[21]。本研究 发 现,miR-199a-5p抑制物降低 了OGD/R诱导的PC12细胞中TNF-α、IL-1β、MCP-1和IL-6水平。这些结果表明,miR-199a-5p抑制物可降低改善OGD/R诱导的PC12细胞炎症反应。另外,令人感兴趣的是,本研究证实,miR-199a-5p可靶向负调控Klotho的表达。多项研究表明,Klotho被鉴定为衰老抑制因子,其可影响许多对心血管疾病的发病机制及其预防至关重要的代谢途径;同时,还具有抑制脂质过氧化和炎症,并防止内皮损伤和血管钙化的作用[22]。据报道,Klotho过表达可改善心肌梗死后氧化应激对心肌组织的损伤[23]。此外,Jin等[24]研究证实,脑卒中病人脑脊液中Klotho表达下调,上调Klotho表达可减轻氧化应激,从而改善脑I/R损伤后的认知功能障碍,进而对脑I/R损伤发挥保护作用。此外,本研究结果显示,Klotho敲低逆转了抑制miR-199a-5p对OGD/R诱导的PC12细胞的保护作用。以上研究结果说明,抑制miR-199a-5p可能通过上调Klotho对脑I/R损伤发挥保护作用。
总之,本研究结果表明,抑制miR-199a-5p对脑I/R损伤的保护可能是其在OGD/R诱导的PC12细胞中抗氧化和抗炎作用的结果,且Klotho有助于抑制miR-199a-5p表达对神经损伤的保护作用。这些结果可能为减轻脑I/R损伤提供新的策略,并为未来脑I/R损伤的研究提供帮助。然而,本研究尚存在一些局限性。目前尚不清楚miR-199a-5p直接靶向Klotho保护OGD/R诱导PC12细胞损伤的具体作用机制,这还需要进一步研究。此外,还需要在体内对脑I/R损伤模型进行研究,以进一步阐明miR-199a-5p对脑I/R损伤神经保护所涉及的具体机制。
