阿魏酸通过磷酸肌醇3激酶/丝氨酸/苏氨酸蛋白激酶途径保护大鼠免受心肌缺血/再灌注损伤
2022-10-25朱舜明张荣怀张学军邴森
朱舜明,张荣怀,张学军,邴森
作者单位:1陕西省人民医院心内一科,陕西 西安 710068;2西安市第三医院心内科,陕西 西安 710068
急性心肌缺血后,通过药物或机械干预恢复病人冠状动脉血流(再灌注)对于挽救病人心肌功能至关重要[1];但再灌注会引发病人机体局部氧化爆发和高水平炎症反应,进而引起心肌细胞损伤和细胞死亡,造成“再灌注损伤”[2]。改善急性心肌梗死的临床结局,探索减轻缺血-再灌注(Ischemia/Reperfusion,I/R)损伤的新型治疗药物,对于该病的临床诊断和治疗至关重要[3]。
阿魏酸(Ferulic acid)是一种广泛存在的酚类化合物,在诸如坚果、西红柿和当归(Angelica sinensis)等植物中均有发现,其对多种疾病具有良好的治疗活性[2]。阿魏酸能够通过抑制环氧合酶(COX-2)、前列腺素E2(PGE2)和肿瘤坏死因子-α(TNF-α)改善血管内皮功能[4]。此外,阿魏酸通过降低活性氧(ROS)水平,进而预防慢性炎症性疾病[5]。但对阿魏酸在心肌I/R所致细胞损伤中的作用目前仍未引起足够关注。
凋亡是程序性细胞死亡的主要类型,与I/R损伤紧密相关[6-7]。胱天蛋白酶(caspase)是介导程序性细胞死亡信号级联反应的关键因子,其中caspase-3被认为是重要的凋亡启动子[8]。尽管已证实磷酸肌醇3激酶/丝氨酸/苏氨酸蛋白激酶(Phosphoinositide 3-kinase/serine/threonine protein kinase,PI3K/Akt)途径调控着细胞增殖、分化和凋亡[9],但其在阿魏酸发挥神经保护作用中的分子机制还有待研究。
本研究自2018年10月至2019年7月通过结扎大鼠左冠状动脉前降支法构建心肌缺血再灌注大鼠模型,探究阿魏酸和PI3K/Akt的作用关系。
1 材料与方法
1.1 主要试剂和实验动物阿魏酸和LY294002购于美国Sigma Chemical公司。PI3K和Akt酶联免疫吸附测定(ELISA)试剂盒购于美国Cusabio Biotech公司。末端脱氧核苷酸转移酶介导的dUTP-生物素缺口末端标记(TUNEL)细胞凋亡检测试剂盒购于德国Roche Diagnostics公司。抗MDA5、SOD1、TNFα、IL-6、IL-1β、Caspase-3、Cleaved caspase-3、PI3K、p-Akt(Ser473)、Akt、eNOS、p-eNOS(Ser1177)、p-mTOR(Ser2448)和β-actin蛋白一抗购于美国Cell Signaling Technology公司。BCA蛋白定量分析试剂盒和二抗购于中国Beyotime Biotechnology公司。其余试剂均为分析纯。雄性Sprague-Dawley(SD)大鼠(200~220 g)由陕西省人民医院[SYXK(陕)2016-006]提供。本研究符合一般动物实验伦理学原则。
1.2 方法
1.2.1 实验动物及分组所有实验大鼠均可自由进食和饮水,饲养温度22~24°C,湿度50%~60%,12 h明暗循环。48只大鼠采用随机数字表法分为4组(n=12):(1)假手术组(sham组);(2)I/R模型组(I/R组);(3)阿魏酸+I/R组(Fer+I/R组);(4)阿魏酸+LY294002+I/R组(Fer+LY+I/R组)。
1.2.2 I/R大鼠模型建立及给药处理通过腹膜内注射戊巴比妥钠(45 mg/kg),待大鼠完全麻醉后,仰卧位固定。再分别接入动物呼吸机以及心电监护仪,于大鼠胸部左侧第5根肋骨处纵向切开,钝性分离肌肉组织,暴露胸腔。剪开心包膜后,用6-0丝线将冠状动脉左前降支(LAD)结扎。当监护仪指标显示脉搏减弱、左心室心肌颜色发白,并且其心电图的ST段显著抬高,表示结扎成功。结扎30 min后持续对大鼠灌注3 h,当ST段出现50%以上回落,则判定为I/R大鼠模型建立成功。
假手术组大鼠仅打开胸腔,不结扎。在I/R建模30 min前,假手术组和I/R组按100 mg/kg腹膜注射0.9%氯化钠注射液,Fer+I/R组大鼠腹膜内注射阿魏酸(10 mg/kg)。Fer+LY+I/R组大鼠在I/R建模30 min前腹膜内注射阿魏酸(10 mg/kg),再于麻醉后,LAD结扎前,通过尾静脉注射LY294002(0.3 mg/kg)。
1.2.3 HE染色脊椎脱臼法处死大鼠后,暴露胸腔后取出心脏,使用预冷生理盐水清洗,去除大血管及结缔组织,用滤纸拭干。再将大鼠左心室心肌用4%多聚甲醛溶液固定,石蜡包埋,横向切成4 μm厚切片,并用苏木精-伊红(HE)染色,在光学显微镜(IX51,Olympus,日本)下观察。病变程度量化:(-)无病变;(+)局部病变;(++)零星散布病变;(+++)融合性病变;(++++)大量块状病变。
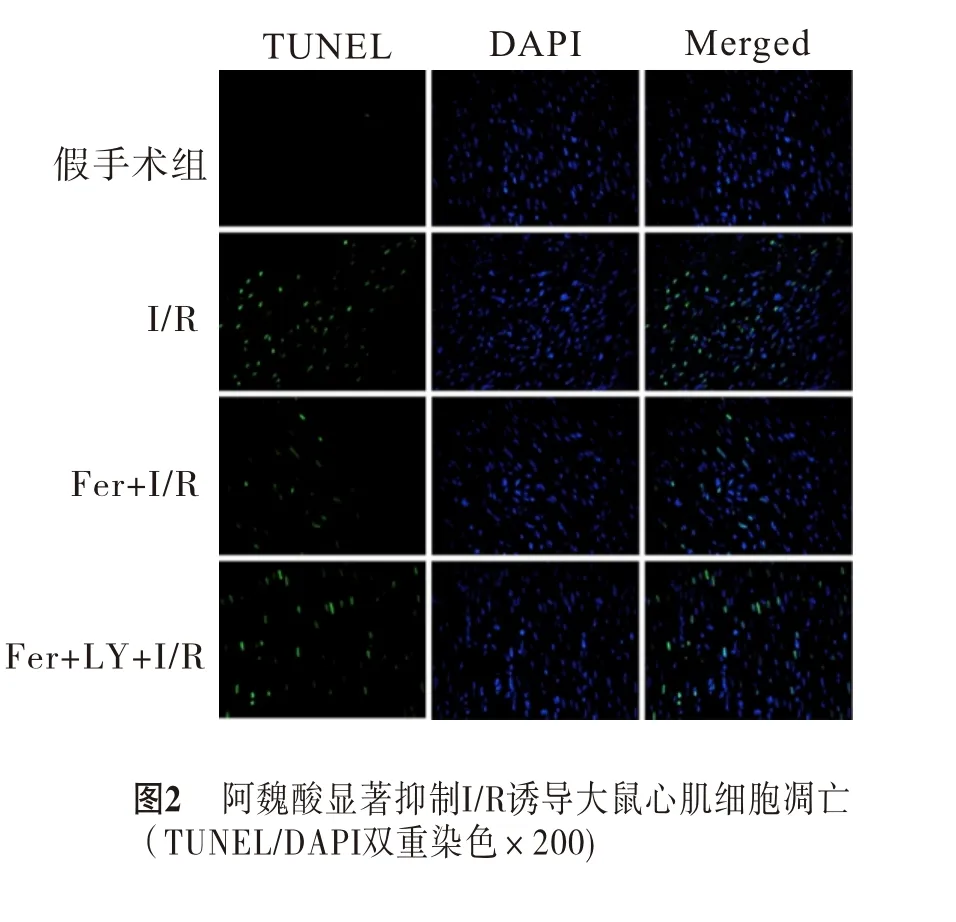
1.2.4 TUNEL法检测心肌细胞凋亡各组大鼠心脏组织经4%多聚甲醛固定,石蜡包埋后切片,使用商业试剂盒(Roche)进行TUNEL测定,以评估不同组大鼠心肌细胞凋亡程度。Fluorescein-dUTP着色为凋亡细胞数,呈绿色;4',6-diamidino-2-phenylindole(DAPI)着色为总细胞数,呈蓝色。为确定心肌细胞凋亡程度,每组随机选择6个视野(×200),使用Image Pro Plus 6.0计算细胞凋亡指数(apoptotic index,AI),AI=凋亡细胞数/总细胞数。
1.2.5 心肌超微结构观察分离大鼠心脏组织,先用磷酸盐缓冲液(0.1 mol/L,pH 7.4)清洗,再于4°C磷酸盐缓冲液中用1%四氧化锇固定2 h。使用Araldite CY212包埋后,通过超薄切片机(Ultracut E,Reichert,奥地利)制备70~80 nm超薄切片。再用乙酸铀酰和乙酸铅染色,在透射电子显微镜(Morgagni 268D,FeiCo,荷兰)下观察记录各组心肌细胞形态轮廓,线粒体和细胞核结构,以及闰盘Z线变化情况。
1.2.6 ELISA检测按照试剂盒说明书要求,使用PI3K和Akt ELISA试剂盒检测各组大鼠心肌组织中PI3K和Akt表达水平。
1.2.7 蛋白质印迹法(Western blotting)处死大鼠后开胸取出心脏,称取约200 mg心脏组织,剪碎并用磷酸盐缓冲液(0.1 mol/L,pH 7.4)清洗。再加入预冷RIPA裂解缓冲液提取总蛋白;裂解液在4℃、12 000 r/min离心5 min。使用BCA蛋白定量试剂盒测定总蛋白质浓度。将等量的蛋白样品通过SDSPAGE电泳分离,再转移到PVDF膜。将膜与5%脱脂牛奶在Tris缓冲液中4℃孵育过夜封闭。封闭膜后,再与抗MDA5、SOD1、TNF-α、IL-6、IL-1β、Caspase-3、Cleaved caspase-3、PI3K、p-Akt(Ser 473)、Akt、eNOS、p-eNOS(Ser1177)、p-mTOR(Ser2448)和β-actin一抗孵育过夜。用TBST洗涤3次,再与辣根过氧化物酶偶联的IgG室温孵育1 h。使用ECLPLUS系统检查蛋白质表达水平变化情况。通过Image Pro Plus 6.0软件进行灰度分析。
1.3 统计学方法所有计量数据均表示为±s,使用SPSS 16.0软件进行数据分析;多组数据比较采用单因素方差分析,多组间两两比较SNK-q法。P<0.05认为差异有统计学意义。
2 结果
2.1 阿魏酸干预明显减轻I/R大鼠心脏组织病理学变化通过苏木精-伊红染色对I/R诱导损伤和阿魏酸干预对大鼠心脏组织损害程度进行分析。染色结果显示,相较于假手术组,I/R组大鼠心肌中表现出明显的炎性细胞浸润、细胞膜损伤、细胞坏死和水肿。在Fer+I/R组大鼠中,心肌细胞坏死、炎性细胞浸润,及细胞水肿病变均明显低于I/R组,且心肌纤维结构更清晰完整(图1和表1)。
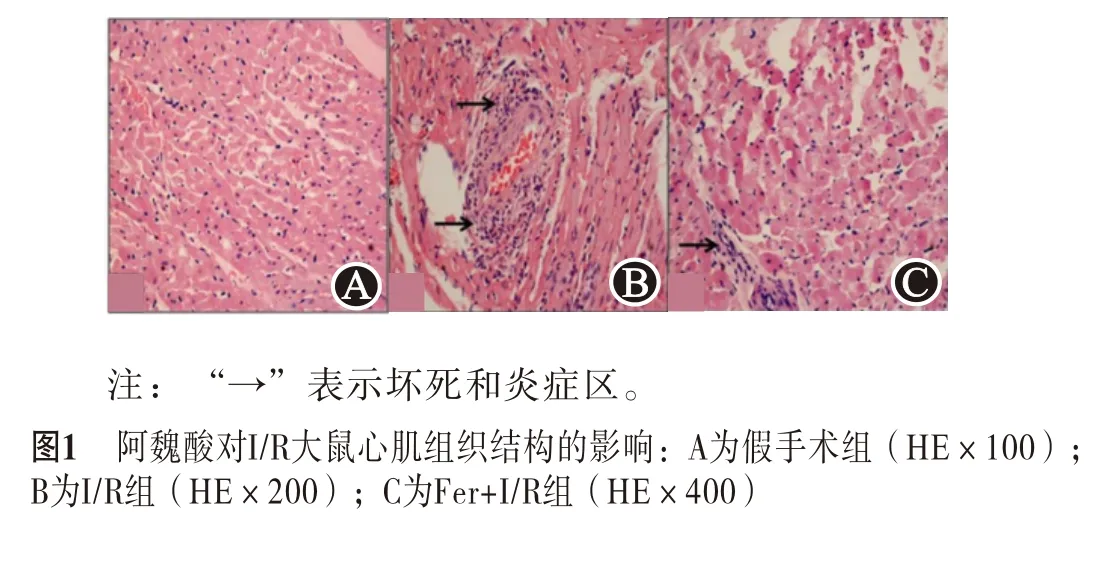
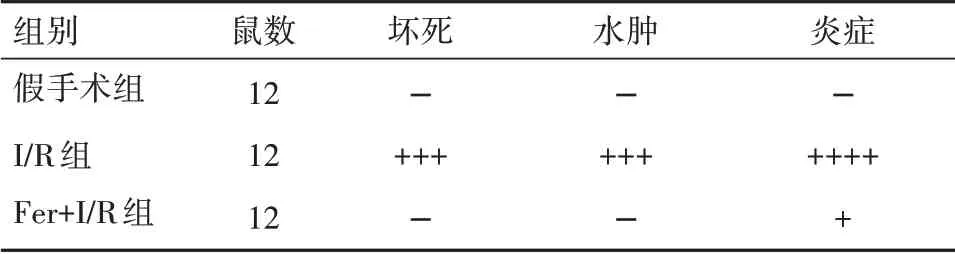
表1 不同实验组大鼠心肌组织病理学分级
2.2 阿魏酸干预抑制I/R大鼠心肌细胞凋亡TUNEL/DAPI双 重 染 色 结 果 显 示,I/R组[(55.45±1.14)%]大鼠存在严重的心肌组织损伤,Fer+I/R组[(18.73±1.01)%]大鼠TUNEL阳性心肌细胞百分比明显低于I/R组(P<0.001);Fer+LY+I/R组[(46.81±1.56)%]凋 亡 指 数 明 显 高 于Fer+I/R组(P<0.01)(图2)。
Western blotting分析结果表明,与I/R组(3.98±0.28)相比,Fer+I/R组(2.01±0.14)大鼠活性Cleaved caspase-3蛋白表达水平显著降低(P<0.05),而Fer+LY+I/R组(3.76±0.25)大鼠Cleaved caspase-3蛋白表达高于Fer+I/R组(P<0.05)(图3)。
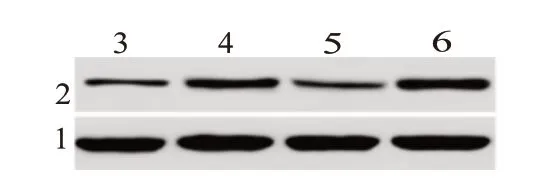
图3 阿魏酸显著抑制I/R诱导大鼠心肌细胞凋亡的Cleaved caspase-3免疫印迹结果
2.3 阿魏酸干预显著激活PI3K/Akt信号通路心肌组织PI3K和Akt蛋白ELISA检测结果显示,I/R组[PI3K:(14.58±0.96)ng/L;Akt:(0.27±0.07)μg/L]大鼠心肌组织中PI3K和Akt蛋白表达水平均低于假手术 组[PI3K:(21.32±1.26)ng/L;Akt:(0.38±0.08)μg/L];Fer+I/R组[PI3K:(27.52±2.73)ng/L;Akt:(0.72±0.15)μg/L]大鼠PI3K和Akt蛋白表达水平均明显高于I/R组(P<0.05)。
PI3K/Akt信号通路各蛋白Western blotting检测结果显示,与假手术组相比,I/R组大鼠PI3K、p-Akt和Akt蛋白表达水平明显下调,PI3K/Akt信号通路下游靶标p-eNOS(Ser1177)和p-mTOR(Ser2448)蛋白表达水平也明显低于假手术组(P<0.05);而Fer+I/R组上述蛋白表达水平均高于I/R组(P<0.05)(图4和表2)。
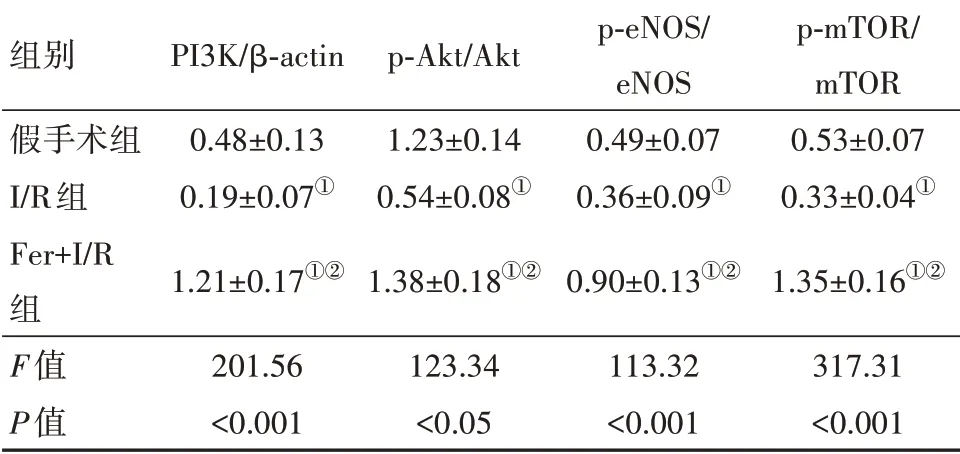
表2 PI3K/Akt信号通路相关蛋白的表达水平
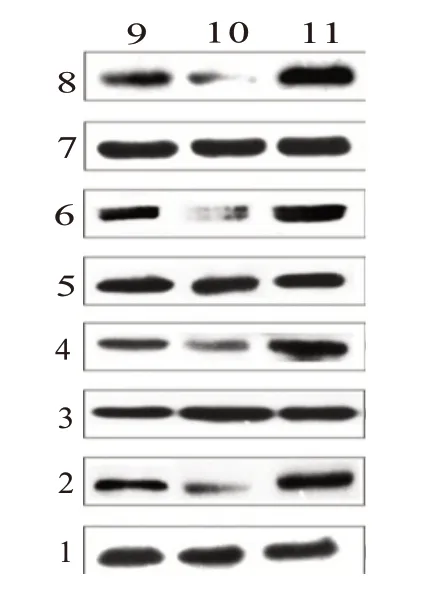
图4 PI3K/Akt信号通路相关蛋白的蛋白质印迹检测
2.4 阿魏酸干预可保护I/R损伤后大鼠心肌结构完整性TEM心肌超微结构分析结果显示,与假手术组相比,I/R组大鼠出现明显肌原纤维变性、线粒体肿胀、不规则线粒,以及心肌细胞闰盘Z线扭曲。在Fer+I/R组大鼠中,心肌细胞核及其线粒体结构均保持完整,没有明显的肌原纤维变性,与假手术组大鼠心肌组织结构相近。而Fer+LY+I/R组大鼠心肌组织细胞排列紊乱,有明显心肌纤维断裂,细胞变性坏死严重,其心肌超微结构病变与I/R组相似(图5)。
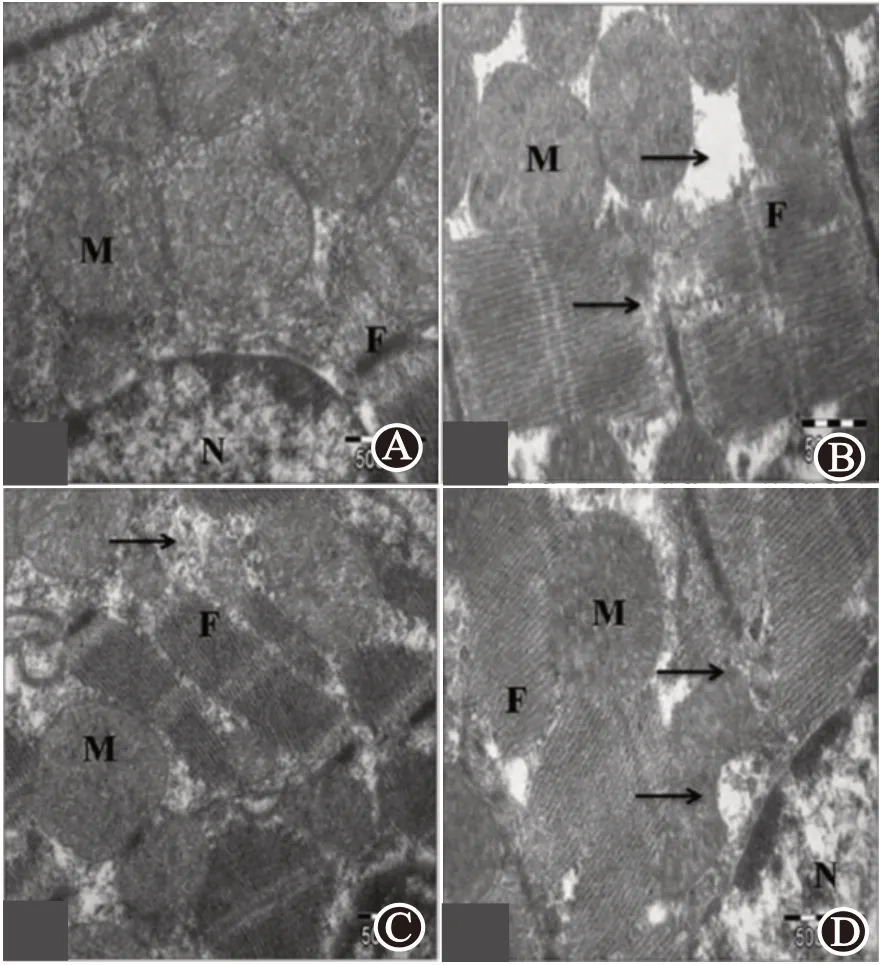
图5 阿魏酸显著改善I/R大鼠心肌超微结构:A为假手术组;B为I/R组;C为Fer+I/R组;D为Fer+LY+I/R组。
2.5 阿魏酸干预抑制I/R大鼠氧化应激和炎症反应Western blotting分析结果显示,与假手术组相比,I/R组大鼠MDA5蛋白表达水平,促炎细胞因子TNF-α、IL-6和IL-1β蛋白表达水平显著升高(P<0.05),SOD1蛋白表达水平明显降低(P<0.05)。与I/R组相比,Fer+I/R组大鼠MDA5、TNF-α、IL-6和IL-1β蛋白表达水平均显著下调(P<0.05),SOD1蛋白表达水平明显上调(P<0.05)。而与Fer+I/R组相比,Fer+LY+I/R组 大 鼠SOD1含 量 明 显 下 调,MDA5、TNF-α、IL-6和IL-1β蛋白表达表达水平显著上调(P<0.05)(图6和表3)。
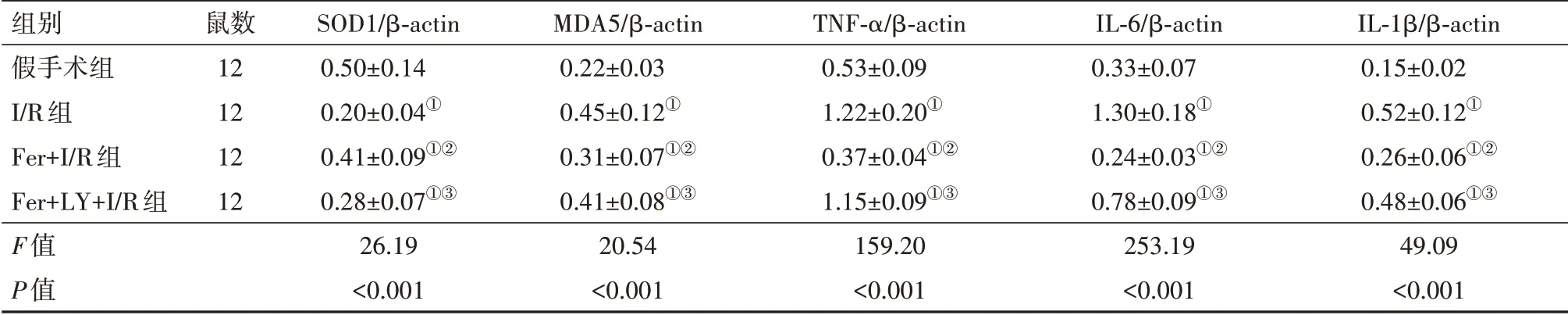
表3 I/R大鼠氧化应激和炎症反应相关蛋白的表达水平

图6 阿魏酸显著抑制I/R大鼠氧化应激和炎症反应水平
3 讨论
I/R是一个复杂的病理生理过程,涉及细胞凋亡、炎症反应和氧化应激调控[10]。研究显示诱导I/R后,大鼠心肌细胞损伤明显,出现典型的细胞凋亡表型[11];与永久性缺血大鼠相比,再灌注大鼠心肌细胞凋亡率也显著增加[12]。
I/R可能激活casepase凋亡蛋白级联反应。其中,caspase-3是细胞凋亡的重要调控因子,活性caspasse-3直接参与诱导蛋白质、酶和DNA等生物活性大分子降解。紫草素(Shikonin)和褪黑素(Melatonin)通过下调caspase-3表达,抑制内质网应激诱导的心肌细胞凋亡,明显缓解I/R模型动物心肌损伤[13-14]。本研究TUNEL/DAPI双重染色及Western blotting实验结果显示,假手术组大鼠未检测到心肌组织caspase-3过度激活;阿魏酸干预能显著下调I/R大鼠活性caspase-3蛋白表达水平,抑制心肌细胞凋亡,以减轻I/R大鼠再灌注期间心肌组织病理损伤。这表明,抑制I/R后心肌细胞凋亡是阿魏酸损伤发挥心脏保护作用的机制之一。
心肌再灌注期间通过激活PI3K/Akt信号通路,降低氧化应激,抑制炎症级联反应以及抑制心肌细胞凋亡,可以明显降低I/R损伤的发病率和死亡率[15-16]。受PI3K调控的Akt在Ser473位点磷酸化后激活[17],产生p-Akt,进一步刺激下游效应靶标,如eNOS、mTOR、NF-κB、Bcl-2蛋白家族和caspase蛋白家族[18],调节细胞凋亡和细胞转录活性,以提高心肌细胞存活率[9]。其中,eNOS磷酸化及其产生的NO在Akt介导的抗凋亡作用中发挥着关键作用[19]。因此,本研究研究了阿魏酸干预对PI3K/Akt信号通路关键调控蛋白表达的影响。免疫组化和蛋白质印迹检测结果显示,eNOS磷酸化水平增加与PI3K蛋白上调和Akt磷酸化同时发生。LY294002是一种特异性阻断PI3K细胞信号传导通路的蛋白激酶抑制剂[20],结合TEM心肌超微结构分析,发现Fer+I/R组大鼠心肌细胞核及其线粒体结构均保持完整;而阿魏酸+LY294002组观察到明显肌原纤维变性、线粒体结构不规则,以及Z线扭曲。LY294002处理逆转了阿魏酸对I/R大鼠心肌细胞的保护作用。上述结果表明,阿魏酸通过激活PI3K/Akt/eNOS途径保护I/R大鼠心脏免受I/R诱导损伤。
超氧化物歧化酶(Superoxide dismutase,SOD)是一种重要的抗氧化金属酶,通过调控胞内活性氧水平,在信号转导和物质代谢过程中发挥着重要作用[21]。细胞氧化应激失衡导致丙二醛(malondialdehyde,MDA)不断积累,对线粒体和溶酶体造成不可逆损伤[22]。IL-6、IL-1β和TNF-α等分泌型炎症调控因子表达水平失衡会明显加剧I/R病理发展[23]。本文实验结果显示,阿魏酸明显抑制I/R大鼠MDA5、TNF-α、IL-6和IL-1β蛋白质表达,并上调SOD1蛋白水平。这表明阿魏酸对I/R大鼠发挥心脏保护作用与其抗炎和抗氧化特性有关。
本研究也存在一定局限性。首先,尽管选择使用LY294002阻断PI3K/Akt信号通路,但关于LY294002是否对心肌组织存在影响并没有做详细的研究。在后续研究中,我们也将以大鼠为动物模型,进一步分析LY294002对大鼠心肌组织的作用,以期能够更为全面地解析阿魏酸对PI3K/Akt途径与大鼠心肌缺血再灌注损伤的影响关系。其次,本文结果仍需要结合临床研究数据做进一步佐证。
综上,阿魏酸干预可有效预防I/R大鼠心肌损伤。阿魏酸通过激活PI3K/AKT信号通路,减少心肌细胞凋亡,抑制炎症反应和氧化应激水平,以缓解I/R诱导心肌损伤。在未来,阿魏酸有望为临床预防I/R心肌损伤提供新的思路。
